吲哚胺2,3双加氧酶促进血管形成的体外实验研究①
魏丽娟 于津浦 贾志龙 李 慧 刘俊田 任秀宝 (天津医科大学附属肿瘤医院预防医学中心天津市肿瘤防治重点实验室 乳腺癌防治教育部重点实验室,天津300060)
吲哚胺2,3双加氧酶(IDO)是肝脏以外唯一催化色氨酸沿犬尿氨酸途径分解代谢的限速酶。研究发现多种肿瘤组织中表达IDO,并诱导局部免疫抑制引起患者预后不良[1-4]。本课题组前期工作中发现乳腺癌组织局部高表达IDO,并且可以诱导局部T细胞的活化[5],进一步研究发现局部表达的IDO和CD105标记的微血管密度相关[6]。本研究旨在通过细胞学实验观察IDO对HUVEC细胞形成管样结构的能力影响,为进一步研究IDO促进血管形成的机制提供实验基础。
1 材料与方法
1.1 细胞培养 人乳腺癌细胞系MDA-MB-231、MDA-MB-435S、MDA-MB-453、SK-Br-3、T47D、ZR-75-1、MCF-7及HUVEC细胞系均由天津医科大学附属肿瘤医院免疫室提供,MDA-MB-435S细胞在含10%FBS的DMEM细胞培养基中,5%CO2、37℃条件下单层贴壁培养;其余细胞在含10%FBS的RPMI1640细胞培养基中,5%CO2、37℃条件下单层贴壁培养。
1.2 逆转录聚合酶链反应(RT-PCR)检测IDOmRNA的水平 TRIZoL试剂(Gibco公司)一步法提取总RNA、紫外分光光度计测纯度与浓度。IDO和β-actin引物均由大连宝生物公司设计并合成,引物序列见表1。采用SuperscriptⅡ逆转录试剂盒进行RT反应,总体系20 μl。反应条件:94℃预变性5分钟;94℃变性30秒,58℃退火30秒,72℃延伸1分钟,30个循环;72℃完全延伸10分钟。PCR产物加入1%琼脂糖凝胶中,在0.5×TBE中进行电泳,紫外光下拍照记录。
1.3 氨基酸分析仪检测IDO活性 收集培养72小时后且生长状态良好的MCF-7细胞上清。取2 ml样品加入磺基水杨酸0.1 g,4℃ 18 000 r/min离心30分钟,取上清液。测定条件:仪器为日立L-8800型全自动氨基酸分析仪;分离柱径为4.6 mm×60 mm,离子交换树脂 2622 SC型;缓冲液泵压力6.90~7.90 kpa,流速 4.0 ml/min,茚三酮泵压力0.89~1.00 kpa,流速 3.5 ml/min;分离柱柱温57℃,反应柱柱温134℃。上机检测培养上清中游离氨基酸含量。
1.4 共培养体系的建立 取对数生长期的MCF-7和HUVEC细胞离心,调整HUVEC细胞浓度为1×105ml-1,调整MCF-7浓度至5×104ml-1。取1.5 ml HUVEC细胞接种于共培养模型的下室,上室分别接种0.5 ml的HUVEC,MCF-7和MCF-7细胞共三组,最后一组的培养液中含1-MT(终浓度为1 mmol/L)。取24、48、72小时三个时间点收集细胞,进行细胞计数及流式检测。
1.5 流式细胞仪检测CD105表达 将收集制备好的单细胞悬液置于Eppendorf管中,每管5×105个细胞,12 000 r/min离心3分钟,弃上清,体系定为20 μl,混匀。每管加入 anti-105-FITC 10 μl,对照管中加入 anti-IgG2α-FITC 10 μl。充分混匀后4℃避光孵育40分钟。PBS缓冲液洗涤,100 μl 1%多聚甲醛固定,上机检测。
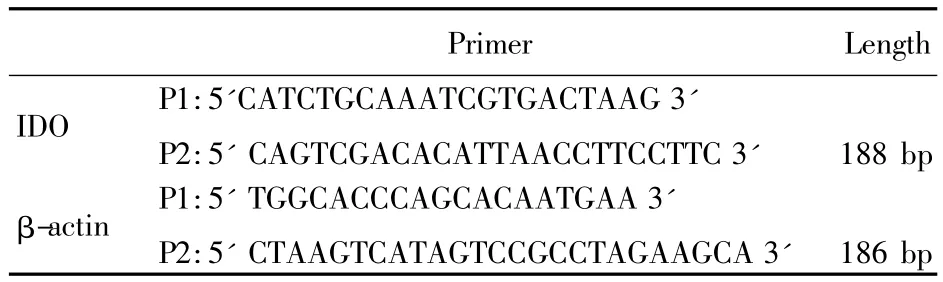
表1 人IDO和β-actin的引物序列和扩增长度Tab.1 The primer and amplification length of IDO and βactin
1.6 基质胶(Matrigel)成管实验 取预冷的基质胶50 μl/孔均匀涂布96孔平板,置于37℃孵箱中30分钟,将制备好的不同状态的HUVEC接种于基质胶表面,培养6小时起不同时间点观察细胞间连接形成的中空管样结构。实验重复3次。
1.7 统计学分析 采用SPSS13.0对数据进行统计分析,均数的比较采用独立样本t检验和单因素方差分析,规定双侧检验P<0.05为差异有统计学意义。
2 结果
2.1 不同细胞系中IDO基因的表达 人乳腺癌细胞系 MDA-MB-231、MDA-MB-435S、MDA-MB-453、SK-Br-3、MCF-7、T47D、ZR-75-1,半定量 RT-PCR 法检测IDO基因的表达情况如下:IDO表达细胞系为MDA-MB-435S、T47D、MCF-7;在 MDA-MB-231、MDA-MB-453、SK-Br-3、ZR-75-1 各细胞系中亦有IDO表达(图1)。
2.2 MCF-7细胞中IDO蛋白的表达活性 培养上清中可检测到(8.12±1.01)mg/L的犬尿氨酸,而色氨酸未检出(<3 pmol),表明MCF-7细胞中IDO的表达可以降解色氨酸,具有功能活性(图2)。
2.3 IDO对HUVEC增殖的影响 以1×105ml-1的HUVEC种植于Transwell小室下层记为第1天,取第2、3、4天时间点,利用细胞计数法计数细胞数量,绘制细胞生长曲线(图3)。共培养24小时时发现与MCF-7共培养后的HUVEC与另两组差异均有统计学意义(P<0.05)。继续共培养48和72小时后,均数间比较有统计学差异。

图1 细胞系中IDO阴性及阳性表达的筛选Fig.1 Analysis of IDO expression in different cell lines by agarose gel electrophoresis
2.4 流式细胞仪检测CD105表达 共培养24小时时组间均数比较:各组两两比较差异均有统计学意义,P<0.05。继续共培养48、72小时后,组间均数比较与24小时情况一致。组内均数比较:三组内24、48、72小时时两两比较差异均有统计学意义,P <0.05(图4、表2)。
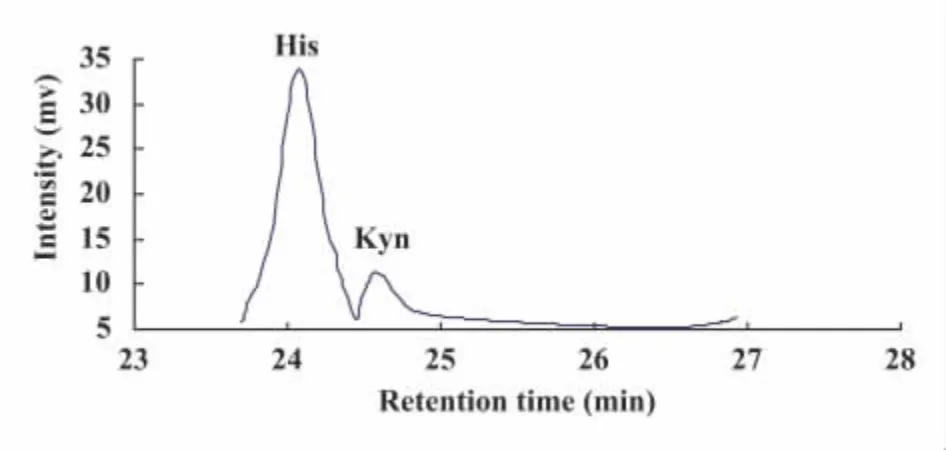
图2 氨基酸分析仪检测培养细胞上清中游离氨基酸Fig.2 Free amino acid in culture supernatant
2.5 IDO对HUVEC成管能力的影响 将三种不同处理方式的HUVEC分别平铺于基质胶,并连续观察其所形成的中空管样结构数目及形态。HUVEC在6小时时即有管样结构形成,并逐渐增多,至24小时形成的管样结构数目最多,48小时后管样结构逐渐减少。与MCF-7共培养后的HUVEC管样结构数目较多,HUVEC细胞多呈复层排列。培养液中加入1-MT,与MCF-7共培养后的HUVEC几乎无管样结构存在(图5、表3)。
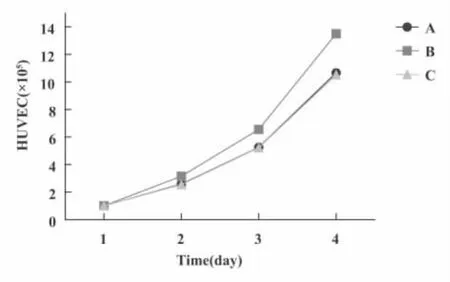
图3 IDO对HUVEC增殖的作用Fig.3 Evaluated the effects of IDO on proliferation of HUVEC
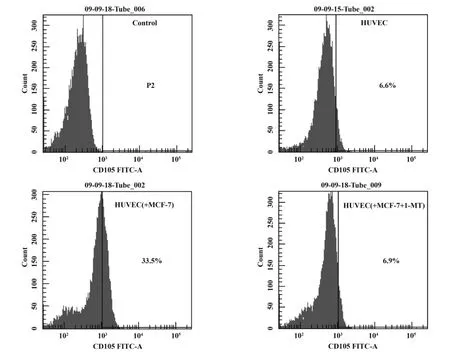
图4 不同共培养体系中HUVEC细胞CD105的表达率Fig.4 Evaluation of the CD105 expression in HUVEC by flow-cytometry analysis in different co-culture systems
表2 不同共培养体系中HUVEC-CD105表达率(±s)Tab.2 The CD105 expression in HUVEC in co-culture system(±s)
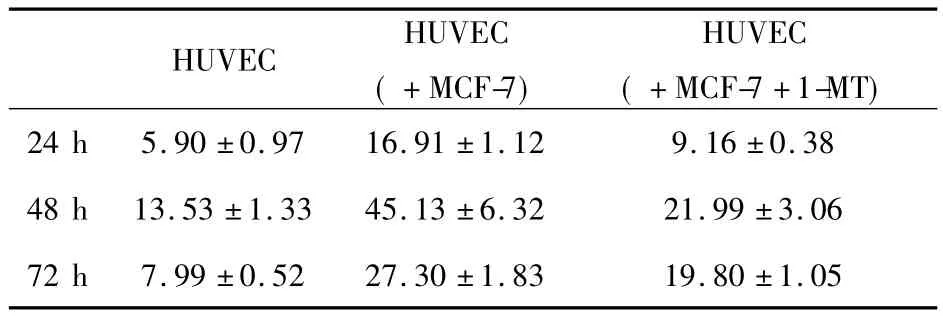
表2 不同共培养体系中HUVEC-CD105表达率(±s)Tab.2 The CD105 expression in HUVEC in co-culture system(±s)
HUVEC HUVEC(+MCF-7)HUVEC(+MCF-7+1-MT)24 h 5.90±0.97 16.91±1.12 9.16±0.38 48 h 13.53±1.33 45.13±6.32 21.99±3.06 72 h 7.99±0.52 27.30±1.83 19.80±1.05
表3 不同体系共培养后HUVEC细胞形成管样结构数目[(±s)/×40]Tab.3 The number of vessel-like structures in different co-culture systems[(±s)/×40]

表3 不同体系共培养后HUVEC细胞形成管样结构数目[(±s)/×40]Tab.3 The number of vessel-like structures in different co-culture systems[(±s)/×40]
HUVEC HUVEC(+MCF-7)HUVEC(+MCF-7+1-MT)6 h 4.33±1.00 14.00±1.22 1.00±0.87 12 h 6.00±0.86 16.67±1.12 1.33±0.71 24 h 7.44±1.42 19.67±2.00 2.00±0.71 36 h 4.22±0.67 17.56±1.42 1.22±0.67 48 h 3.56±0.88 15.22±1.2 0.67±0.71 72 h 2.67±0.71 12.33±1.22 0.44±0.72
3 讨论
IDO作为肝外色氨酸代谢过程中的限速酶,与自身免疫、移植免疫及母胎耐受等多种发病机制相关。Uyttenhove等[7]首先发现,大部分人肿瘤细胞高表达IDO,并且多数研究认为IDO高表达是独立的不良预后指标[1-4]。我们的前期研究发现在乳腺癌细胞中IDO的表达和肿瘤局部Treg细胞的分布密切相关,两者共同参与肿瘤的局部免疫耐受而加速肿瘤进展[5]。目前关于IDO与肿瘤的相关研究主要集中在肿瘤免疫耐受方面,IDO与重力血管形成相关的报道较少。Hiroaki[8]在研究IDO与卵巢癌疾病进展的关系时发现IDO通过抑制肿瘤局部NK细胞的增殖和促进血管形成加速卵巢癌的进展,该研究利用基因转染的方式获得表达IDO的卵巢癌细胞系OMC-1/IDO,体内试验发现IDO可以促进肿瘤生长和转移,同时免疫组化结果显示OMC-1/IDO肿瘤组织中每高倍视野平均有(8±1)个新生血管而OMC-1肿瘤组织中仅为(3±1)个,具有统计学差异。本课题组前期工作中发现乳腺癌组织局部高表达IDO且与CD105标记的微血管密度成正相关[6],本研究旨在通过细胞学实验观察IDO对HUVEC细胞成管能力的影响,为进一步研究IDO促进血管形成的机制提供实验基础,从而为研究肿瘤的发生发展机制提供新的思路。
CD105是一种增殖相关蛋白,与CD31、CD34等泛内皮标志物相比,CD105能更准确地反映内皮细胞的增殖。Charpin等[9]对360例乳腺癌石蜡标本进行了CD31、CD105的检测,经过14.3年的随访发现,CD105与患者总生存和无转移生存显著相关,而CD31与患者预后无关。Kumar等[10]采用抗CD105抗体观察了106例乳腺癌组织中微血管密度与病人预后的相关性,多因素分析显示用CD105测定微血管密度值是一个独立的预后指标。我们利用流式细胞仪检测了 HUVEC表面CD105的表达情况,与MCF-7共培养后HUVEC表面CD105的表达率较独立培养的HUVEC表达率更高,但是在共培养中加入IDO抑制剂1-MT后,HUVEC的增殖以及其表面CD105的表达率均受到抑制,这提示我们IDO在HUVEC的增殖以及活化中发挥了一定的作用。基质胶成管实验显示肿瘤细胞可以明显促进HUVEC细胞间的细胞连接增多,管样结构形成增多,加入1-MT后,管样结构减少,进一步验证了IDO可以加速新生血管形成。
本实验中我们利用Transwell小室共培养模型,观察到体外环境中IDO能够提高HUVEC成管能力,但是其具体机制有待于进一步研究。Li等[11]的研究发现在异种移植皮肤内IDO能够诱导血管形成。体内实验发现经腺病毒转染高表达IDO的成纤维细胞移植片的伤口毛细血管样管腔的数量在第8天会明显增加。该研究认为其机制与色氨酸代谢产生的犬尿氨酸引起的毒性反应无关,而与色氨酸缺乏有关,环境中的色氨酸缺乏作为刺激因子引起了一系列的反应从而促进了内皮细胞的增殖、活化,形成毛细血管。我们的研究证实IDO可以促进HUVEC形成管样结构,其机制可能与色氨酸缺乏有关,具体机制有待于进一步研究。
1 Hagedorn H G,Nerlich A G.Microvessel density and endothelial basement membrane composition in laryngeal squamous cell carcinoma[J].Acta Otolaryngol,2000;120(7):891-898.
2 Munn D H,Zhou M,Attwood J T et al.Prevention of allogeneic fetal rejection by tryptophan catabolism[J].Science,1998;281(5380):1191-1193.
3 Uyttenhove C,Pilotte L,Theate I et al.Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J].Nat Med,2003;9(10):1269-1274.
4 Munn D H,Sharma M D,Hou D et al.Expression of indoleamine 2,3-dioxygenase by plasmacytoid dendritic cells in tumor-draining lymph nodes[J].J Clin Invest,2004;114(2):280-290.
5 魏丽娟,于津浦,丛义滋et al.吲哚胺2,3-双加氧酶参与乳腺癌患者免疫耐受的研究[J].中国免疫学杂志,2009;25(11):987-990,995.
6 刘俊田,魏丽娟,于津浦 et al.吲哚胺2,3-双加氧酶在乳腺癌中的表达及其与预后的关系[J].中华肿瘤学杂志,2011;33(7):513-516.
7 Uyttenhove C,Pilotte L,Theate I et al.Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J].Nat Med,2003;9(10):1269-1274.
8 Hiroaki Nonaka,Yasushi Saga,Hiroyuki Fujiwara et al.Indoleamine 2,3-dioxygenase promotes peritoneal dissemination of ovarian cancer through inhibition of natural killercell function and angiogenesis promotion[J].Inter Oncology,2011;38:113-120.
9 Charpin C,Dales J P,Garcia S et al.Tumor neoangiogenesis by CD31 and CD105 expression evaluation in breast carcinoma tissue microarrays[J].Clin Cancer Res,2004;10(17):5815-5819.
10 Kumar S,Ghellal A,Li C et al.Breast carcinoma:vescular density determined using CD105 antibody correlates with tumor prognosis[J].Cancer Research,1999;59:856-861.
11 Li Yunyuan,Edward E,Abdi G et al.Local expression of indoleamine 2,3-dioxygenase protects engraftment of xenogeneic skin substitute[J].Invest Dermatology,2006;126:128-136.