促红细胞生成素对荷瘤小鼠免疫功能的影响①
刘月彩 耿玉兰 刘泽世 沈 莉 单保恩 (河北医科大学第一医院检验科,石家庄050031)
肿瘤的发生和发展是多种因素作用的结果。机体免疫功能在控制肿瘤的发生和发展方面发挥着重要的作用,机体免疫监视功能的下降,肿瘤细胞产生的免疫抑制因素以及肿瘤细胞的免疫逃逸作用等是肿瘤发生和发展的原因之一[1,2],因此,提高机体的免疫功能,就有可能起到抗肿瘤的作用。促红细胞生成素(Erythropoietin,EPO)是一种分子量约为30.4 kD的糖蛋白激素,EPO主要生理功能是作用于骨髓造血细胞,促进红系祖细胞增殖、分化和成熟,临床上主要用于治疗肾脏疾病、癌症及放化疗等引起的贫血。EPO对提高血红蛋白水平,减少输血需求,提高患者生活质量发挥着重要作用。近年来发现,EPO 对免疫系统有着广泛的影响[3,4],但对免疫系统影响主要来自于EPO治疗肾衰竭贫血患者的研究,而有关EPO对肿瘤患者免疫功能影响的研究鲜有报道。本文旨在探讨EPO对荷瘤小鼠红细胞(RBC)、白细胞(WBC)、红细胞压积(Hct)、血红蛋白(Hb)含量、T淋巴细胞亚群分布和血清细胞因子含量的影响,以期对EPO用于临床治疗肿瘤相关性贫血和估计预后提供理论依据。
1 材料与方法
1.1 材料 小鼠黑色素瘤细胞株B16由河北医科大学第四医院科研中心提供,5~6周龄C57BL/6小鼠,雄性,体重18~20 g,购自中科院北京实验动物中心(合格证号:Scxk京-2005-0013);RPMI1640和胰蛋白酶购自美国Gibco公司;胎牛血清购自杭州四季青生物有限公司;EPO购自华北制药有限公司;FITC标记的抗小鼠CD8单克隆抗体(mAb)及PE标记的CD4 mAb均购自eBioscience公司;小鼠TNF-α和IL-2 ELISA试剂盒购自ADL公司。
1.2 方法
1.2.1 细胞培养 B16细胞用含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI1640培养基,于37℃、5%CO2培养箱中培养,以0.25%的胰蛋白酶消化细胞传代,取对数生长期细胞用于实验。
1.2.2 动物实验 C57BL/6小鼠18只随机分为3组:正常对照组、盐水处理组和EPO处理组,每组6只。除正常对照组外每只小鼠右前腋皮下注射B16细胞1×106个/0.2 ml。每天观察小鼠成瘤情况。盐水处理组:按EPO用法和用量腹腔内注射生理盐水。EPO处理组:于第5天观察到小鼠成瘤后,腹腔注射EPO 60 U/kg,每周3次,连用2周,其用法和用量参考文献[5]。正常对照组:不做任何处理。每天观察小鼠的一般状况。
1.2.3 小鼠外周血中RBC、Hb、Hct和WBC的测定于停药后次日,将各组小鼠摘眼球放血,EDTA抗凝,应用 ACTdiff2血细胞分析仪测定外周血中RBC、Hb、Hct和 WBC 含量。
1.2.4 EPO对小鼠脾脏脏器指数的影响 取血后将各组小鼠处死,准确称量动物体重、脾脏重量,按公式计算脾脏脏器指数。脾脏脏器指数(Spleen index,SI)=脾脏重量(mg)/体重(g)。
1.2.5 小鼠脾脏T细胞亚群的检测 将各组小鼠处死后,无菌摘取脾脏,制备脾细胞悬液,调整细胞浓度为1×107ml-1,取0.1 ml于试管中,分别加入荧光标记的小鼠抗CD4+和CD8+T单克隆抗体,振荡混匀,室温避光放置30分钟,PBS洗涤后,用流式细胞仪分析脾淋巴细胞CD4+、CD8+T百分率,计算CD4+/CD8+T比值。
1.2.6 小鼠血清TNF-α和IL-2含量测定 将1.2.3所取血液静置后离心(3 000 r/min,10分钟),取血浆,用ELISA检测试剂盒测定血清中TNF-α、IL-2的含量,按试剂盒说明进行操作。在酶标测试仪上测定各样本492 nm处吸光度值。根据标准曲线计算出血清中细胞因子的含量。
1.3 统计学分析 所有数据采用SPSS13.0统计学软件进行统计分析,实验结果以±s表示,两个独立样本均数比较用t检验,各组均数间比较用单因素方差分析。P<0.05表示有统计学差异。
2 结果
2.1 EPO对小鼠外周血中 RBC、Hb、Hct和 WBC的影响 与正常小鼠相比,盐水处理组小鼠RBC、Hb和Hct水平显著降低(P<0.05);与盐水处理组相比,EPO可有效提高荷瘤小鼠RBC、Hb和Hct水平(P<0.05),与正常小鼠相比无统计学差异(P>0.05)。三组小鼠外周血中WBC数量无明显差异(P >0.05,表1)。
2.2 EPO对小鼠脾脏脏器指数的影响 EPO处理组和盐水处理组荷瘤小鼠的脾脏重量较正常对照组增加,脾脏脏器指数明显高于正常小鼠(P<0.05)。EPO处理组小鼠的脾脏脏器指数明显高于盐水处理组(P <0.05,表1)。
2.3 EPO对小鼠脾T细胞亚群的影响 盐水处理组及EPO处理组荷瘤小鼠脾脏CD4+T细胞百分率及CD4+/CD8+T比值明显低于正常小鼠(P<0.05),EPO处理组与盐水处理组相比,CD4+T小鼠脾细胞百分率无差别(P>0.05),CD8+T细胞百分率下降(P<0.05),CD4+/CD8+T比值升高(P<0.05,图1和表2)。
2.4 EPO对小鼠血清中细胞因子含量的影响 盐水处理组及EPO处理组荷瘤小鼠血清中TNF-α、IL-2含量明显低于正常小鼠(P<0.05),盐水处理组及EPO处理组荷瘤小鼠血清中TNF-α含量无差别(P>0.05),EPO处理组小鼠血清中IL-2水平与盐水处理组相比明显增高,有统计学差异(P<0.05,图2)。
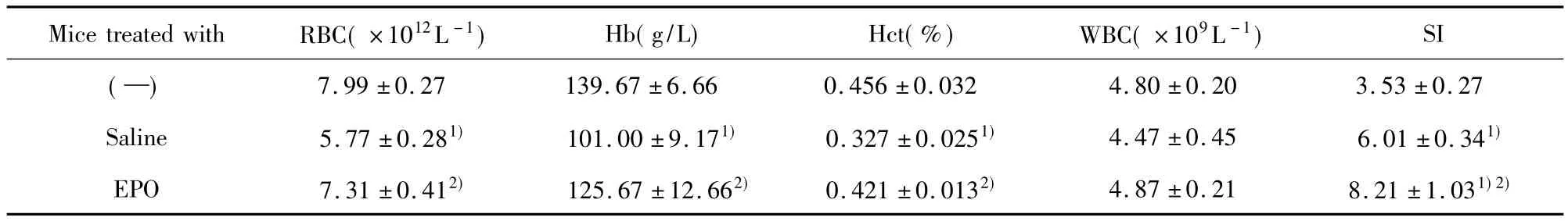
表1 EPO对荷瘤小鼠外周血中RBC、Hb、Hct和WBC及脾脏脏器指数的影响Tab.1 Effects of EPO on levels of RBC,Hb,Hct and WBC in peripheral blood and spleen index in tumor-bearing mice
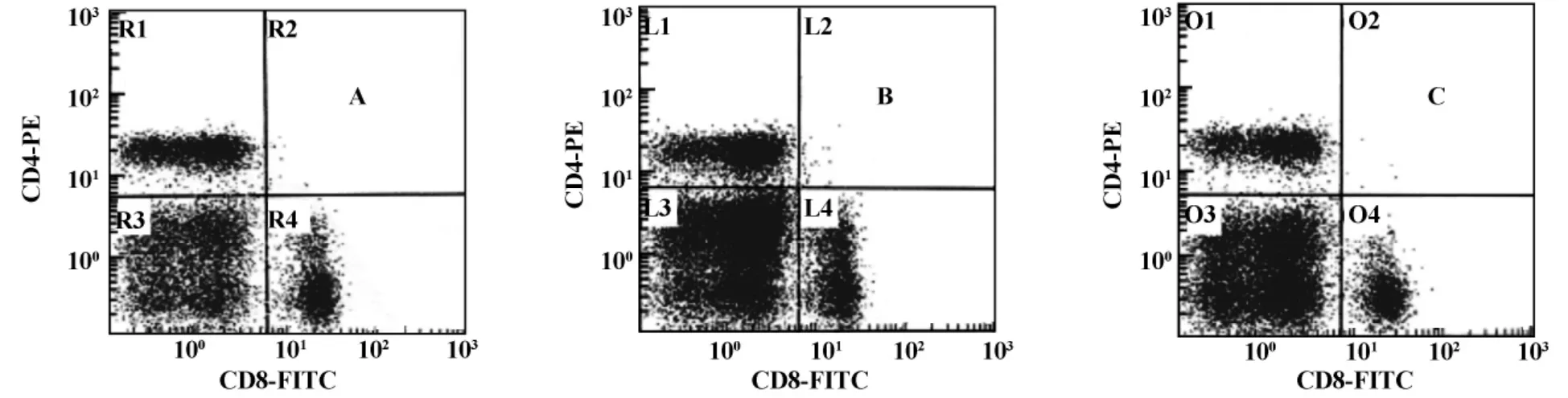
图1 EPO对小鼠脾T细胞亚群的影响Fig.1 Effects of EPO on T cell subsets of mice spleen analyzed by FCM
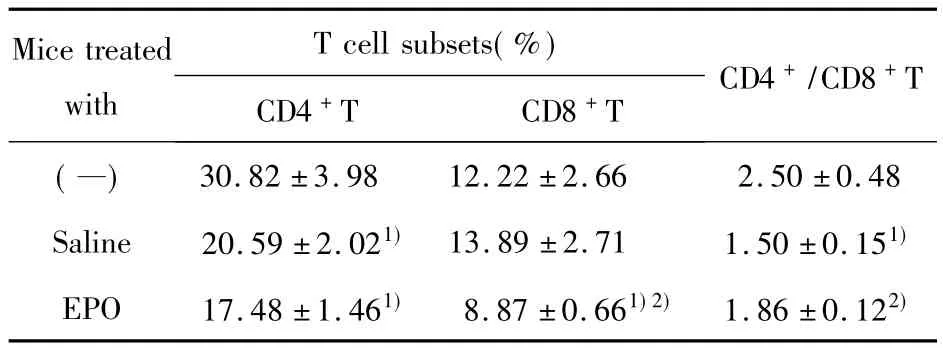
表2 EPO对小鼠脾T细胞亚群的影响Tab.2 Effects of EPO on T cell subsets of mice spleen
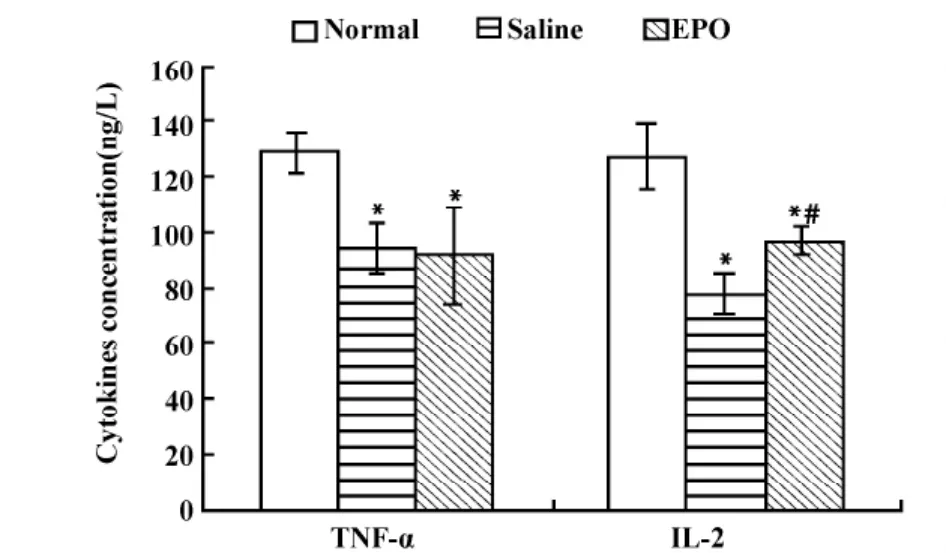
图2 EPO对小鼠血清中TNF-α和IL-2含量的影响Fig.2 Effects of EPO on TNF-α and IL-2 level in serum from mice
3 讨论
促红细胞生成素是治疗肾性贫血的首选药物,近年来用于肿瘤相关性贫血的治疗也取得较好的效果[6]。近来研究发现,EPO及EPOR广泛分布在非红细胞类型的细胞上[7]。不但对血液系统,而且对免疫系统、神经系统、心血管系统等均有影响[3,4,8-10]。本实验采用 C57BL/6 小鼠黑色素瘤细胞B16皮下移植瘤模型,从脾脏重量的变化、T细胞亚群分布、细胞因子分泌等方面研究EPO对小鼠免疫功能的影响。
本研究结果显示,盐水处理组荷瘤小鼠外周血RBC、Hb和Hct水平比正常对照组显著降低;与盐水处理组相比,EPO可有效提高小鼠外周血RBC、Hb和Hct水平,与正常对照组相比无差别。但EPO并未显著影响小鼠外周血中WBC的数量,三组小鼠外周血中WBC的数量没有明显差别。荷瘤小鼠脾脏重量较正常对照组增加,脾脏脏器指数明显高于正常小鼠。EPO处理组小鼠的脾脏脏器指数较盐水处理组增高,可能与其提高血液中RBC、Hb和Hct有关。
T细胞是构成免疫防御系统的重要因素,也是机体抗肿瘤特异性免疫应答的主体,包括CD4+辅助性T细胞和CD8+抑制性T细胞两个主要亚群,CD4+T细胞具有调节免疫反应活性、分泌细胞因子的作用,处于整个肿瘤免疫的核心位置,而CD8+T细胞则有免疫抑制和细胞毒性作用,二者相互变化、协调以维持机体的免疫平衡。本研究结果显示,EPO对荷瘤小鼠脾脏CD4+T细胞百分率无影响,EPO处理组荷瘤小鼠脾脏CD8+T细胞百分率与盐水处理组相比下降,致使CD4+/CD8+T比值水平升高。提示EPO可通过下调CD8+T细胞百分率而影响荷瘤小鼠的免疫功能。
细胞因子(Cytokine)是一类由活化的免疫细胞和相关基质细胞分泌,能作用于分泌细胞本身或其他细胞的生物活性物质,可参与机体的多种免疫调节,激发宿主对肿瘤的免疫反应,并可直接抑制恶性肿瘤的生长,在机体抗肿瘤免疫中具有重要意义[11,12]。TNF-α 是反映机体免疫功能的重要指标,产生于巨噬细胞和淋巴细胞,在肿瘤治疗中发挥着重要作用[13]。IL-2是细胞免疫应答所必需的细胞因子,通过多种途径发挥免疫调节作用[14,15]。IL-2主要由抗原激活的T细胞(主要是CD4+T亚群)产生,可促进细胞毒T细胞(CTL)增殖与分化,激活巨噬细胞和NK细胞。近几年来,IL-2还作为一种免疫制剂,在临床上用于治疗黑色素瘤,取得了一定效果;TNF-α及IL-2二者具有协同抗肿瘤效应[16]。结果显示,EPO没有显著影响荷瘤小鼠血清中TNF-α含量,但EPO处理组小鼠血清中IL-2水平与盐水处理组相比明显增高。表明EPO有可能通过促进免疫细胞分泌细胞因子IL-2,以改善机体免疫功能,从而提高机体对肿瘤的特异性免疫应答。
综上所述,黑色素瘤可引起小鼠外周血RBC、Hb、Hct水平和免疫功能的下降,应用EPO在改善荷瘤小鼠贫血状态的同时,又可通过改变血清中细胞因子的含量和血中T淋巴细胞亚群的比例来增强荷瘤小鼠的免疫功能。
1 Bubenik J.MHC class I down-regulation:tumour escape from immune surveillance[J].Int J Oncol,2004;25(2):487-491.
2 郝 群,李大金.免疫系统衰老的研究进展[J].上海免疫学杂志,2003;23(1):60-62.
3 李 宓,杜 艺,彭 莉et al.促红细胞生成素对尿毒症患者体液及细胞免疫功能的影响[J].中国免疫学杂志,2005;21(8):624-626.
4 徐家云,芦丹萍,张春荣et al.促红细胞生成素对腹透患者免疫功能的影响[J].陕西医学杂志,2004;33(3):228-229.
5 Sigounas G,Sallah S,Sigounas V Y.Erythropoietin modulates the anticancer activity of chemotherapeutic drugs in a murine lung cancer model[J].Cancer Lett,2004;214(6):171-179.
6 Gupta S,Singh P K,Bisht S S et al.Role of recombinant human erythropoietin in patients of advanced cervical cancer treated“by chemoradiotherapy”[J].Cancer Biol Ther,2009;8(1):13-17.
7 冯 玫,李玉翠.EPO与EPO受体的研究进展[J].白血病·淋巴瘤,2005;14(4):254-256.
8 康文清,朱长连,熊 虹et al.重组人促红细胞生成素治疗新生儿缺氧缺血性脑病的疗效[J].实用儿科临床杂志,2006;21(2):86-87.
9 郭洪波,邹 飞.红细胞生成素(EPO)对脑源性神经干细胞增殖与分化的调控作用[J].解放军医学杂志,2005;30(7):623-625.
10 杜心灵,叶 亮,夏家红et al.重组人红细胞生成素对大鼠心肌梗死的治疗作用[J].中华实验外科杂志,2004;21(11):1315-1316.
11 Salgaller M L,Lodge P A.Use of cellular and cytokine adjuvants in the immunotherapy of cancer[J].J Surg Oncol,1998;68(2):122-138.
12 Wong R J,Patel S G,Kim S.Cytokine gene transfer enhances herpes oncolytic therapy in murine squmous cell carcinoma[J].Hum Gene Ther,2001;12(3):253-265.
13 Younes A,Kadin M E.Emerging applications of the tumor necrosis factor family of ligands and receptors in cancer therapy[J].J Clin Oncol,2003;21(18):3526-3534.
14 Kikuchi T,Joki T,Abe T et al.Antitumor activity of killer cells stimulated with both interleuk in-2 and interleukin-12 on mouse glioma cell[J].J Immunother,1999;22(3):245-250.
15 Nishimura T,Ohta S,Sato N et al.Combination tumor immunotherpy with recombinant tumor necrosis factor and recombinant interleukin 2 in mice[J].Int J Cancer,1987;40(2):255-261.
16 Schiller J H,Morgan-Ihrig C,Levitt M L.Concomitant administration of interlenkin-2 plus tumor necrosis factor-α in advanced nonsmall cell lung cancer[J].Am J Clin Oncol,1995;18(1):47-51.