Poly(I:C)影响间充质干细胞的成骨分化及其对树突状细胞的作用①
赵晓寅 刘 丹 刘 柳 侯亚义 (南京大学医学院免疫与生殖生物学实验室,南京210093)
间充质干细胞(Mesenchymal stem cells,MSC)是一群中胚层来源的具有自我更新和多向分化潜能的多能干细胞,能够分化形成脂肪、骨和软骨等组织,除了具备多向分化潜能,MSC还具有低免疫原性和免疫调节能力[1]。同时,取材的广泛方便、体外扩增操作的简单迅速及其可塑性使得MSC在临床治疗中有广阔的应用前景。作为临床应用的希望,MSC治疗的相关研究已经在许多不同的疾病动物模型中展开,包括异体免疫排斥、器官和干细胞移植、自身免疫和肿瘤免疫等。
免疫细胞外源性和内源性表达的Toll样受体(TLR)对其在天然免疫和获得性免疫中抵抗入侵者起到十分关键的作用[2,3]。到目前为止,在哺乳动物中发现并确认的TLR有13个(人类10个和小鼠13个)。TLR能够识别细菌、病毒、真菌等多种病原相关分子模式及某些由宿主产生的分子[4]。TLR能够被他们特异的配体或激动剂活化,从而引起MyD88依赖的或TRIF依赖的下游信号分子的激活。这些信号通路的激活触发了下游各种细胞因子、趋化因子和其他炎症介质的分泌[5]。
近年来的研究发现,骨髓、脂肪和脐带来源的MSC都能够表达TLR,TLR信号的活化对MSC的分化、增殖和免疫调节功能的影响依然存在争议[6-15]。因此,本研究分析了TLR3配体——Poly(I:C)对脐带MSC表型、细胞增殖、凋亡、成骨分化以及免疫调节功能的影响。
1 材料与方法
1.1 材料 脐带取自南京大学医学院附属鼓楼医院妇产科,正常足月妊娠剖宫产胎儿的脐带。所用材料均严格遵守医学伦理道德,经产妇及家属认可,并经医院医学伦理委员会批准。DMEM/F12培养基、RPMI1640培养基和优级胎牛血清(Gibco公司);胶原酶 Ⅱ、中性蛋白酶和透明质酸酶(Sigma公司);小鼠抗人 PE-CD117、PE-CD44、PE-CD29、FITC-CD31、FITC-CD45和APC-CD105单克隆抗体(ebioscience公司);rmGM-CSF、rmIL-4(Miltenyi Biotec 公司);兔抗小鼠 PE-CD11c、Alexa Flour-CD11c、FITC-CD80、FITC-CD86和APC-MHC-Ⅱ单克隆抗体(ebioscience公司)。
1.2 人脐带来源间充质干细胞的分离培养 MSC分离及纯化按本实验室常规方法。从手术室取足月剖腹产的胎儿脐带,在无菌状态下用预冷的含0.01%青霉素和链霉素的PBS冲洗,去掉脐带内血块。在DMEM/F12基本培养基中,将脐动脉剥除,其余部分剪成2 mm3碎块,加入250 U/ml的胶原酶Ⅱ,100 U/ml中性蛋白酶,10 U/ml透明质酸酶,37℃振荡消化3小时至组织基本消化完全,离心去上清,洗3次,培养于DMEM/F12完全培养基中(含10%FBS)。调整细胞密度为1×109L-1于培养箱中培养(37℃恒温,5%CO2),3~4天后,轻轻晃动培养板,全量换液,待细胞丰度达80%左右时,用2.5 g/L的胰酶消化、传代。取第3~8代细胞,分析其表面标志,确定其为MSC后用于后续试验。
1.3 小鼠骨髓来源树突状细胞的分离与培养 4~6周的C57BL/6小鼠购自扬州大学比较动物中心,所有的小鼠适应环境1周后进行实验。DC细胞来源于小鼠的骨髓。将C57BL/6小鼠断颈处死,在无菌条件下取出胫骨和腓骨,置于无菌PBS中待用;使用注射器吸取PBS,反复冲洗骨髓腔,直至骨发白;将骨髓悬液用100目筛网过滤并收集到离心管中。4℃,1 200 r/min离心5分钟,弃上清,加入红细胞裂解液,静置2分钟后加入 PBS稀释,4℃,1 200 r/min离心5分钟,弃上清,加入 PBS混匀,4℃,1200 r/min离心5分钟后,收集沉淀的骨髓细胞。将收集的小鼠骨髓细胞重悬,调整细胞密度为1×106cells/ml,接种于12孔板中,每孔加入1 ml RPMI1640完全培养基(添加10%FCS胎牛血清,100 μg/ml的青霉素,100 μg/ml的链霉素,10 ng/ml的GM-CSF,1 ng/ml IL-4)。所有细胞置于37℃、5%CO2、饱和湿度条件下贴壁培养;第三天、第五天半量换液,移除不贴壁的细胞;培养至第六天,通过流式细胞仪鉴定,>90%的细胞均为CD11c阳性。
1.4 流式细胞仪检测表面标志
1.4.1 MSC表面标志的检测 胰酶消化细胞,PBS洗两遍,4℃,1 200 r/min,离心5分钟,弃上清;调整细胞密度约每管(1~5)×105个细胞。共三例脐带MSC,每个标记设三复孔,按照抗体说明书的用量加入同型对照和相应抗体,4℃避光孵育30分钟,PBS洗三次后,4℃,1 200 r/min,离心5分钟;用300 μl的PBS充分重悬细胞,最后在流式细胞仪上进行检测分析。MSC 检测标志为:CD117、CD29、CD31、CD44、CD105及CD45。
1.4.2 DC表面共刺激分子的检测 将骨髓单核细胞(5×105cells/孔)与MSC(5×104cells/孔) 于RPMI1640中(添加10%FCS胎牛血清,100 μg/ml的青霉素,100 μg/ml的链霉素,1 ng/ml IL-4,10 ng/ml GM-CSF)共培养6天,这时单核细胞诱导分化为未成熟的DC。向共培养体系中加入10 μg/ml的Poly(I:C)刺激24小时。由于MSC具有很强的贴壁性,而DC为半贴壁细胞,根据DC与MSC不同的贴壁特性,将DC于共培养体系中轻轻吹下回收,流式细胞仪检测了DC细胞表面CD86、CD40和MHCⅡ的表达情况。
1.5 CCK-8法检测细胞增殖 CCK-8法是一种基于 WST-8[2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐]的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测方法。将3~10代的MSC以104cells/孔的密度接种于48孔板中,细胞培养于DMEM/F12培养基中(含10%的FBS,100 μg/ml的青霉素,100 μg/ml的链霉素)。分别加入1、10、25 和50 μg/ml的 Poly(I:C)处理24小时和48小时,CCK-8检测细胞增殖。
1.6 Annexin V/PI双染法检测细胞凋亡 坏死细胞的Annexin V和PI呈双阳性,而凋亡细胞为Annexin V阳性,PI阴性,未凋亡细胞Annexin V和PI皆呈阴性。操作步骤:分别加入 1、10、25和50 μg/ml的Poly(I:C)处理MSC 24小时和48小时后,用不含EDTA的0.25%的胰蛋白酶消化,收集细胞于流式管中;PBS洗两遍,200 μl binding buffer复悬(约细胞 106个/ml),加入 2.5 μl Annexin V-FITC;混匀,室温避光作用10分钟;加入10 μl 25 μg/ml的PI,避光作用10分钟;流式细胞仪检测细胞凋亡。
1.7 流式细胞术检测DC吞噬能力 将处理后的DC轻轻吹下培养于24孔板中,加入0.2 mg/ml的FITC-dextran(右旋糖酐),于 37℃,5%CO2培养箱内孵育60分钟,另设4℃孵育作为对照。PBS洗3次后,每管加入300 μl的1.2 mg/ml台盼蓝重悬细胞,以淬灭胞外荧光。流式细胞仪检测FITC-dextran阳性细胞百分比。
1.8 混合淋巴细胞反应
1.8.1 小鼠淋巴结T细胞的获取 将BALB/c小鼠断颈处死,无菌条件下取腋下及肠系膜淋巴结置于预冷无菌的RPMI1640培养基中,除去多余的脂肪组织;用注射器针芯将淋巴结细胞轻轻挤出;加入5 ml培养基,反复吹打至细胞悬液均匀后,筛网过滤,收集细胞悬液,离心,弃上清,培养基洗一遍后,计数待用。
1.8.2 混合淋巴细胞反应 DC分为Control组、Poly(I:C)刺激组、MSC共培养+Poly(I:C)刺激组
(MSC∶DC=1∶10或1∶20)。将T细胞用 CFSE 标记后铺于96孔板中,调整细胞浓度为5×106ml-1,每孔加入100 μl T细胞后,各处理组的DC与T细胞按1∶10的比例加入培养体系中,终体积为200 μl/孔,每组设4个复孔。置于37℃,5%CO2培养箱内培养三天后,流式检测T细胞增殖情况。
1.9 茜素红S染色 茜素红染色的原理是基于沉积的钙可以与茜素红发生显色反应并在细胞外基质中被染成橘红色。将培养板用PBS洗2次,95%的乙醇固定10分钟,双蒸水冲洗3次;0.1%茜素红-Tris-HCl(pH8.3)37℃染色30分钟;蒸馏水冲洗后显微镜下观察。
1.10 Q-PCR检测mRNA表达 用Trizol试剂提取MSC中总的RNA,检测RNA浓度及纯度后,进行反转录。反转录体系(20 μl):1 μg RNA,4 μl 5 × RT buffer,2 μl dNTP,0.5 μl RNase inhibitor,0.5 μl Oligo dT,0.5 μl ReverTra Ace,加 DEPC 水至 20 μl;反应程序:42℃ 20分钟,99℃ 5分钟,4℃ 5分钟。反转录后得到的cDNA进行随后的Q-PCR。Q-PCR反应体系(10 μl)为:1 μl cDNA(反转录产物按1∶10稀释),0.5 μl上游引物,0.5 μl下游引物,5 μl 2 ×TransStart SYBR Green QPCR Supermix,3 μl ddH2O。Q-PCR反应程序:95℃ 10分钟;95℃ 15秒,60℃ 30秒,72℃ 30秒(40个循环,72℃收集信号);95℃ 15秒,60℃ 30秒,95℃ 15秒(1个循环,熔解曲线)。反应在ABI StepOnePlus荧光定量PCR仪中进行,得到各个基因的Ct值,使用2-ΔΔCt方法分析目的基因表达,以GAPDH作为内参。每实验组设置3个重复,每个样本设置三个复孔。所用基因的引物由Invitrogen合成,引物序列如表1。
1.11 统计学分析 所有实验数据均重复三次以上,结果以±s表示,使用 Prism 5(GraphPad Software,Inc.,San Diego,CA)对实验数据进行统计学分析并作图。One-way ANOVA analysis用来分析3组及以上数据的差异。P<0.05时,差异具有显著性。
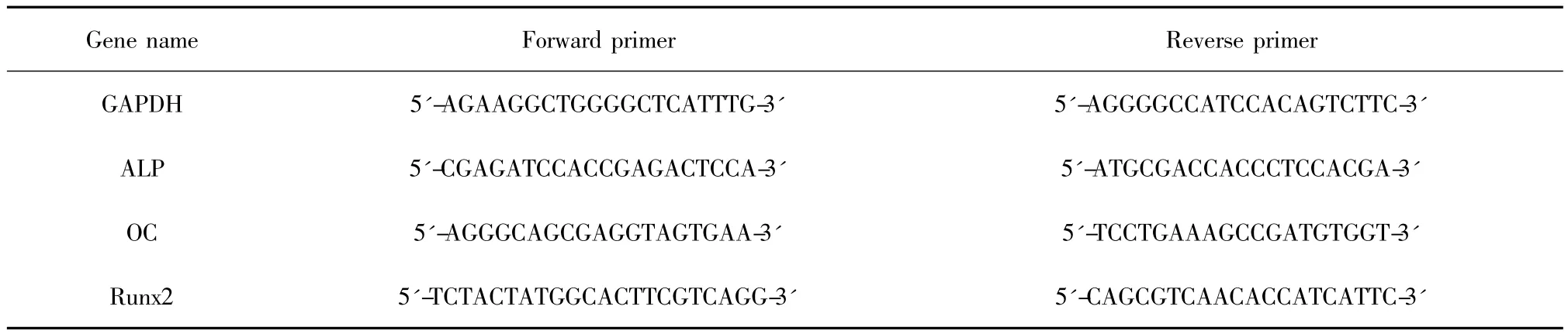
表1 mRNA上下游引物序列Tab.1 The primer sequences used in PCR
2 结果
2.1 Poly(I:C)不改变MSC的表型 取第3~8代的MSC,以105个/孔的密度接种于6孔板中,Poly(I:C)刺激48小时后,流式细胞仪检测Poly(I:C)的刺激对MSC表型的影响。结果显示,Poly(I:C)处理的MSC对CD29、CD44(纤维蛋白和透明脂酸盐的受体,基质细胞表达)和CD105(即SH-2)表达呈阳性,CD31(内皮细胞标志)、CD45(造血细胞标志)和CD117(多能造血干细胞标志)的表达呈阴性,与对照组MSC相同,Poly(I:C)不会影响MSC的表型(图1)。经3代以上传代后,细胞成分均一,纯度在95%以上。
2.2 Poly(I:C)影响MSC的增殖和凋亡 将MSC以2×104个/孔铺于48孔板中,分别用1、10、25和50 μg/ml的 Poly(I:C)刺激 MSC 24或48小时,CCK-8检测对MSC细胞增殖的影响,结果发现,1~50 μg/ml的 Poly(I:C)处理 MSC 24和 48小时,OD450的值均不发生改变,TLR3的活化不会影响细胞的增殖(图2A)。随后,我们用Annexin-V/PI双染法检测不同浓度Poly(I:C)的刺激对MSC细胞凋亡的影响,结果发现,低浓度的Poly(I:C)刺激对MSC没有影响,而Poly(I:C)浓度达到25 μg/ml后会引起MSC的凋亡(图2B)。

图1 人脐带MSC的表面标志Fig.1 The surface marker of human umbilical cord MSC
2.3 Poly(I:C)抑制MSC的成骨分化 MSC具有成骨分化的能力,我们用1 μg/ml和10 μg/ml Poly(I:C)处理MSC共21天,检测了Poly(I:C)的刺激对MSC成骨分化的影响。茜素红染色结果显示,MSC成骨诱导时加入Poly(I:C)刺激,与对照组相比,成骨效率明显降低(图3A、B)。通过 Q-PCR检测成骨标志基因,可见Runt相关转录因子2(Runtrelated transcription factor 2,RUNX2)、碱性磷酸酶(Alkaline phosphatase,ALP)和骨钙蛋白(Osteocalcin,OC)的表达均明显降低(P <0.05),图3C,与染色结果相符。
2.4 MSC抑制Poly(I:C)引起的DC的成熟和功能
将MSC与骨髓单核细胞于RPMI1640完全培养基(添加10%FCS胎牛血清,100 μg/ml的青霉素,100 μg/ml的链霉素,10 ng/ml的 GM-CSF,1 ng/ml IL-4)中共培养7天,单核细胞被诱导成未成熟DC,加入Poly(I:C)刺激24小时。流式细胞仪检测CD11c阳性的DC对MHCⅡ、CD40和CD86的表达情况。结果显示,MSC共培养组的DC对表面细胞标志CD40、CD86和MHCⅡ的表达与单独Poly(I:C)刺激组的DC相比显著降低(P<0.05)(图4A、B)。结果说明,在Poly(I:C)的刺激下,MSC能够抑制DC成熟表面标志的表达。
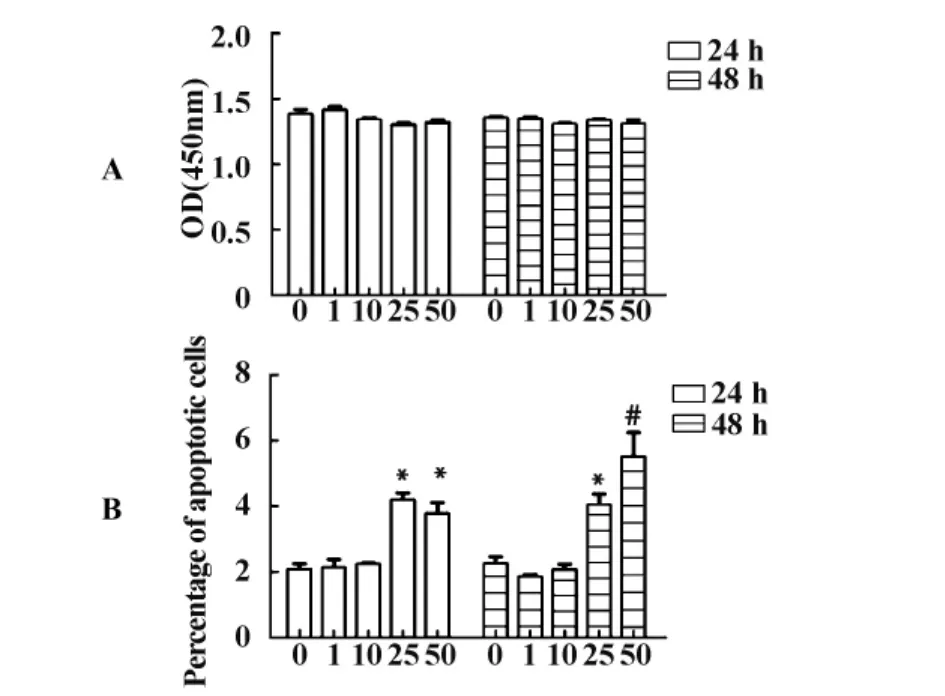
图2 Poly(I:C)对MSC的增殖和凋亡的影响Fig.2 The proliferation and apoptosis of MSC after treated with Poly(I:C)
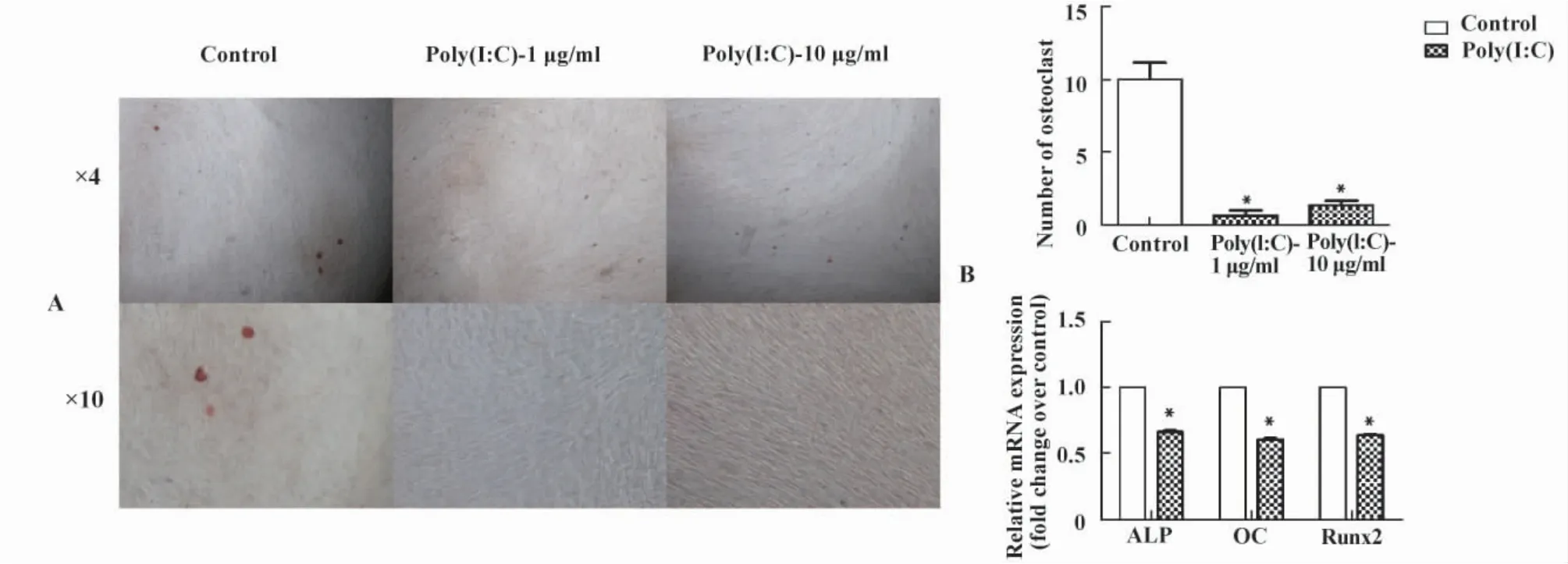
图3 Poly(I:C)对MSC成骨分化的影响Fig.3 The Osteogenic differentiation of MSC after treated with Poly(I:C)
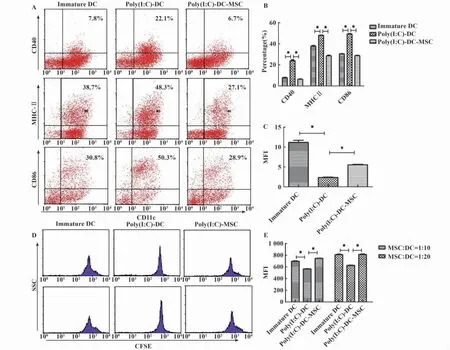
图4 MSC能够抑制Poly(I:C)引起的DC的成熟和功能Fig.4 MSC can inhibit the maturation and activation of DC with the treatment of Poly (I:C)
未成熟DC具有很强的吞噬功能,随后我们检测了Poly(I:C)刺激下MSC对DC吞噬功能的影响。结果显示,MSC与DC共培养组,DC的吞噬功能比单独Poly(I:C)刺激组明显的增强(图4C),说明MSC能够抑制DC的成熟,使其处于未成熟状态。成熟的DC能够将抗原递呈给T细胞,并使其活化,促进T细胞的增殖。我们首先用CFSE标记T细胞,然后将各个处理组[即Poly(I:C)刺激MSCDC共培养组、单独Poly(I:C)刺激DC组、未刺激DC组]的DC与T细胞按1∶10的比例共培养,3天后流式检测T细胞的增殖情况。结果显示,单独Poly(I:C)刺激组DC能够显著的促进T细胞的增殖,而MSC显著抑制DC细胞的抗原递呈功能(图4D)。以上结果说明,在Poly(I:C)刺激下,MSC能够抑制DC的成熟和功能。
3 讨论
MSC具有自我复制、多向分化潜能、造血支持、促进干细胞植入、低免疫原性和免疫调控等特性[16]。近年来的研究发现,骨髓、脂肪和脐带来源的MSC都能够表达有活性的TLRs[6-12]。
有研究表明TLRs的活化能够对MSC的分化和增殖产生影响[13-15]。Hwa 等[17]的研究发现,用TLR-1、TLR-2、TLR-3、TLR-4、TLR-5、TLR-6 和 TLR-9的配体刺激人脂肪来源的MSC,只有TLR9活化能够促进MSC的增殖。LPS和PGN能够促进MSC的成骨分化,CpG则能够抑制成骨,另外,Poly(I:C)不影响MSC的成骨或成脂分化。Liotta等[6]的研究则认为TLR的活化不影响人骨髓来源MSC的成骨、成脂和成软骨。Lombardo等[10]的研究则认为,TLR3和TLR4配体刺激能够促进脂肪来源MSC的成骨分化,但是不影响成脂分化,也不影响细胞增殖。Raicevic等[18]的研究发现,TLR3和 TLR4配体的刺激能够促进骨髓和脂肪来源MSC的成骨分化,而对脐带MSC没有影响。我们的研究发现,在Poly(I:C)的刺激下,人脐带来源MSC的表型和增殖不发生改变,但是高浓度的Poly(I:C)会引起MSC的凋亡;茜素红染色结果显示,Poly(I:C)能够抑制MSC的成骨分化,同样成骨相关基因RUNX2、ALP和OC的表达也明显受到抑制。
关于TLR对MSC免疫调节功能产生何种影响仍不清楚。Liotta等[6]的研究发现TLR3、TLR4的活化会阻断人骨髓来源BMSC对T细胞的抑制作用。与此相反,Waterman等[14]的研究则认为Poly(I:C)对MSC短时间的活化可以长时间的使其处于免疫抑制功能增强的状态,对IDO和PGE2的表达增强,对T细胞增殖的抑制作用增强,而TLR4的活化则使MSC更倾向于成为一种炎性MSC。Opitz等[7]的研究发现TLR3和TLR4的活化能够促进MSC产生IDO,从而促进对T细胞的抑制作用,增强MSC的免疫抑制功能。这些矛盾的结果可能与实验设计有关。我们将MSC与DC细胞共培养,加入TLR3配体Poly(I:C)的刺激,结果发现,Poly(I:C)存在的情况下MSC能够抑制DC的活化,增加DC的吞噬功能,使DC趋向于未成熟状态。
本实验探讨了Poly(I:C)对人脐带来源间充质干细胞生长、分化和功能的影响,发现了在TLR3配体存在的情况下,MSC依然具有很强的免疫调节功能,并且Poly(I:C)的刺激能够显著的抑制脐带MSC的成骨分化。脐带MSC取材方便且生长速度快,易于体外大量扩增,具有很高的临床应用前景。我们关于TLR3对MSC影响的研究为探索炎症环境对MSC影响的机制以及脐带MSC的体外应用奠定了基础。
1 Nasef A,Ashammakhi N,and Fouillard L.Immunomodulatory effect of mesenchymal stromal cells:possible mechanisms[J].Regen Med,2008;3:531-546.
2 Akira S,Takeda K,and Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001;2:675-680.
3 Hornung V,Rothenfusser S,Britsch S et al.Quantitative expression of toll-like receptor 1-10 mRNA in cellular subsets of human peripheral blood mononuclear cells and sensitivity to CpG oligodeoxynucleotides[J].J Immunol,2002;168:4531-4537.
4 Beutler B.Inferences,questions and possibilities in Toll-like receptor signalling[J].Nature,2004;430:257-263.
5 Akira S,Takeda K.Toll-like receptor signalling[J].Nat Rev Immunol,2004;4:499-511.
6 Liotta F,Angeli R,Cosmi L et al.Toll-like receptors 3 and 4 are expressed by human bone marrow-derived mesenchymal stem cells and can inhibit their T-cell modulatory activity by impairing Notch signaling[J].Stem Cells,2008;26:279-289.
7 Opitz C A,Litzenburger U M,Lutz C et al.Toll-like receptor engagement enhances the immunosuppressive properties of human bone marrow-derived mesenchymal stem cells by inducing indoleamine-2,3-dioxygenase-1 via interferon-beta and protein kinase R[J].Stem Cells,2009;27:909-919.
8 Pevsner-Fischer M,Morad V,Cohen-Sfady M et al.Toll-like receptors and their ligands control mesenchymal stem cell functions[J].Blood,2007;109:1422-1432.
9 Tomchuck S L,Zwezdaryk K J,Coffelt S B et al.Toll-like receptors on human mesenchymal stem cells drive their migration and immunomodulating responses[J].Stem Cells,2008;26:99-107.
10 Lombardo E,DelaRosa O,Mancheno-Corvo P et al.Toll-like receptor-mediated signaling in human adipose-derived stem cells:implications for immunogenicity and immunosuppressive potential[J].Tissue Eng Part A,2009;15:1579-1589.
11 Yu S,Cho H H,Joo H J et al.Role of MyD88 in TLR agonist-induced functional alterations of human adipose tissue-derived mesenchymal stem cells[J].Mol Cell Biochem,2008;317:143-150.
12 van den Berk L C,Jansen B J,Siebers-Vermeulen K G et al.Tolllike receptor triggering in cord blood mesenchymal stem cells[J].J Cell Mol Med,2009;13:3415-3426.
13 Bunnell B A,Betancourt A M,and Sullivan D E.New concepts on the immune modulation mediated by mesenchymal stem cells[J].Stem Cell Res Ther,2010;1:34.
14 Waterman R S,Tomchuck S L,Henkle S L et al.A new mesenchymal stem cell(MSC)paradigm:polarization into a pro-inflammatory MSC1 or an Immunosuppressive MSC2 phenotype[J].PLoS One,2010;5:e10088.
15 Nemeth K,Leelahavanichkul A,Yuen P S et al.Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production[J].Nat Med,2009;15:42-49.
16 Tyndall A,Walker U A,Cope A et al.Immunomodulatory properties of mesenchymal stem cells:a review based on an interdisciplinary meeting held at the Kennedy Institute of Rheumatology Division,London,UK,31 October 2005[J].Arthritis Res Ther,2007;9:301.
17 Hwa Cho H,Bae Y C,Jung J S.Role of toll-like receptors on human adipose-derived stromal cells[J].Stem Cells,2006;24:2744-2752.
18 Raicevic G,Najar M,Pieters K et al.Inflammation and toll-like receptor ligation differentially affect the osteogenic potential of human mesenchymal stromal cells depending on their tissue origin[J].Tissue Eng Part A,2012;18:1410-1418.