A组链球菌M蛋白重组多肽原核表达载体构建及融合蛋白的表达①
丁月霞 倪琼琼 刘金来 (广州医学院第五附属医院心血管内科,广州510700)
A组 β溶血性链球菌(Group A β-hemolytic streptococci,GAS)感染引起的风湿热和风湿心脏病(Rheumatic fever/rheumatic heart diseases,RF/RHD)是严重危害青少年和成人健康的疾病,研制安全、有效的GAS疫苗将有助于预防致咽炎GAS引起的RF/RHD,对减轻病人和社会的经济负担有积极的意义。现已发现M蛋白位于GAS的细胞壁上,具有抗吞噬作用,是制备GAS疫苗的理想抗原。我们在前期有关GAS的携带流行状况及编码其M蛋白的emm基因分型的研究表明,近期流行型为emm1和emm12[1];我们借鉴了国外学者有关A组链球菌M蛋白疫苗的候选基因序列的成功经验,以其编码的M蛋白信号肽后35个氨基酸和相同保守区的J14肽串联起来作为免疫原[1-3],即作为抗A组β溶血性链球菌M蛋白的候选疫苗,以此为设想合成含有编码该重组多肽或蛋白的基因序列,并构建该段核苷酸序列的重组表达质粒,以进一步诱导GST融合蛋白的表达。
1 材料与方法
1.1 材料
1.1.1 质粒和细菌 T载体(实验室提供)、大肠杆菌(E.coli)BL21菌株(上海申工)、pGEX-4T-1质粒(BV Tech公司)。
1.1.2 试剂(盒) HSTMTaq Mix Kit购自东盛生物公司,预染蛋白 Marker购自 Ferment公司,BamHⅠ/XhoⅠ限制性内切酶、DNA Marker、T4 DNA连接酶、T4磷酸激酶均购自大宝生物公司,异丙基-β-巯基半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG) 以及Western blot所需试剂耗材均购自Sigma公司,PCR产物回收纯化试剂盒购自东盛生物公司,琼脂糖凝胶DNA回收试剂盒,质粒提取试剂盒购自TIANGEN公司,抗兔GST单克隆抗体购自CST公司,HRP标记的山羊抗兔IgG、化学发光试剂盒购自Santacruz公司,X胶片、曝光盒购自广州安布雷拉公司,BioRAD蛋白电泳装置(美国BioRAD公司),MALDITOF-TOF质谱仪:UltraflexⅢ(德国布鲁克)。
1.2 方法
1.2.1 GAS重组M蛋白多肽疫苗抗原区段的选择以及核苷酸引物设计 根据前期emm基因测序结果分析[1,4],选择编码信号肽后 35 个氨基酸(属于M蛋白的型特异区)的核苷酸序列作为目的基因;同时我们的测序结果还发现emm1和emm12 C端保守区J14肽的核苷酸序列一致,故我们设计将分别编码GASM蛋白(emm1和emm12)信号肽后35个氨基酸和 J14肽的核苷酸序列串联[5-7]起来(GGTTTTGCGAATCAAACAGAGGTTAAGGCTAACGGTGATGGTAATCCTAGGGAAGTTATAGAAGATCTTGCAGCAAACAATCCCGCAATACAAAATATACGTTTAGATCATAGTGATTTAGTCGCAGAAAAACAACGTTTAGAAGATTTAGGACAAAAATTTGAAAGACTGAAACAGCGTTCAGAACTCTACCTTCAGCAATACTATGATGCATCACGTGAAGCTAAAAAACAAGTTGAAAAAGCTTTAGAA)。根据Oligo6软件分析,得出重组基因属于常规基因序列,平均GC含量为37.04,将此重组基因序列分成6个片段,共合成了12条引物(含有保护性碱基,上海捷瑞生物工程有限公司),Primer 1和Primer 12分别包含有BamHⅠ/XhoⅠ限制性内切酶酶切位点。该段基因序列编码84个氨基酸(GFANQTEVKANGDGNPREVIEDLAANNPAIQNIRLDHSDLVAEKQRLEDLGQKFERLKQRSELYLQQYYDASREAKKQVEKALE,约9.6 kD)通过和 CDC数据库比对确定和各组织均无任何同源性,具有良好的免疫原性。
1.2.2 核苷酸引物片段 Primer 1:ACTTAGGATCCATGGGTTTTGCGAATCAAACAGAGGTT(含有BamHⅠ酶切位点);Primer 2:GATTACCATCACCGTTAGCCTTAACCTCTGTTTGATTCGCAAAA;Primer 3:AAGGCTAACGGTGATGGTAATCCTAGGGAAGTTATAGAAGATCT;Primer 4:TATTGCGGGATTGTTTGCTGCAAGATCTTCTATAACTTCCCTAG;Primer 5:TGCAGCAAACAATCCCGCAATACAAAATATACGTTTAGATCATAGT;Primer 6:GTTGTTTTTCTGCGACTAAATCACTATGATCTAAACGTAl-TATTTTG;Primer 7:GATTTAGTCGCAGAAAAACAACGTTTAGAAGATTTAGGACAAAAAT;Primer 8:GAACGCTGTTTCAGTCTTTCAAATTTTTGTCCTAAATCTTCTAAAC;Primer 9:TTGAAAGACTGAAACAGCGTTCAGAACTCTACCTTCAGCAATAC;Primer 10:TAGCTTCACGTGATGCATCATAGTATTGCTGAAGGTAGAGTTCT;Primer 11:TATGATGCATCACGTGAAGCTAAAA-AACAAGTTGAAAAAGCTTT;Primer 12:ACTTACTCGAGTTATTCTAAAGCTTTTTCAACTTGTTTTT(含有 XhoⅠ的酶切位点)。
1.2.3 重叠PCR以及原核表达载体构建 上述混合引物 5 μl、Primer 1:2 μl、Primer 12:2 μl、Taq 酶1 μl、超纯水 13 μl、Buffer 1 μl、dNTP 1 μl,25 μl反应体系;反应条件:94℃ 20秒;54℃ 20秒;72℃ 12秒,20个循环。将PCR产物纯化后连入T载体、转化大肠杆菌BL21,质粒测序、挑选正确的单克隆;将测序正确的连入T载体的质粒用BamHⅠ/XhoⅠ把270 bp的目的片段切下来;同时用BamHⅠ/XhoⅠ对空质粒(pGEX-4T-1,pG)进行酶切;回收需要的片段和酶切后的空载体进行连接,并转化BL21,挑取单克隆培养,然后提质粒、酶切鉴定并测序,挑选正确的克隆,构建含有目的片段的重组质粒(pGEX-4T-1-emm1-12-J14,pE)的大肠杆菌BL21菌株(pE/B)。
1.2.4 GST融合蛋白(GST/emm)诱导表达
1.2.4.1 GST/emm基础表达 将BL21转接至无氨苄抗性的LB平板上,同时分别将pG/B(转化了空质粒pG的大肠杆菌BL21)和pE/B(转化了重组质粒pE的大肠杆菌BL21)菌株转接至氨苄抗性的LB平板上;37℃培养过夜后各挑取单克隆菌落到1 ml LB培养基中(Amp 100 μg/ml),过夜振荡培养(12~16小时,180~200 r/min,37℃)后以1∶100比例将菌液转接于2 ml LB培养基中(Amp 100 μg/ml),剧烈振荡培养2小时(220 r/min,37℃,OD 值约0.6~0.8,下同)。取出1 ml菌液不加IPTG,作为阴性对照;另外1 ml加入终浓度为1 mmol/L的IPTG 25℃诱导 2小时后,收集菌液离心(4℃,12 000 r/min,5分钟)、弃上清,细菌沉淀重悬于100 μl 1×SDS上样缓冲液中(使用前加入终浓度为0.1 mmol/L的DTT);冰上超声裂解,3秒×3~5次;短暂高速离心后100℃水浴5分钟;4℃,12 000 r/min,5分钟离心,冰上放置,等全部样品处理完后一起进行12%的SDS聚丙烯酰胺凝胶电泳(200 V,40分钟)、考马斯亮蓝染色40分钟和脱色后在凝胶成像系统中拍照;并进一步通过Western blot检测GST融合蛋白表达(下同)。
1.2.4.2 IPTG诱导GST/emm表达的时效性 分别取适量上述振荡培养过夜的pG/B和pE/B菌液,按照1∶100转接于所需要的LB培养基中(Amp 100 μg/ml),剧烈振荡培养2 小时(220 r/min,37℃,OD值约0.6~0.8)后加入终浓度为1 mmol/L的IPTG 25℃分别诱导0、2、6、8、18 和24 小时(pG/B 只做未诱导和2小时诱导组),其余处理同上。
1.2.4.3 不同浓度的IPTG诱导GST/emm表达在上述步骤中,分别加入终浓度为 0.01、0.1、1 mmol/L的IPTG在25℃诱导8小时,其余同上(pG/B只做未诱导和1 mmol/L诱导组)。
1.2.4.4 不同温度下IPTG诱导GST/emm表达在不同温度 (25℃、30℃、37℃),以终浓度为1 mmol/L的IPTG分别诱导8小时,其余步骤同上,将聚丙烯酰胺凝胶上的目的条带(35.6 kD)切下进行蛋白质谱分析(由中山大学蛋白质组学实验室完成)。
1.2.5 Western blot检测GST/emm的表达 IPTG诱导组和未诱导组(只做上述的基础表达组和pE/B的时间组与浓度组)取1 ml菌液如上处理,每条泳道上样量为20 μg(约25 μl上述细菌裂解液)。进行12%的SDS聚丙烯酰胺凝胶电泳后经半干电转移槽转移至硝酸纤维素膜上(100 V、60分钟),在室温下用封闭缓冲液(5%脱脂奶粉,含0.1%TWEEN20的 TBS配制)封闭1小时,洗膜、兔抗GST单克隆抗体为一抗(1∶2 000稀释)4℃孵育过夜、洗膜后与 HRP标记的山羊抗兔 IgG,二抗(1∶5 000稀释)室温孵育1小时,洗膜后增强化学发光法显色,X线底片曝光1分钟显影,并进行灰度扫描。
1.2.6 质谱分析检测融合蛋白GST/emm 用刀片切取1~2 mm胶粒,置于1.5 ml EP管中、清洗(用200 μl MilliQ震荡清洗2次,每次10分钟)、脱色(对于考染胶,加25 mmol/L NH4HCO3和50%ACN考染脱色液200 μl、37℃、20分钟或超声脱色5分钟、吸干;重复脱色2~3次,至蓝色褪去)、脱水(加ACN 100 μl脱水至胶粒变白,吸弃 ACN);加10 mmol/L DTT 50 μl,37℃1 小时;冷至室温,快速加IAA 30 mmol/L 50 μl,置于暗室 45 分钟;清洗:用200 μl MilliQ震荡清洗2次,每次10分钟;然后用200 μl 50%ACN震荡清洗2次,每次10分钟;脱水:加ACN 100 μl脱水至胶粒变白,吸弃ACN;用25 mmol/L NH4HCO3稀释 Trypsin 至12.5 mg/ml,每管加10 μl,稍微离心一下,让酶液与胶粒充分接触,4℃放置30分钟 ,待酶液被胶粒完全吸收,吸弃多余的酶液,加 25 mmol/L NH4HCO315 μl,37℃过夜(16小时)。然后AnchorChip靶点样。最后进行质谱分析以上制备的样品,使用德国Bruker公司的UltraflexⅢ质谱仪进行分析。所获得图谱使用Biotools软件检索,以 MASCOT(Matrix Science,London,UK)为搜索引擎。搜索参数设置:数据库为自建序列数据库,数据检索的方式为combined;最大允许漏切位点为1;酶为胰蛋白酶。质量误差范围设置:PMF50ppm,MS/MS0.5Da。
2 结果
2.1 Overlap-PCR结果 如图1所示,通过Overlap-PCR合成的重组DNA目的序列接近272 bp,通过琼脂糖凝胶回收、纯化并测序(上海捷瑞生物工程有限公司完成),结果与设计之初的序列完全符合,可以用于下一步的表达载体构建。如图2所示用BamHⅠ和XhoⅠ快速型限制性内切酶双酶切空质粒(pG)和重组质粒(pE),后者可见目的片段约252 bp,并将pE测序鉴定,重组核苷酸序列的编码框正确,编码84个氨基酸。
2.2 成功构建含目的片段的pGEX-4T-1-emm1-12-J14(pE)重组质粒 图3为我们所构建的含目的DNA的表达载体结构示意图,我们选择了高效的谷胱甘肽巯基转移酶(Glutathione S transferase,GST)标记的融合蛋白表达系统(pGEX-4T-1,pG),该质粒作为空质粒与所克隆的目的片段进行连接转化,成功构建了稳定表达重组质粒pE的大肠杆菌BL21菌株。
2.3 GST/emm诱导表达
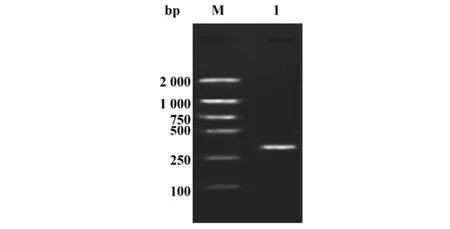
图1 Overlap PCR电泳图Fig.1 1.5%Agarose gel electrophoretic profiles of recombinant emm gene amplified by Overlap PCR
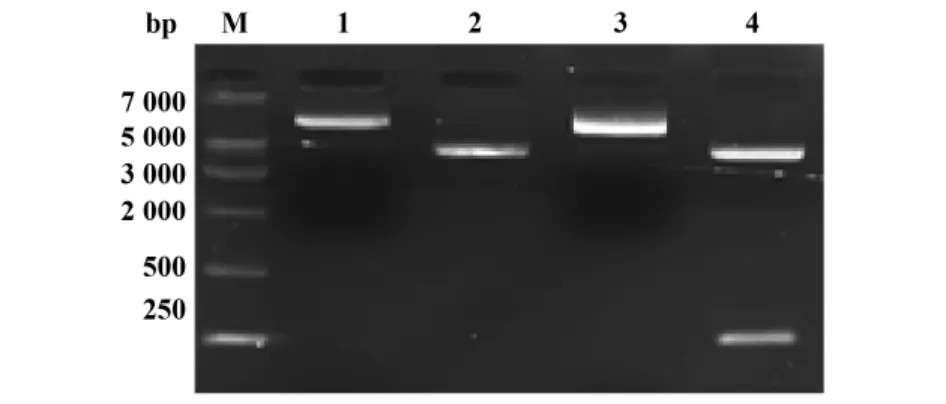
图2 重组质粒双酶切1.5%琼脂糖凝胶电泳图Fig.2 1.5%Agarose gel electrophoretic profiles of recombinant plasmid cleavage with Bam HⅠ/XhoⅠ
2.3.1 GST/emm基础表达 如图4所示,E.coli BL21无论诱导与否均无GST(26 kD)和GST融合蛋白(GST/emm,约35.6 kD)表达;表达空质粒(pG)的BL21未诱导时无GST表达;而转化了重组质粒(pGEX-4T-1-emm1-12-J14,pE)的 BL21无GST/emm表达,诱导后GST/emm明显过量表达。
2.3.2 IPTG诱导GST/emm表达的时效性 如图5所示,1 mmol/L IPTG分别诱导表达重组质粒的BL21(pE/B)0、2、6、8、18、24 小时后,GST 融合蛋白(GST/emm)的表达在2小时就比较明显,在6~8小时达高峰,18小时和24小时时有所下降,但依旧是过量表达。
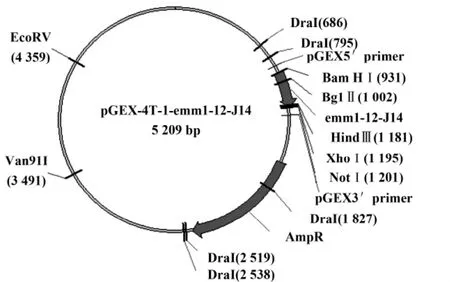
图3 pGEX-4T-1/emm1-12-J14结构示意图Fig.3 The structure diagram of pGEX-4T-1/emm1-12-J14
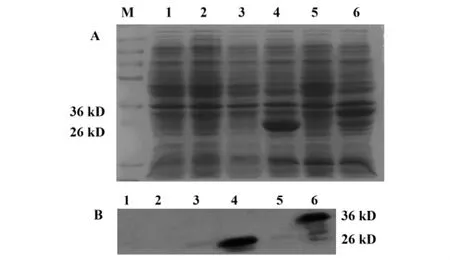
图4 IPTG诱导GST融合蛋白在E.coli BL21中的表达Fig.4 The expression of inducible protein with IPTG
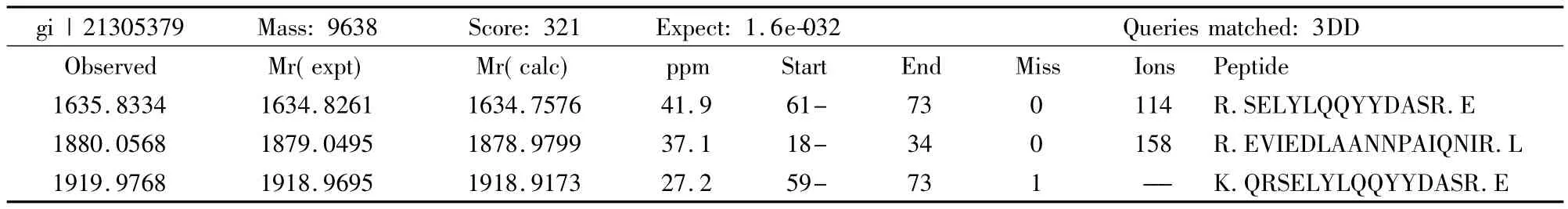
表1 GST/emm质谱分析结果Tab.1 The fusion protein(GST/emm)examined with MALDI-TOF MS
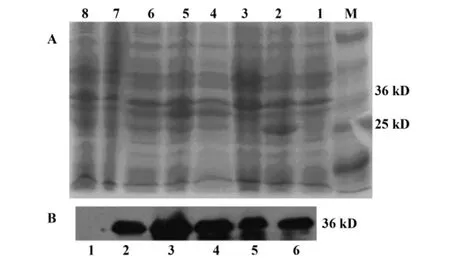
图5 IPTG诱导GST/emm表达的时间效应Fig.5 The expression of GST/emm induced with IPTG at different times
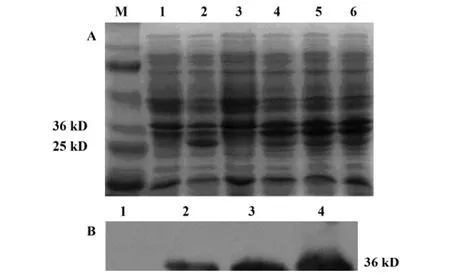
图6 IPTG诱导GST/emm表达的浓度效应Fig.6 The expression of GST/emm induced with different concentrations of IPTG
2.3.3 不同浓度和温度下IPTG诱导GST融合蛋白的表达 如图6所示,12%SDS-PAGE和Western blot结果均表明不同浓度的 IPTG(0.01、0.1、1 mmol/L)诱导pE/B 8小时时表达GST/emm融合蛋白在较低浓度时即有明显表达,随浓度增加表达有所增加。1 mmol/L IPTG在不同温度下诱导GST/emm表达均为过量表达,温度对融合蛋白表达量的影响不明显,见图7。
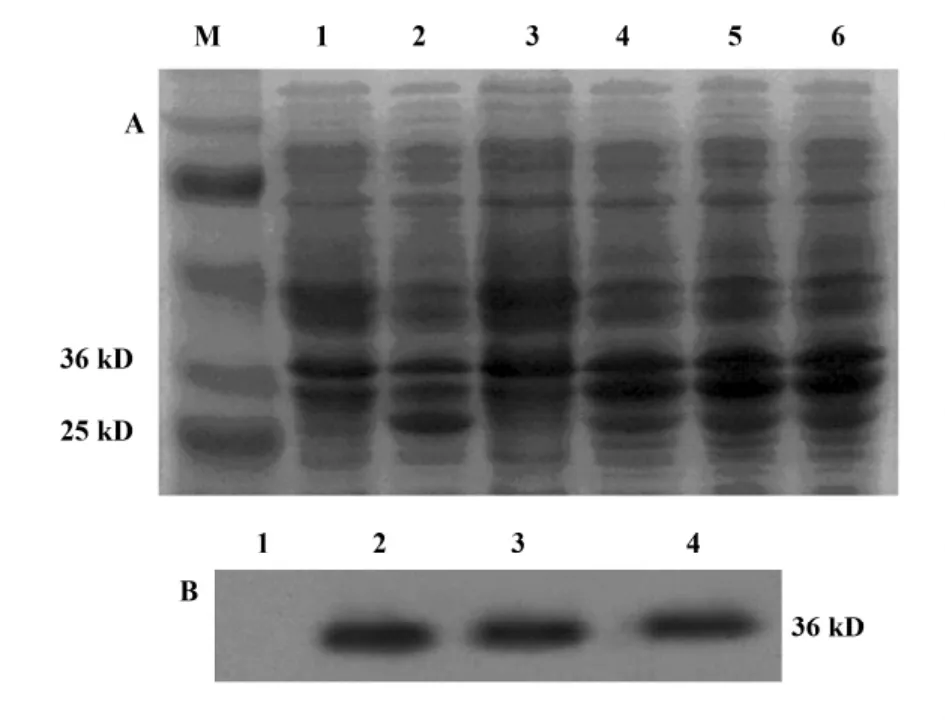
图7 温度对IPTG诱导GST/emm表达Fig.7 The expression of GST/induced with IPTG under different tempreatures
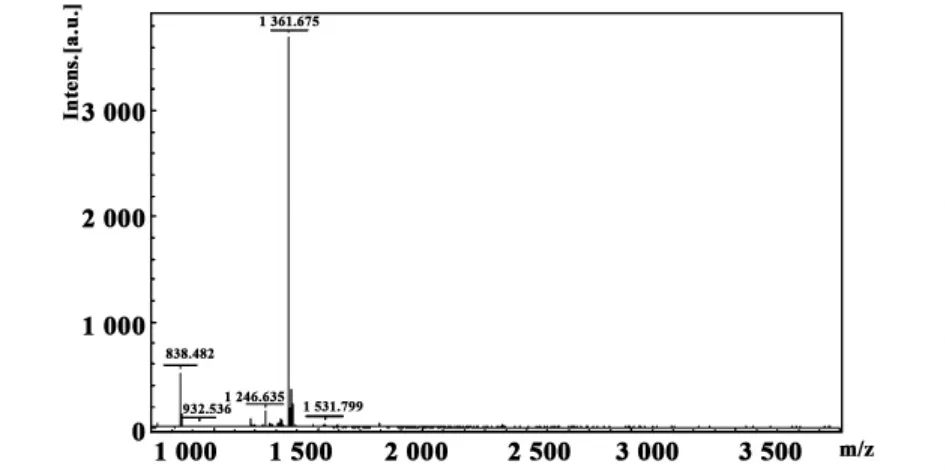
图8 GST/emm质谱检测结果Fig.8 The fusion protein(GST/emm)examined with MALDI-TOF MS
2.4 GST/emm质谱检测结果 如表1和图8所示:蛋白质谱分析gi|21305379(自建数据库)是以重组蛋白的氨基酸序列(如前所述,M蛋白信号肽后的35个氨基酸和J14肽序列串联)建立数据库,GST/emm质谱分析结果与该数据库比对,如果分数超过16分即可确定诱导的融合蛋白正确,蛋白质谱分析确定35.6 kD处的条带是GST/emm,可以进行下一步实验。
3 讨论
众所周知GAS可以引发多种感染性和感染后自身免疫性疾病,尤其在发展中国家由其导致的风湿热以及风湿性心脏病仍有较高的发病率和致残致死率,所以近年来各国学者一直致力于针对GAS的疫苗研制[4,7]。由 emm 基因编码的 M 蛋白作为GAS最重要的毒力因子之一是热门的候选免疫原。目前欧美国家已经成功构建针对M蛋白的多价疫苗并进行了临床试验[5-8]。但是各个地区和国家致病型GAS的流行情况不同,编码其主要毒力因子M蛋白的emm基因分型也不尽相同,这就需要不同国家或者地区进行相关GAS及其emm分型的流行病学调查以便选出适合本国的针对M蛋白的疫苗候选基因,这一项工作我们在前期已经完成[1]。
我们之所以选择编码M蛋白信号肽后35个氨基酸的核苷酸序列作为目的基因,是因为此区为GAS M蛋白型特异性的高变区,且信号肽后的这部分序列与人的组织无交叉免疫反应,通常把该区编码的多肽序列作为候选疫苗。我们的测序结果还发现emm1和emm12 C端保守区J14肽的核苷酸序列一致,现在的动物实验已经证明了GAS不同亚型的C端保守区编码的J14或J8肽具有很好的免疫原性,是保护性抗原,它们可以刺激动物产生保护性抗体[2,6]。故通过分子克隆技术将致咽炎GAS的2型emm(1和12)编码信号肽后35个氨基酸的基因与j14肽的基因串联起来,由其编码的重组蛋白在NCBI与人的对该氨基酸序列比对无任何同源性,可作为很好的疫苗候选者。重叠PCR是根据目的基因的核苷酸序列,将目的基因分成70~90 bp不等的多条引物,分段进行合成;利用相连片段间20~30 bp重叠的核苷酸部分互相搭桥、互为模板,通过几轮连续的PCR反应将各片段粘合在一起,组合成为目的基因。该技术的关键在于核苷酸引物的设计、退火温度的控制以及首尾重叠部分(一般需要25 bp)。我们通过引物设计软件,将目的基因分成6个片段、共设计了12条引物,同时引入相应的酶切位点(见方法与结果),成功合成了编码候选多肽的全基因序列;并进一步构建了GST标签的重组质粒、成功转化E.coli BL21、建立了稳定表达目的基因的大肠杆菌株系。
GST标签的融合蛋白表达载体业已成熟尤其在融合蛋白的可溶性表达以及维持蛋白表达后的生物活性上有其独到之处。我们选择带有GST标签的pGEX-4T-1作为表达载体,将重组的DNA目的片段克隆到该载体上,构建了稳定表达体系。该质粒含有凝血酶专一酶切位点,为大量诱导表达和纯化融合蛋白以及切去GST标签,获得目的蛋白或多肽提供了很大的可能性。我们利用构建好的含有编码M蛋白目的基因的重组质粒,成功通过IPTG诱导了GST融合蛋白的过量表达,摸索出最佳表达条件。诱导结果经SDS-PAGE、Western blot以及蛋白质谱分析目的条带均正确,其中质谱分析是目前较为先进的检测多肽片段的蛋白质实验技术。该技术是一种新型的检测多肽或蛋白质的方法,尤其是在没有成熟的单克隆抗体或检测小分子多肽时[9],其原理是:通过电离源将蛋白质分子转化为气相离子,然后利用质谱分析仪的电场、磁场将具有特定质量与电荷比值(M/Z值)的蛋白质离子分离开来,经过离子检测器收集分离的离子,确定离子的M/Z值,分析鉴定未知蛋白质。我们的研究中利用所设计的重组多肽氨基酸序列自建数据库,通过基质辅助激光解吸电离质谱分析目的多肽或融合蛋白,结果表明GST/emm中多肽分子量和氨基酸正确,与自建数据库相匹配。这就为下一步候选免疫原蛋白的大量表达纯化、酶切以及下游的动物实验奠定了良好的基础。
1 丁月霞,倪琼琼,刘金来.广州市儿童致咽炎β溶血性链球菌的流行情况及其emm基因分型[J].中山大学学报(医学科学版),2011;32(3):411-415.
2 Dale J B.Multivalent group A streptococcal vaccine designed to optimize the immunogenicity of six tandem M protein fragments[J].Vaccine,1999;17(2):193-200.
3 Batzloff M,Yan H,Davies M et al.Preclinical evaluation of a vaccine based on conserved region of M protein that prevents group A streptococcal infection[J].Indian J Med Res,2004;119(Suppl):104-107.
4 Stollerman G H.Rheumatic fever[J].Lancet,1997;349(9056):935-942.
5 Bisno A L.Group A streptococcal infections and acute rheumatic fever[J].N Engl J Med,1991;325(11):783-793.
6 Vohra H,Dey N,Gupta S et al.M protein conserved region antibodies opsonise multiple strains of Streptococcus pyogenes with sequence variations in C-repeats[J].Res Microbiol,2005;156(4):575-582.
7 Hu M C,Walls M A,Stroop S D et al.Immunogenicity of a 26-valent group A streptococcal vaccine[J].Infect Immun,2002;70(4):2171-2177.
8 Kotloff K L,Corretti M,Palmer K et al.Safety and immunogenicity of a recombinant multivalent group a streptococcal vaccine in healthy adults:phase 1 trial[J].JAMA,2004;292(6):709-715.
9 陈绍农,潘远江,陈耀祖.多肽及蛋白质质谱分析新进展[J].质谱学报,1995;16(3):15-21.