口蹄疫灭活疫苗中蛋白质含量测定方法的比较
马 丽,邹兴启,朱元源,史兰广,赵启祖*
(1.中国兽医药品监察所,北京100081;2.北京科兴生物制品有限公司,北京100085)
口蹄疫灭活疫苗中主要成分为抗原和佐剂,纯化不完全的疫苗中可能会含有细胞碎片、血清、病毒非结构蛋白等杂蛋白,使用过程中会引发动物副反应,同时疫苗中病毒非结构蛋白的存在给病毒感染和疫苗免疫的鉴别诊断带来困难[1-2]。因此,选择一种适合、简便、快速、灵敏的蛋白质含量测定方法来准确定量口蹄疫灭活疫苗中蛋白质对于疫苗的质量监控意义重大。目前测定蛋白质含量的方法有多种,包括凯氏定氮法、双缩脲法、Lowry法、考马斯亮蓝法、2,2’-联喹啉-4,4’-二羧酸法和紫外分光光度法等[3]。本试验采用凯氏定氮法、改良Lowry法和考马斯亮蓝法这三种较常见的测定方法,测定抽取样品的蛋白质含量,并对之进行比较,最后采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进一步验证测定结果,以期为口蹄疫灭活疫苗蛋白质含量检测方法的遴选和标准化提供实验依据。
1 材料与方法
1.1 仪器 KjeltecTM2300自动定氮仪(FOSS公司产品),紫外分光光度计(Thermo公司产品),蛋白质电泳仪,涡旋混合器,离心机(SIGMA公司产品),“U”型96孔板,各量程移液枪。
1.2 试剂 催化剂片(FOSS公司产品),浓硫酸,双氧水,12%PAGE胶(invitrogen公司产品),丙酮,改良Lowry法蛋白质测定试剂盒(Thermo公司产品),考马斯亮蓝法蛋白质测定试剂盒(Thermo公司产品)。
1.3 检测样品 国内不同口蹄疫灭活疫苗生产厂家抽取的15批次口蹄疫O型、亚洲1型二价灭活疫苗。
1.4 方法
1.4.1 样品制备 破乳样品制备:准确量取10 mL疫苗样品,加1.1 mL正丁醇,充分混匀,4℃静置过夜,取下层清亮液体,即为破乳样品。
检测样品制备:准确量取100 μL疫苗样品,加900 μL丙酮,充分混匀,室温静置 10 min,4 ℃,15000 g,离心15 min,弃上清,丙酮洗沉淀两次,室温干燥沉淀,用适量去离子水重悬沉淀[4-5]。
标准牛血清白蛋白系列浓度样品制备:将试剂盒内标准牛血清白蛋白(2 mg/mL),用去离子水稀释成终浓度为 0、25、125、250、500、750、1000、1500、2000 μg/mL 样品,备用。
1.4.2 凯氏定氮法 以生理盐水为空白对照,按KjeltecTM2300自动定氮仪使用操作规程对破乳样品定氮。准确量取1 mL样品加入消化管,同时加入半片催化剂片、5 mL浓硫酸、2.5 mL双氧水,置消化炉上,420℃消化1 h,冷却至室温,将样品置全自动凯氏定氮仪上定氮,测定氮含量,乘以蛋白质换算系数6.25,即得1 mL样品蛋白质含量,每一样品平行测定三次,取平均值。
1.4.3 改良Lowry法标准曲线绘制 按改良Lowry法蛋白质测定试剂盒说明书操作,准确量取标准牛血清白蛋白系列浓度样品各40 μL,加入“U”型96孔板中,加入试剂盒内Lowry试剂200 μL,室温放置10 min,加入酚试剂 20 μL,室温放置 30 min,测定各浓度在750 nm吸光值。
1.4.4 考马斯亮蓝法标准曲线绘制 按考马斯亮蓝法蛋白质测定试剂盒说明书操作,准确量取标准牛血清白蛋白系列浓度样品各取10 μL,加入“U”型96孔板中,加入试剂盒内考马斯亮蓝溶液300 μL,室温放置10 min,测定各浓度在595 nm吸光值。
1.4.5 改良Lowry法和考马斯亮蓝法比较试验改良Lowry法和考马斯亮蓝法检测范围分别为1~1500 μg/mL 和100 ~1500 μg/mL,为了验证样品中蛋白质含量对测定结果影响,从15批疫苗中选取6批疫苗:1号、2号、6号、7号、8号、14号,这6批疫苗分别来自6个口蹄疫灭活疫苗生产厂,分别测定其原倍、5倍和10倍稀释后蛋白质含量。
1.4.6 SDS-PAGE 按纯化样品制备方法得15批疫苗沉淀,再用20 μL上样缓冲液重悬沉淀,参照《蛋白质技术手册》[4]进行 SDS-PAGE:使用12%PAGE胶,恒压120 V,直至溴酚蓝前沿至胶前沿约1 cm处停止电泳。用考马斯亮蓝染色,观察电泳图谱,并与上述三种蛋白质含量测定方法检测的15批疫苗样品总蛋白质含量进行比对。
2 结果与分析
2.1 标准曲线
2.1.1 改良Lowry法标准曲线 以牛血清白蛋白浓度为纵坐标,以其各浓度在750 nm处吸光值为横坐标,绘制标准曲线图1。得回归方程为 y=379.57x2+300.63x-21.749,线性相关系数 R2=0.9993(0.98-1),显著相关。

图1 改良Lowry法标准曲线图
2.1.2 考马斯亮蓝法标准曲线 以牛血清白蛋白浓度为纵坐标,以其各浓度在595 nm处吸光值为横坐标,绘制标准曲线图2。得回归方程为 y=1324.1x2-958.85x+216.79,线性相关系数 R2=0.994(0.98-1),显著相关。
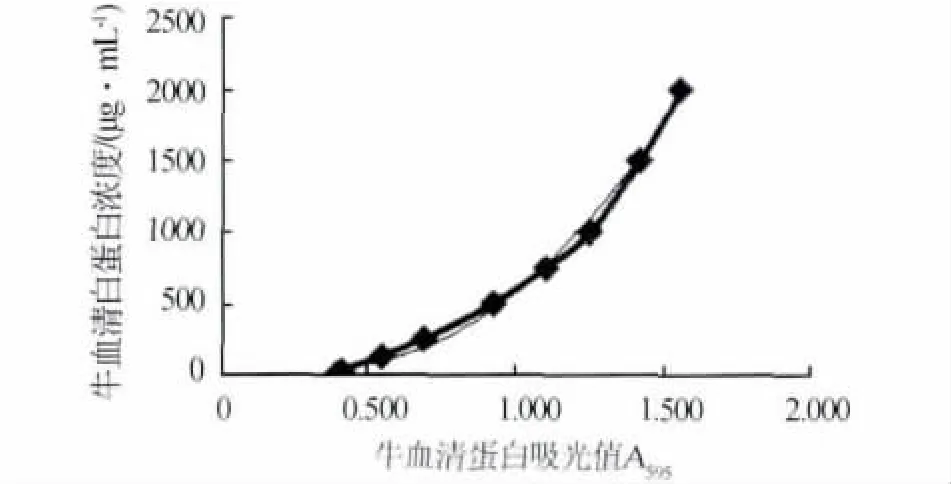
图2 考马斯亮蓝法标准曲线图
2.2 蛋白质含量测定结果及分析
2.2.1 凯氏定氮法测定结果 按破乳样品制备方法对9批疫苗破乳,按1.4.2项方法测定其总蛋白质含量,测定结果见表1。
2.2.2 改良Lowry法测定结果 按检测样品制备方法对15批疫苗样品进行处理,最后用50 μL去离子水重悬沉淀,按1.4.3项方法测定其在750 nm吸光值,根据标准曲线得出每一样品总蛋白质含量,每一样品重复3次,取其平均值,测定结果见表1。

表1 三种蛋白质测定方法三次测定结果平均值(μg/mL)
2.2.3 考马斯亮蓝法测定结果 按检测样品制备方法对15批疫苗样品进行处理,最后用50 μL去离子水重悬沉淀,按1.4.4项方法测定其在595 nm吸光值,根据标准曲线得出每一样品总蛋白质含量,每一样品平行测定3次,取其平均值,测定结果见表1。
2.2.4 与经典方法比较结果 凯氏定氮法是一种蛋白质测定的经典方法。因此,将部分样品改良Lowry法和考马斯亮蓝法测定结果同凯氏定氮法测定结果进行了比较,结果见图3。
由表1可见,同一批疫苗样品,不同测定方法测定蛋白质含量差异较大,其中凯氏定氮法测定结果最高,改良Lowry法测定结果适中,考马斯亮蓝法测定结果最低。图3可见不同批次疫苗两种方法测定结果所占凯氏定氮法测定结果百分比各不相同,差异也比较大,其中考马斯亮蓝法测定结果最低的仅占3.1%。5号和6号总蛋白质含量较低,凯氏定氮法未能准确测定其蛋白质含量,改良Lowry法和考马斯亮蓝法测定结果一致。

图3 改良Lowry法和考马斯亮蓝法测定结果同凯氏定氮法测定结果比较
2.2.5 改良Lowry法和考马斯亮蓝法比较试验结果 在上述测定基础上,按检测样品制备方法处理选取的6批疫苗样品,最后分别用50、250、500 μL去离子水重悬,采用这两种方法测定其蛋白质含量,每一样品每一稀释度做3次平行测定。测定结果见表2,¯x为3次测定结果平均值,s为标准差,并使用SPSS软件分析每一方法对疫苗不同稀释倍数之间的测定结果差异性。
表2 两种方法测定疫苗不同稀释度蛋白质含量结果(蛋白质浓度μg/mL:±s)

表2 两种方法测定疫苗不同稀释度蛋白质含量结果(蛋白质浓度μg/mL:±s)
测定方法 稀释 1号 2号 6号 7号 8号 14号原倍 332±44.1 1572±135.7 67±5.88 653±18.36 2009±改良Lowry法171.22 477±64.49 5倍 346±14.1 1587±103.45 252±8.79 716±16.06 1908±8.87 454±16.15 10倍 859±39.03 1776±31.41 164±3.94 744±53.87 1766±105.04 457±38.07考马斯亮蓝法原倍 126±3.41 156±1.30 64±0.32 79±2.45 700±21.05 137±6.28 5倍 328±1.17 341±1.63 321±0.79 329±4.35 473±6.17 329±0.79 10倍 640±2.54 645±2.45 656±3.27 635±0.64 784±23.32 650±10.25
由表2可见,样品中蛋白质含量对改良Lowry法和考马斯亮蓝法测定结果有一定影响。用SPSS软件分析6批次疫苗不同稀释倍数结果之间的差异性(结果未列出),其中改良Lowry法测定原倍和5倍稀释测定结果差异不显著,个别样品原倍、5倍和10倍稀释差异均不显著,仅6号疫苗差异显著,分析原因为蛋白质含量过低,稀释后超出改良Lowry法测定范围;考马斯亮蓝法测定的大部分疫苗样品不同稀释倍数测定结果差异较显著。
2.3 SDS-PAGE结果及分析 按照1.4.6项对15批疫苗进行SDS-PAGE电泳,结果见表1和图4。

图4 疫苗SDS-PAGE电泳图
SDS-PAGE电泳为定性试验,其图谱颜色的深浅与蛋白质的量是成正比的。图4明显可见部分疫苗SDS-PAGE电泳图谱差异较大,如5号、10号、7号、2号、8号图谱颜色依次变深,其改良Lowry法测定蛋白质含量分别为 67、443、653、1572、2009 μg/mL,含量依次增加,两者一致;而考马斯亮蓝法测定5号、10号、7号蛋白质含量依次为64、74、79 μg/mL,与图谱颜色不一致;凯氏定氮法测定蛋白质含量与图谱颜色是基本一致的。
3 讨论
凯氏定氮法是一种蛋白质测定的经典方法,适用样品广泛,其依据蛋白质为含氮的有机化合物,通过测定样品中氮含量,乘以换算系数转化为蛋白质的含量,本法灵敏度较低,适用于0.2~2.0 mg氮的测定[3]。本研究采用全自动凯氏定氮法测定,检测氮含量下限为100 μg(蛋白质含量检测下限为625 μg),灵敏性更高。但是,我国官方发布了关于控制口蹄疫灭活疫苗纯度的相关文件[6],文件规定2015年1月1日起,总蛋白含量为每mL疫苗不高于500 μg,显然超出其检测范围。并且此方法操作复杂费时,试剂消耗量大[7],试验过程涉及到浓硫酸、双氧水等危险溶剂的使用。表1中凯氏定氮法测定7批疫苗蛋白质含量均明显高于改良Lowry法和考马斯亮蓝法测定结果。究其原因,可能是由于生产工艺过程纯化不完全,疫苗样品中氨基酸、核酸等成分中的非蛋白氮也会被换算成蛋白质,使得测定结果要比实际值高。
Lowry法是依据蛋白质分子中含有的肽键在碱性溶液中与Cu2+螯合形成蛋白质-铜复合物,此复合物使酚试剂的磷钼酸还原,产生蓝色化合物,化合物在745~750 nm处有最大吸光值,在此范围内其颜色深浅与蛋白质浓度呈正比,因此可检测750 nm 光吸收值的大小计算蛋白质含量[3-4,5],本研究采用改良Lowry法测定蛋白质含量,其检测范围为1~1500 μg/mL,满足官方规定蛋白质含量要求,几乎所有疫苗样品中蛋白质含量均在此范围内。此外,本方法直接检测蛋白质含量,排除了凯氏定氮法中非蛋白氮影响,测定蛋白质含量相对准确,对同一批样品多次重复实验,结果平行性较好。
考马斯亮蓝法是依据在酸性溶液中考马斯亮蓝G250与蛋白质分子中的碱性氨基酸(精氨酸)和芳香族氨基酸结合形成蓝色复合物,复合物在465~595 nm处有最大吸光值,在此范围内其颜色深浅与蛋白质浓度呈正比,因此可检测595 nm光吸收值的大小计算蛋白质含量[3-4,8]。本研究使用的试剂盒检测范围为100~1500 μg/mL,部分样品超出其检测范围,需要做浓缩或稀释处理。
与凯氏定氮法相比,改良Lowry法和考马斯亮蓝法则操作过程简单、迅速、试剂消耗量小,可以通过准确配取标准蛋白溶液,直接测定样品中蛋白质含量,排除凯氏定氮法中非蛋白氮对测定结果影响。表1结果显示考马斯亮蓝法测定值明显低于改良Lowry法测定值。与本实验结果相似,1976年,Bradford M M[9]指出BSA溶液酶解后考马斯亮蓝法测定其蛋白质含量结果要比酶解前低。马志鹏等[10]比较了改良Lowry法和考马斯亮蓝法测定标准牛血清白蛋白(BSA)水溶液在碱性蛋白酶水解前与后的蛋白质含量,其结果表明未进行酶解的BSA水溶液,两种方法测定的蛋白质含量相当;BSA水溶液酶解后,使用改良Lowry法测定的蛋白质含量与酶解前的值相近;使用考马斯亮蓝法测定蛋白质含量值较酶解前出现大幅下降。马志鹏等[10]比较了改良Lowry法和考马斯亮蓝法对O型口蹄疫病毒灭活抗原总蛋白含量测定,结果表明改良Lowry法能够更加精确、真实地反映O型口蹄疫病毒灭活抗原总蛋白含量。因此,改良Lowry法能较真实的反映口蹄疫灭活疫苗中蛋白质含量,与凯氏定氮法相比,此方法操作简单,工作效率高,而且低耗。
[1]Doel T R.Optimisation of the immune response to foot-andmouth disease vaccines[J].Vaccine,1999,17(13/14):1767-1771.
[2]薛景山.口蹄疫防疫问题解析[M].北京:中国农业出版社,2008.
[3]中国药典委员会.中华人民共和国药典二○一○年版[S].
[4]汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2000:77-100.
[5]Waterborg J H.The protein protocols handbook[M].Germany:Springer-Verlag,2009:7-10.
[6]中华人民共和国农业部.农办医[2013]32号文件[S].
[7]郭颖娜,孙 卫.蛋白质含量测定方法的比较[J].河北化工,2008,31(4):36-37.
[8]Kruger N J.The protein protocols handbook[M].Germany:Springer-Verlag,2009:17-24.
[9]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical biochemistry,1976,72(1):248-254.
[10]马志鹏,潘 倩,韦雪玲,等.改良Lowry法和 Bradford法测定O型口蹄疫病毒灭活抗原总蛋白含量的比较[J].甘肃科技,2012,28(2):142-143.

