改良考马斯亮蓝试剂法测定壳聚糖及其 衍生物中蛋白质含量
壳聚糖(Chitosan,CTS)是由甲壳素经脱乙酰基制成的一种聚阳离子大分子天然多糖,其安全无毒,可生物降解,具有良好的生物相容性,无免疫原性,具有抑菌[2]、消炎、止血[3]、镇痛[4]及促进伤口愈合等生物学功能。近年来国内外以壳聚糖为基础原材料的生物医用材料相关研究非常活跃,已成为多糖生物医用材料研究的一个热点。
壳聚糖主要来源于虾蟹壳,在制备纯化过程中虽然经强酸、浓碱反复处理[5]以除去大部分无机物和蛋白质等,但仍会有少量的蛋白质残留,因此壳聚糖及其衍生物应用于生物材料方面,检测控制其中的微量蛋白质含量对材料的安全性是非常必要的。
Folin-酚试剂法(Lowry法)和考马斯亮蓝法(Bradford法)是测定微量蛋白质常用的方法,灵敏度高,操作方便,应用广泛[1]。在测定壳聚糖及其带聚阳离子电荷的衍生物中的蛋白质含量时,Lowry法反应条件是在碱性和中性条件下进行,由于壳聚糖的水不溶性,壳聚糖衍生物如羧甲基壳聚糖(Carboxymethyl Chitosan,CM-CTS)、羟丙基壳聚糖(Chydroxypropyl Chitosan,HP-CTS)、羟乙基壳聚糖(Hydroxyethyl Chitosan,HE-CTS)等在偏碱性和中性pH条件下所带的-NH2/-NH3+可与Lowry试剂中的Cu2+离子结合而形成大量的絮状沉淀,故该法不适用于壳聚糖及其衍生物中蛋白质含量测定;Bradford法是在酸性条件进行的,所以壳聚糖以及壳聚糖衍生物如羧甲基壳聚糖、羟丙基壳聚糖、羟乙基壳聚糖等均可在此条件下进行蛋白质含量测定。但Bradford法试剂中含有多价负电荷的磷酸,能与壳聚糖及壳聚糖衍生物中的-NH2/-NH3+产生不溶性絮状沉淀,干扰了考马斯亮蓝试剂测定这类多糖中蛋白质含量的准确性,导致测定结果偏高。在大量实验研究的基础上,对Bradford法中的试剂进行了改良,将试剂中的磷酸改为盐酸。通过方法学验证,结果表明改良后的考马斯亮蓝试剂用于测定壳聚糖及其衍生物中可溶性蛋白含量,方法灵敏,结果准确可靠,操作方便,是一种适合于壳聚糖及其衍生物中微量蛋白含量测定的方法。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白、考马斯亮蓝G-250,Sigma公司产品;壳聚糖(CTS)、羧甲基壳聚糖(CM-CTS)、羟丙基壳聚糖(HP-CTS),由青岛博益特生物材料有限公司制备并纯化;其他试剂均为国产商品试剂分析纯。
1.2 仪器与设备
TU-1800s紫外可见分光光度计,北京普析通用仪器有限公司;AL-104电子精密天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 试剂配制
(1)标准蛋白质溶液。准确称取干燥至恒重的牛血清白蛋白(Bovine Serum Albumin,BSA)50.0 mg,置100 mL容量瓶中,加水至刻度定容,配制成500 μg·mL-1的蛋白质标准溶液。准确量取该标准蛋白质溶液20 mL,置100 mL容量瓶中,加水至刻度定容,配制成100 μg·mL-1的蛋白质标准溶液。临用前配制,4 ℃放置。
(2)壳聚糖样品溶液。准确称取干燥至恒重的壳聚糖0.5 g,置50 mL容量瓶中,加水充分悬浮,加冰乙酸0.5 mL振摇充分溶解,加水稀释至刻度,摇匀,配制成10 mg·mL-1的溶液,4 ℃下保存,一周内使用。
(3)羧甲基壳聚糖样品溶液。准确称取干燥至恒重的羧甲基壳聚糖0.5 g,置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀,配制成10 mg·mL-1的溶液,4 ℃下保存,一周内使用。
(4)羟丙基壳聚糖样品溶液。准确称取干燥至恒重的羟丙基壳聚糖0.5 g,置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀,配制成10 mg·mL-1的溶液,4 ℃下保存,一周内使用。
(5)经典考马斯亮蓝G-250试剂。称取100 mg考马斯亮蓝G-250,溶于50 mL 95%的乙醇中后,再加入100 mL 85%的磷酸,用水稀释到1 000 mL,过滤后备用。
(6)改良考马斯亮蓝G-250试剂。称取100 mg考马斯亮蓝G-250,溶于50 mL 95%的乙醇中后,再加入50 mL浓盐酸,用水稀释到1 000 mL,放置过夜,过滤后备用。
1.3.2 经典考马斯亮蓝试剂测定壳聚糖及其衍生物的蛋白质含量的方法
在洁净试管中分别依次加入不同量的标准蛋白质溶液,用水补足至1.0 mL进行标准蛋白标准曲线的测定,标准曲线的取样点应不低于5个;另取一个试管中加水1.0 mL作为空白对照;另取洁净试管加入样品溶液1.0 mL,平行样品应不少于3个;各加入考马斯亮蓝试剂5.0 mL,每管加毕后立即在旋涡混合器上混匀。混匀放置10 min后,在紫外可见光分光光度计上595 nm处测定相应光吸收值,以加水管为空白对照。以标准蛋白质浓度(μg·mL-1)为横坐标,相应蛋白标准品对应管吸光值A595nm为纵坐标,作图,即得蛋白质含量测定的标准曲线,按标准曲线计算样品的蛋白质含量。
1.3.3 改良考马斯亮蓝试剂测定壳聚糖及其衍生物的蛋白质含量的方法
在洁净试管中分别依次加入不同量的标准蛋白质溶液,用水补足至1.0 mL进行标准蛋白标准曲线的测定,标准曲线的取样点应不低于5个;另取一个试管中加水1.0 mL作为空白对照;另取洁净试管加入样品溶液1.0 mL,平行样品应不少于3个,各加入改良考马斯亮蓝试剂5.0 mL,每管加毕后立即在旋涡混合器上混匀。混匀放置10 min后,在紫外可见光分光光度计上(597±1)nm处测定相应光吸收值,以加水管为空白对照。以标准蛋白质浓度(μg·mL-1)为横坐标,相应蛋白标准品对应管吸光值A595nm为纵坐标,作图,即得蛋白质含量测定的标准曲线,按标准曲线计算样品的蛋白质含量。
1.4 不同酸对考马斯亮蓝试剂pH值、颜色和最大光吸收值的影响
考马斯亮蓝染料G-250染料在酸性溶液中与蛋白质结合,染料的最大峰的位置发生变化,据此实验采用了磷酸、冰醋酸、盐酸,分别配制考马斯亮蓝试剂,考察不同酸对考马斯亮蓝试剂的pH值、溶液颜色及最大光吸收值的影响,用于考察不同酸配制的考马斯亮蓝试剂测定蛋白质含量的可行性。
1.5 考马斯亮蓝试剂测定蛋白质含量稳定性考察
采用磷酸和盐酸分别配制考马斯亮蓝试剂,对两种试剂测定蛋白质的灵敏度和稳定性进行考察。
1.6 改良考马斯亮蓝试剂测定蛋白质含量的线性范围考察
采用经典和改良的考马斯亮蓝两种试剂分别测定不同蛋白质含量与最大吸光值(OD值)的线性关系,以评价改良考马斯亮蓝试剂测定蛋白质含量的可行性。
1.7 改良考马斯亮蓝试剂测定蛋白质含量回收率实验
取20支试管,编号0~20,其中0~5号分别加入不同量的蛋白质标准溶液,用水补足至1 mL,6~14号管分别加入不同量的已知蛋白含量的HP-CTS溶液,用蛋白质标准溶液补足至1 mL,15~20号管分别加入不同量的已知浓度的蛋白质溶液,用水补足至1 mL,按照改良考马斯亮蓝试剂蛋白质含量测定方法测定6~20管中的蛋白质浓度,测得蛋白质含量与理论上已知的蛋白质含量相比较,计算改良考马斯亮蓝试剂法测定蛋白质含量的回收率。
1.8 改良考马斯亮蓝试剂测定蛋白含量的最低检测限实验
将25.8 μg·mL-1标准蛋白质溶液稀释10倍,在紫外分光光度计上测定,以评价改良法测定蛋白质的最低检出限。
2 结果与分析
2.1 不同酸对考马斯亮蓝试剂pH值、颜色和最大光吸收值的影响
经典的考马斯亮蓝试剂的配制含有85%磷酸,该溶液的颜色为棕黑色,pH为0.58,最大光吸收峰在465 nm,与蛋白质反应后溶液的颜色变为蓝色,最大吸收峰移至595 nm。在考马斯亮蓝G250试剂用于测定壳聚糖及其衍生物中的蛋白质含量时,考虑到实际中的磷酸为三价强酸,可与具有-NH2/-NH3+的壳聚糖及壳聚糖衍生物产生正负电荷的结合,从而导致壳聚糖及壳聚糖衍生物大分子内或大分子间的絮凝,干扰了溶液的透明度,干扰了测定结果。
本实验选用了3种酸按比例配制考马斯亮蓝试剂,测定壳聚糖及其衍生物中的蛋白质含量。由表1可知,加入30~50 mL的盐酸后,试剂最大光吸收峰在465 nm附近,与蛋白质结合反应后其最大光吸收值为(597±1)nm,符合考马斯亮蓝试剂测定蛋白质含量的基本要求。
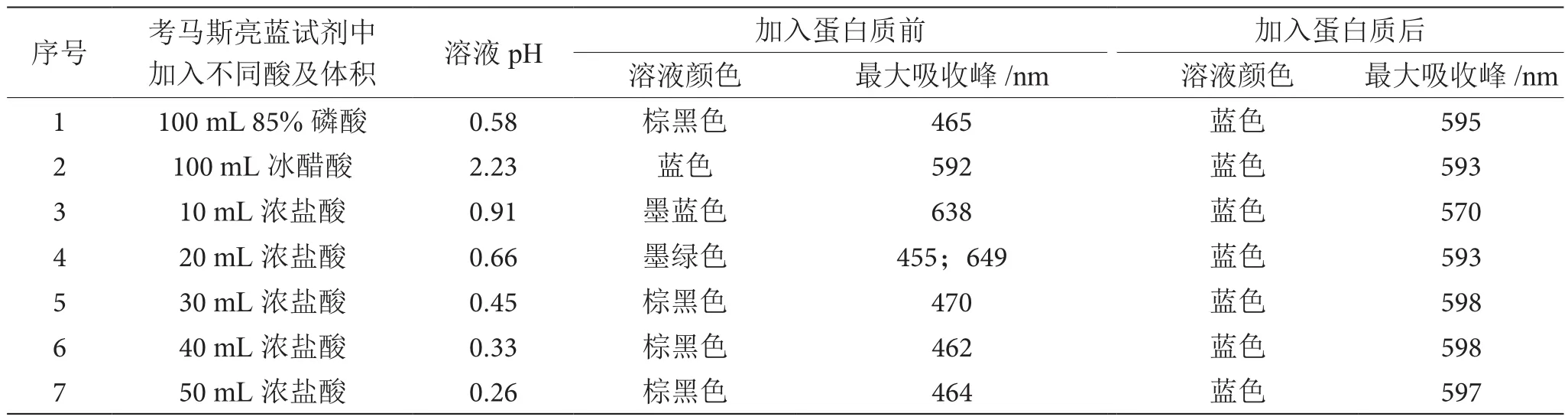
表1 不同酸的考马斯亮蓝试剂的性质表
2.2 稳定性实验结果
由表2、表3可知,经典法和改良法两种试剂与蛋白质反应后,溶液随时间延长其吸收值均相应下降,但20 min内均有很好的稳定性。对比40 mL、50 mL两种浓盐酸的加入量,加入50 mL浓盐酸的改良考马斯亮蓝试剂测定壳聚糖及其衍生物蛋白质含量时,溶液在20 min内稳定性更好。因此,选择加入50 mL的浓盐酸作为改良考马斯亮蓝试剂的配制方法,用于测定壳聚糖及其衍生物的蛋白质含量。
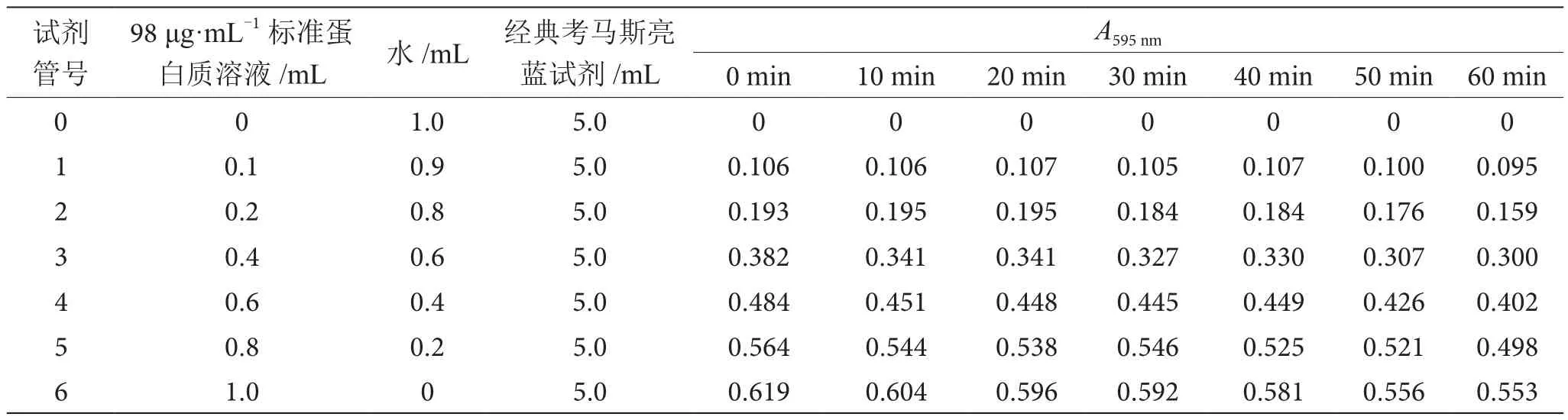
表2 经典考马斯亮蓝试剂与蛋白质形成溶液的稳定性实验结果表
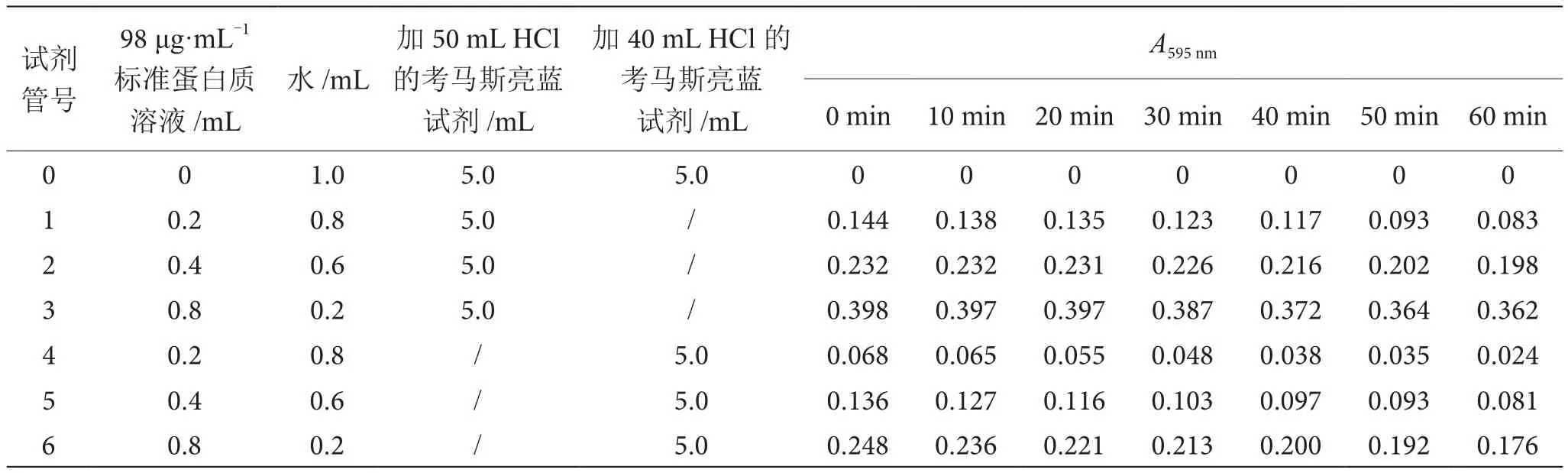
表3 加入不同盐酸量的考马斯亮蓝试剂与蛋白质形成溶液的稳定性实验结果表
2.3 线性范围实验结果
经典和改良考马斯亮蓝试剂测定标准蛋白质溶液的结果见表4,两种试剂测定标准蛋白质溶液曲线见图1、图2。由实验结果可看出,改良的考马斯亮蓝试剂与经典的考马斯亮蓝试剂测定蛋白质含量的线性数据基本一致,在0~104.0 μg·mL-1蛋白质浓度范围内,蛋白质浓度与光吸收均呈线性关系,R2分别可达到 0.994 4和 0.994 1。

表4 经典和改良考马斯亮蓝试剂测定标准蛋白质溶液的结果比较表
2.4 回收率实验结果
用传统考马斯亮蓝试剂测定蛋白质含量时,羟丙基壳聚糖(HP-CTS)受干扰最大,因此本实验以蛋白质残留为阴性的HP-CTS为实验样本进行回收率实验。由表5可知,回收率结果平均值为118.74%,表明用改良的考马斯亮蓝试剂测定壳聚糖及壳聚糖衍生物中微量蛋白质含量,回收率比较好。
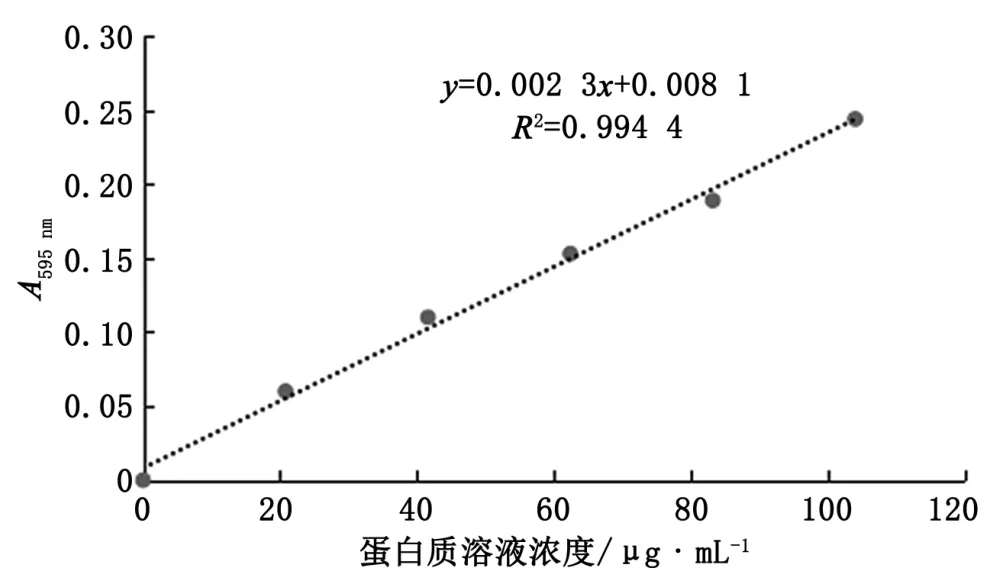
图1 经典考马斯亮蓝试剂的标准曲线图
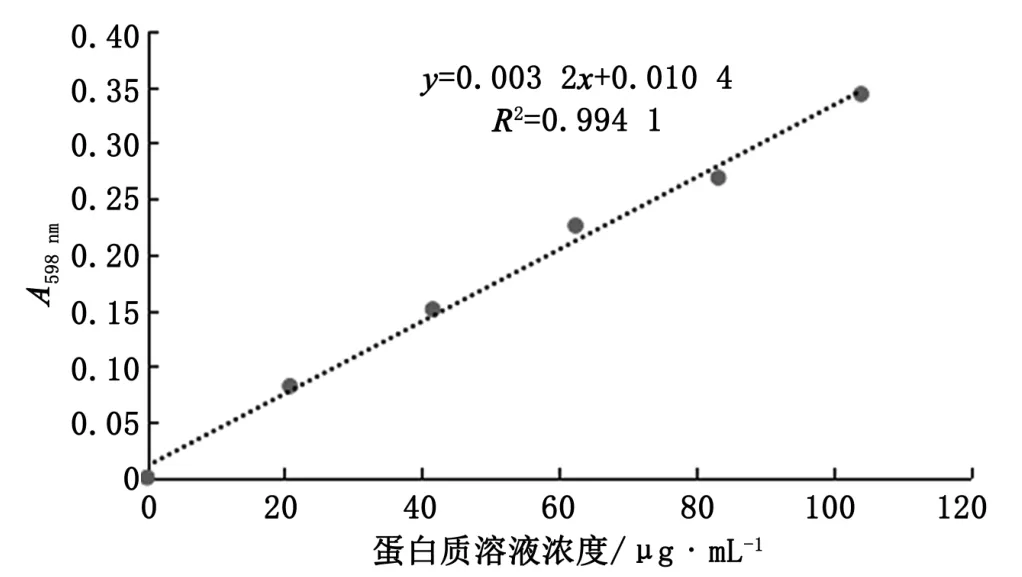
图2 改良考马斯亮蓝试剂的标准曲线图

表5 改良法测定蛋白含量回收率实验结果表
2.5 最低检测限实验结果
实验结果表明在蛋白质浓度为1.032 μg·mL-1时,改良试剂与蛋白质溶液反应后在(597±1)nm处仍有吸收,最低检测限约为 1 μg·mL-1。
2.6 经典和改良的考马斯亮蓝试剂测定CTS、CMCTS、HP-CTS中的蛋白质含量的比较
采用两种测定试剂分别对CTS溶液、CM-CTS溶液、HP-CTS溶液中的蛋白质含量进行测定,结果见表6。

表6 经典和改良考马斯亮蓝试剂测定CTS、CM-CTS、HP-CTS中蛋白质含量的结果表
由表6可知,经典的考马斯亮蓝试剂测定壳聚糖及其衍生物样品,壳聚糖及羟丙基壳聚糖溶液中呈现蓝色的细小悬浮颗粒,在沉淀不能去除的情况下测定OD值偏高;羧甲基壳聚糖溶液中多为蓝色絮状颗粒,颗粒沉降后的上清液测定OD值反而偏低。而改良的考马斯亮蓝试剂测定上述样品,检测液为澄清溶液。经典试剂中的多价磷酸可与壳聚糖及其衍生物的-NH2/-NH3+结合,产生不溶性的絮凝,溶液中形成大量蓝色的颗粒状或絮状沉淀,若沉淀悬浮在溶液中,测定的结果偏高,若沉淀沉降后,测定的结果又偏低,而采用改良后的考马斯亮蓝试剂测定同一份溶液的蛋白质含量时,溶液澄清透明,原因是消除了沉淀的干扰,测定结果可信。
3 结论
在测定壳聚糖及其衍生物中蛋白质含量时,由于壳聚糖及壳聚糖衍生物本身含有-NH2/-NH3+,能与加入磷酸的经典考马斯亮蓝试剂发生反应产生絮状沉淀,干扰了测定结果的准确度。经实验证明,在配制考马斯亮蓝试剂时用50 mL的浓盐酸代替磷酸,配制的考马斯亮蓝试剂与蛋白质形成的复合物在20 min内稳定,线性R2可达到0.994 1,回收率为118.74%,最低检测限可达到1 μg·mL-1。在测定壳聚糖及壳聚糖衍生物中蛋白质含量的实验中,溶液澄清透明,测定的结果可信。

