苍白球内侧部、黑质网状部与运动调控
胡荣光,刘晓莉,侯莉娟,乔德才
(北京师范大学 体育与运动学院,北京 100875)
躯体运动是人体一切行为活动的基础。躯体运动由中枢运动控制系统发起和维持,并通过外周神经支配肌肉来实现。中枢运动控制系统以三个等级的方式组构:最高水平以大脑新皮质的联合皮质和大脑基底神经节为代表,负责运动的战略;中间水平以运动皮质和小脑为代表,负责运动的战术;最低水平以脑干和脊髓为代表,负责运动的执行。其中基底神经节在运动的发起和调节中起着重要作用。
20世纪90年代以来,我们对基底神经节的理解有了本质上的变化。从那时起,基底神经节环路被描述为由直接通路和间接通路(后来又发现超直接通路)组成,这些通路上某些核团的神经元电活动的变化可以用来解释一些运动障碍疾病的机理。之后的20年里,关于基底神经节功能的研究成果迅速增多。然而,直到今天我们仍然不能对一个简单的问题给予确切的答案——基底神经节的基本功能究竟是怎样的[1]?不过,综合目前国内外在该领域的研究成果,其中关于某些核团——比如苍白 球内侧部(Internal segment of the globus pallidus,GPi)和黑质网状部(Substantia nigra pars reticulata,SNr)——在运动障碍疾病的机理和在运动调控的机制中的研究,对于进一步解开这个谜团提供了有价值的线索。本文综合近年来国内外关于苍白球内侧部和黑质网状部在运动调控方面的一些研究进展,分析两者在基底神经节功能实现中的作用,希望对于进一步研究GPi/SNr以及基底神经节的基本功能起到一定的提示和借鉴作用。
1 基底神经节与运动调控
1.1 基底神经节概述
基底神经节是位于大脑两半球深部的一些皮层下神经核团的总称,包括尾状核、壳核、苍白球、黑质、丘脑底核(Subthalamic nucleus,STN)和杏仁核。基底神经节与运动有关的神经联系主要由三条神经环路组成,即直接通路(皮层—纹状体—GPi/SNr—丘脑—皮质)、间接通路(大脑皮层—纹状体—苍白球外侧部 〈External segment of the globus pallidus,GPe〉—STN—GPi/SNr—丘脑—皮质)和超直接通路(皮层—STN—GPi/SNr—丘脑—皮层)[2-3]。在基底神经节中,纹状体是运动信息的主要输入核团,而GPi/SNr是主要输出核团。
基底神经节的神经环路由内部错综复杂的纤维联系构成了一个复杂的神经网络,其间又有多种神经递质的参与,这就使研究其功能异常困难,许多机理至今仍不十分清楚。目前认为基底神经节的主要功能是运动调控,此外还在认知活动中起一定作用。基底神经节调控运动是通过直接和间接两个通路实现的,两个通路的上游输入核团——纹状体活动的变化,通过两条通路的传递之后,会引起下游输出核团GPi/SNr产生两种不同的变化。当纹状体神经元兴奋时,一方面通过直接通路释放更多的GABA 抑制GPi/SNr的活动;另一方面通过间接通路释放更多的GABA 抑制GPe的活动,从而减少GPe对STN 的抑制,使得STN 释放更多的Glu,进而引起GPi/SNr的兴奋性增强。两种相反的信息在GPi/SNr整合,“调节”GPi/SNr向丘脑释放GABA 的量,影响丘脑的活动,并最终影响运动皮层的兴奋性。
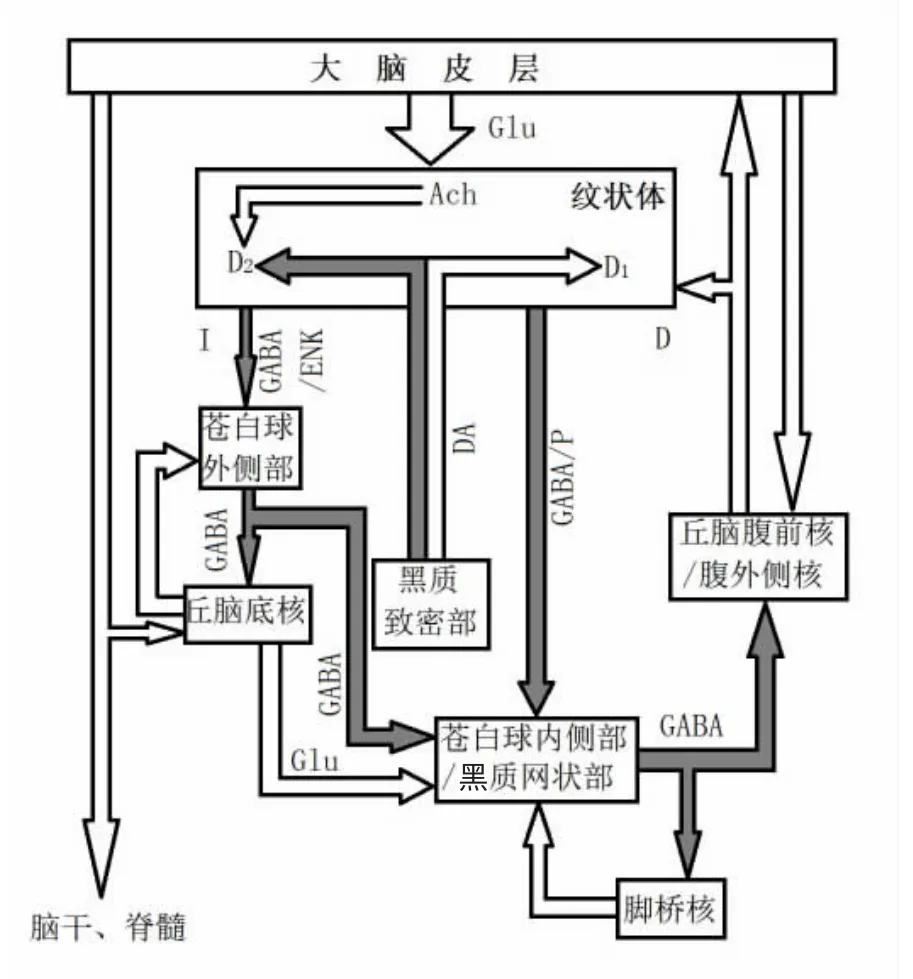
图1 皮质—基底节—丘脑—皮质环路示意图
1.2 躯体运动传导通路
躯体运动是由运动中枢产生并传导运动指令,周围运动神经元通过神经肌肉接点引起肌肉产生收缩或舒张而实现的。大脑皮质、基底神经节、小脑、脊髓等结构的神经元以突触连接方式构成从大脑皮质至骨骼肌的神经链,通过此神经链传导各级神经冲动,最终控制和影响骨骼肌的运动,此神经链被称为人体躯体运动传导通路。
躯体运动传导通路可分为锥体系、锥体外系、最后公路三部分。锥体系是指从大脑皮质至骨骼肌的管理骨骼肌运动的神经元;锥体外系是指除锥体系统外控制骨骼肌运动的其他神经结构,包括大脑皮质、纹状体、背侧丘脑、丘脑底核、中脑顶盖、前庭核群、红核、黑质、脑桥核、小脑和脑干网状结构等;最后公路是指在脊髓灰质前角的脊髓α运动神经元和在脑干的脑神经核中的脑运动神经元,它们接受从脑干到大脑皮层各级高位中枢发出的下传信息,也接受来自躯干、四肢和头面部皮肤、肌肉和关节等处的外周传入信息,并对这些信息进行整合,产生一定形式和频率的反射传出冲动,直达所支配的骨骼肌。
其中锥体外系有调节躯体活动的重要功能,它调节运动功能的中心在基底神经节。所以从锥体外系的功能角度而言,主要指基底神经节的部分。
2 GPi/SNr的纤维联系及功能
GPi/SNr是基底神经节输出通路——“GPi/SNr-VLSMA”通路上的重要核团;直接通路、间接通路和超直接通路的信息最终都要经这两个核团整合以及丘脑中继后,最终传输回皮层。GPi和SNr有着相似的投射纤维,都接受来自纹状体、苍白球外侧部的GABA 能纤维投射以及来自丘脑底核的Glu能纤维投射,都发出GABA 能纤维投射至丘脑。因此,人们往往把GPi和SNr当成一个“联合体”,但它们在功能上还存在细微的区别。Nambu认为,GPi与广泛运动皮层有较强的相互作用,控制感觉—运动行为;而SNr与前运动皮层有相互作用,控制联合功能[4]。
2.1 GPi的纤维联系
GPi在啮齿类动物中又叫脚内核(Entopeduncular nucleus,EP),大鼠的GPi约有3 200个神经元[4]。其神经元有相对较大的胞体(20—60μm),树突稀疏,树突棘也较少。神经元自发放电频率约6 Hz,自发放电主要表现出规则、不规则和爆发式3种类型。
GPi的传入纤维较多,包括来自纹状体的GABA 能传入纤维(70%)和P 物质传入纤维,来自苍白球外侧部的GABA 能传入纤维(15%),来自丘脑底核的Glu能神经纤维(10%),以及来自板内核的Glu能纤维、中缝背核的5-HT 能纤维、脚桥被盖核的Glu能和胆碱能纤维以及黑质致密部的DA 能纤维等的传入。根据纤维联系和功能的不同,GPi被分为运动区(腹侧,约占2/3)、联合区(背侧,约占1/3)和边缘区(中缝位置)三部分,不同的传入纤维分别投射在GPi的不同区域[4]。
GPi发出GABA 能纤维主要投射到丘脑腹前核、丘脑腹外侧核,另有少部分投射至丘脑中央中核、缰核和伏隔核。GPi到丘脑的投射纤维主要投射到丘脑投射神经元的胞体和树突;此外,其投射纤维还与丘脑中间神经元联系。这种纤维联系表明GPi投射纤维不仅能直接抑制丘脑投射神经元的活动,而且能通过丘脑中间神经元“去抑制”其投射神经元。
GPi的GABA 受体包括GABAAR(主 要 由α1、β2 和γ2亚基组成)、GABABR(由R1和R2亚基组成),GABA在突触间隙扩散或被GABA 转运体(GABA transporters,GATs)重摄取。GPi的Glu受体主要是AMPAR 和NMDAR,Hanson等发现mGluR1在“纹状体—GPi”的突触前膜和后膜上均有分布。Yung等发现D1 受体在GPi也有分布,但尚未发现GPi处有DA 的释放[5]。
2.2 SNr的纤维联系
SNr位于黑质致密部和大脑脚之间,由GABA 能神经元组成,大鼠的SNr约有26 300个神经元[6]。GABA 能神经元为中等大小多角形,分支不多,有3—5条树突干,覆盖着稀疏的树突棘;此外还有覆盖区域少的GABA 能神经元,其树突细,可能是中间神经元。GABA 能神经元频率为(11.4+0.8)Hz[7],动作电位时程短(<1ms),后超极化电位呈两相,膜电位超极化时没有内向性或外向性整流。
大量纹状体神经纤维投射到SNr,占SNr神经传入的绝大部分;一个纹状体投射神经元同时又支配着多个SNr神经元,因此SNr神经元的神经传入呈高度汇聚状态。纹状体的神经末梢主要与SNr神经元的树突干形成对称性突触,以GABA 作为神经递质。直径一般大于1μm 的GPe神经末梢与SNr神经元的胞体(59%)和近端树突(37%)形成对称性突触,且GPe神经末梢一条轴突与多个SNr神经元的胞体和近端树突形成突触联系,并以GABA 作为神经递质,如此构成蕊筐样的支配关系。SNr主要的兴奋性传入来自于STN 的传入神经支配,STN 神经末梢与SNr神经元形成非对称性突触,以Glu作为神经递质[8]。SNr除发出GABA 能纤维投射至丘脑(腹前核、腹外侧核)外,还发出GABA 能纤维至上丘。SNr的GABA 受体主要是GABAA受体(主要由α1和β2亚基组成)。SNr的Glu受体除了有AMPAR 和NMDAR 之外,王智明等还发现mGluR1α亚型在黑质网状部分布较多。
3 GPi/SNr与运动调控
GPi/SNr的GABA 能神经元投射直接调控着丘脑和脑干运动核团的功能,因而GPi/SNr内GABA 能神经元活动的变化将引起基底神经节的最终传出信息的改变。Nambu等[9]发现来自大脑皮层的运动信息,分别经超直接通路、直接通路和间接通路先后到达GPi/SNr(在三条通路上的传递时间分别为7.8ms、20.9ms和29.9ms),信息到达GPi/SNr后可引发上述两核团神经元电活动出现一个“增强—抑制—增强”的动态变化过程。GPi/SNr通过抑制性GABA能神经纤维与丘脑连接,经丘脑中继又返回大脑皮层(丘脑与皮层间经Glu能神经纤维连接),因此,GPi/SNr神经元电活动“增强—抑制—增强”的动态变化过程可引发大脑皮层神经元电活动相应出现一个“抑制—增强—抑制”的动态变化。抑制阶段,运动信息在基底神经节内的传递由超直接通路完成,STN 神经元被激活,并与GPi/SNr之间有着广泛的纤维投射,所以经丘脑中继后,可以引起大脑皮层广泛区域神经元电活动的抑制,这在一定程度上降低背景“噪音”和抑制不必要的动作产生;增强阶段,运动信息在基底神经节内的传递由“直接”通路完成,此通路中纹状体与GPi/SNr之间纤维投射相对较少,因此经丘脑中继到达皮层后,仅“运动计划”所在脑区被释放,神经元电活动增强,运动计划被执行;再抑制阶段,运动信息在基底神经节内的传递由“间接”通路完成,STN 神经元再次被激活,“运动计划”所在脑区重新被抑制,运动计划终止。通过此模型,可以精确地实现运动的发起和停止[10]。
正常情况下,直接和间接通路相对平衡的“兴奋—抑制”信息通过GPi/SNr传递到丘脑,最终传回大脑皮层,这些信息包括一个运动方案的执行与否、运动方案的执行部位和方向等具体参数。可见,GPi/SNr在人体运动动作的执行与控制过程中具有重要的作用,其活动的激活与“运动计划”的选择或终止有关。
3.1 GPi与运动调控
研究发现,损毁帕金森病大鼠的GPi感觉运动区(腹侧),其运动障碍症状减轻;而损毁GPi的外侧,其认知障碍症状减轻。这说明GPi与运动相关的神经元位于GPi的腹侧[11]。大多数GPi神经元改变其放电晚于运动皮层神经元,且比肌肉活动的开始晚80—100 ms[12]。有研究表明,PD 动物的GPi神经元放电频率较正常动物增加20%—50%,其爆发式的放电类型显著增加。为此,人们设计了通过脑深部电刺激GPi治疗帕金森病的手术方法,发现可以缓解运动症状和左旋多巴胺引起的异动症。在继续给予左旋多巴胺的情况下,刺激腹侧GPi能使异动症和僵直得到改善,但运动不能症状却恶化;而若停止服用左旋多巴胺,刺激背侧GPi可以缓解运动不能和减轻异动症。这表明GPi的运动调控功能具有差异性[13]。但后来人们发现,脑深部电刺激GPi会有明显的副作用,而且由于GPi相对较大,深部电极位置的差异会导致疗效变化。于是又出现了脑深部电刺激STN 治疗PD 的方法,这一方法比刺激GPi的疗效更好[14]。
3.2 SNr与运动调控
研究发现,帕金森大鼠中SNr的GABA 能神经元自发性放电频率显著增高,其中呈簇状放电的神经元比例显著增加;帕金森病大鼠通过损毁患侧STN 后,SNr神经元的自发放电频率恢复正常,簇状放电减少,阿扑吗啡引起的旋转行为明显受到抑制[15]。癫痫模型大鼠发作一天后,局部SNr簇状放电的神经元比例增加,放电频率增高;给予癫痫模型大鼠抗癫痫药物后,可使兴奋的SNr神经元恢复正常状态;提示SNr及其相关基底神经节运动环路对癫痫和帕金森病的发作起着重要的门控作用。通过直接抑制SNr兴奋性,或者减少STN 对SNr的兴奋性传入来间接抑制SNr的兴奋性,都可以提高癫痫发作的阈值[16]。近年来已将SNr和直接兴奋SNr的STN 作为临床治疗癫痫和帕金森病的靶核团,用高频刺激丘脑底核将诱导Glu能神经元兴奋性输出的降低,从而导致SNr神经元的失活,SNr抑制驱动的降低导致了VL 的去抑制,最终导致运动皮层系统的激活[17]。另有研究表明,黑质网状部波频过度降低和异常波的出现与异动症的发生密切相关,可以作为评定大鼠异动症的一项指标[18]。黑质网状部有调节姿势和运动的功能,自主运动或跑台运动中SNr的电活动增加起主导作用,约80%的SNr神经元放电增加与大肌肉群的身体运动同步[19],黑质网状部在运动功能障碍性疾病的发病过程中发挥着重要作用。
4 GPi/SNr与帕金森病
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,因最早描述该病的是一位名叫詹姆·帕金森的英国医生而得名。该病主要源于中脑黑质致密部多巴胺神经元退行性病变导致的多巴胺与乙酰胆碱平衡失调。主要的临床特征包括静止性震颤、肌强直、运动迟缓和姿势步态异常等,还可出现认知功能下降、情绪障碍等非运动症状。目前,PD 的发病机制尚未完全阐明,其治疗存在诸多困难。
通常情况下,激活直接通路可易化运动功能,激活间接通路可抑制运动功能,正常时两者功能处于动态平衡状态,制约这种平衡的是“黑质致密部—新纹状体DA 系统”。自黑质致密部的DA 神经元发出纤维到新纹状体,释放DA,与新纹状体两种受体结合,一种是作用到新纹状体的D1受体上,可激活直接环路,产生易化运动的效应;另一种是作用到新纹状体的D2受体上,对间接环路起抑制作用,也同样产生易化运动的效应[2]。帕金森病患者黑质致密部多巴胺神经元退行性病变甚至坏死,使得“黑质致密部—新纹状体DA 系统”对运动的易化作用逐步丧失,“STN-GPi/SNr”活动过强,影响了运动方案的正常选择或终止,从而产生了帕金森病的一系列症状。
近年来,STN 深部脑刺激治疗帕金森病取得了良好效果。通过一个适宜幅度和频率的刺激信号对STN 进行一定时间的刺激,可以更有效改善帕金森病人的震颤、运动失能等症状;但目前对STN高频刺激(STN-High frequency stimulation,STN-HFS)治疗帕金森病的机制尚无定论。很多学者认为STN-HFS通过抑制STN 神经元的活动来发挥作用,经STN 释放的Glu少了,因此GPi/SNr被抑制。但是,Francois Windels[20]的研究表明,STN-HFS会引起SNr的Glu和GABA 同时升高。Zhang等人用丘脑底核电刺激技术研究SNr胞外Glu和GABA 浓度的变化,也发现刺激丘脑底核引起SNr胞外Glu和GABA 浓度均升高[21],但GABA 浓度升高更显著。Cl'ementine Bosch等人用膜片钳技术研究高频刺激丘脑底核治疗帕金森病的机制,他们通过观察SNr核团的突触后电流变化,发现STN-HFS使PD 病理状态下高度兴奋的STN-SNr突触活动得以恢复正常。STNHFS通过在SNr重建了一种“兴奋—抑制”活动的平衡,从而达到治疗的目的[22]。
5 小结
综上所述,GPi和SNr在基底神经节中的作用可归纳为:GPi/SNr兴奋时,运动终止或暂停;GPi/SNr抑制时,运动方案进行。GPi/SNr的兴奋对于运动方案的选择(或运动的调节)具有重要的意义。帕金森病使间接通路中“STN-GPi/SNr”活动过强,影响了运动方案的正常选择或终止,进而导致了一系列症状的产生;通过一定的治疗手段(如STN-HFS)重建GPi/SNr的“兴奋—抑制”活动的平衡状态,可以达到治疗帕金森病的目的。
GPi和SNr作为基底神经节的两个输出核团,具有相似的神经纤维联系,同时又分别有不同的传入纤维和投射核团。这提示我们,二者在整合直接通路和间接通路的信息并向下游核团传递的过程中,似乎承担着相似又有区别的任务。GPi、SNr在整合基底神经节直接和间接通路的信息中的作用有什么差异?这可能是我们研究基底神经节功能的又一个突破点。
[1]Nambu A.Seven problems on the basal ganglia[J].Neurobiology,2008,18(6):595-604.
[2]李国彰.神经生理学[M].北京:人民卫生出版社,2007:282.
[3]王景.帕金森病大鼠苍白球神经元放电模式的分析[D].西安:第四军医大学,2008.
[4]Nambu A.Globulus pallidus internal segment[J].Progress in Brain Research,2007,160:135-150.
[5]Blandimi F,Nappi G,Tassorelli C,et al.Functional changes of the basal ganglia circuitry in Parkinson’s disease[J].Progress in Neurobiology,2000,62(1):63-88.
[6]Smith Y,Bevan M D,Shink E,et al.Microcircuitry of the direct and indirect pathways of the basal ganglia[J].Neuroscience,1998,86(2):353-387.
[7]崔建华,刘斌,戴振东,等.大鼠尾壳核对同侧黑质网状部神经元电活动的影响[J].生物医学工程研究,2011,30(3):133-137.
[8]张贝.黑质区微注射鱼藤酮对大鼠纹状体和丘脑腹外侧核神经元电活动的影响[D].上海:华东师范大学,2007.
[9]Nambu A,Takada M,lnase M,et al.Dual somatotopical representations in the primate subthalamic nucleus:evidence for ordered but reversed body-map transformations from the primary motor cortex and the supplementary motor area[J].J Neurosci,1996,16(8):2671-2683.
[10]Belujon P,Grace A A.Reorganization of Striatal Inhibitory Microcircuits Leads to Pathological Synchrony in the Basal Ganglia[J].Neuron,2011,71(5):766-768.
[11]Smith Y,Wichmann T.Functional Anatomy and Physiology of the Basal Ganglia:Motor Functions[C]//Tarsy D.Current Clinical Neurology:Deep Brain Stimulation in Neurological and Psychiatric Disorders.Totowa:Humana Press,2008:3-32.
[12]Hoover J E,Strick P L.The Organization of Cerebel-lar and Basal Ganglia Outputs to Primary Motor Cortex as Revealed by Retrograde Transneuronal Trans-port of Herpes Simplex Virus Type 1[J].The Journal of Neuroscience,1999,19(4):1446-1463.
[13]王广鹏,徐海燕,何德福,等.苍白球功能变化与帕金森症[J].中国病理生理杂志,2010,26(2):396-400.
[14]Benabid A L,Benazzous A,Pollak P.Mechanisms of deep brain stimulation[J].Movement Disorders,2002,17(3):S73-S74.
[15]Bolam J P,Hanley J J,Booth P A C,et al.Synaptic organisation of the basal ganglia[J].J.Anat,2000,196:527-542.
[16]Henderson J M,Stank D,Tomas D,et al.Postural changes after lesions of the substantia nigra pars reticulata in hemiparkinsonian monkeys[J].Behav Brain Rca,2005,160(2):267-276.
[17]Benazzouz A,Gao D M,Ni Z G,et al.Effect of highfrequency stimulation of the subthalamic nucleus on the neuronal activities of the substantia nigra pars reticulata and ventrolateral nucleus of the thalamus in the rat[J].Neuroscience,2000,99(2):289-295.
[18]徐岩,张婷,曹学兵.左旋多巴诱发异动症大鼠模型黑质网状部电活动的研究[J].脑与神经疾病杂志,2008,16(6):663-665.
[19]Gulley J M,Kosobud A,Rebec G V.Behavior-related modulation of substantia nigra pars reticulata neurons in rats performing a conditioned reinforcement task[J].Neuroscience,2002,111(2):337-349.
[20]Windels F,Bruet N,Poupard A,et al.Influence of the Frequency Parameter on Extracellular Glutamate andγ-Aminobutyric Acid in Substantia Nigra and Globus Pallidus During Electrical Stimulation of Subthalamic Nucleus in Rats[J].Journal of Neuroscience Research,2003,72(2):259-267.
[21]Zhang B,Chu J S,Zhang J G,et al.Change of Extracellular Glutamate and Gamma-Aminobutyric Acid in Substantia Nigra and Globus Pallidus during Electrical Stimulation of Subthalamic Nucleus in Epileptic Rats[J].Stereotact Funct Neurosurg,2008,86(4):208-215.
[22]Bosch C,Degos B,Deniau J M,et al.Subthalamic nucleus high-frequency stimulation generates a concomitant synaptic excitation-inhibition in substantia nigra pars reticulate[J].J Physiol,2011,589(17):4189-4207.

