抗GPC3 C端抗体辅助杀伤肝癌细胞HepG2的活性检测及抗原表位鉴定
张红飞 ,张慧娜 ,李军锋 ,于虹 ,代晓朋 ,赵光宇 ,郭彦 ,王凯娟 ,张建营 ,周育森
1.郑州大学 公共卫生学院,河南 郑州 450001;2.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
原发性肝癌是全球最常见的恶性肿瘤之一,其发病率呈上升趋势[1]。我国肝癌的发病率及死亡率均位于恶性肿瘤的第二位[2]。早期诊断、早期治疗对提高肝癌患者的生存质量具有十分重要的意义。磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)是硫酸类肝素蛋白聚糖家族成员,其相对分子质量为60×103~70×103,通过糖基磷脂酰肌醇结合于细胞表面[3]。研究表明,GPC3在肝癌细胞中异常表达,而在正常肝细胞和其他非肿瘤肝病细胞表面未见表达[4-7],使得GPC3可能成为新的血清学指标,用于肝癌患者的早期诊断[8]。GPC3除了在肝癌诊断上的应用之外,其膜蛋白的性质决定了其可以作为免疫治疗靶点。Ishiguro等发现,制备的抗 GPC3 C端(524~563残基)单克隆抗体可以在体外抑制Huh7细胞的生长,其辅助杀伤肿瘤活性在于其参与的抗体依赖细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxity,ADCC)作用,裸鼠体内移植模型研究发现,抗GPC3抗体GC33可以抑制HepG2或Huh7移植模型的肿瘤生长,并促进化疗药物对肿瘤的杀伤作用,同时能明显降低表达GPC3的肝癌鼠血清GPC3和甲胎蛋白(AFP)水平[9-12]。
抗体是否诱导ADCC或补体依赖的细胞毒性(CDC)杀伤肿瘤活性,主要取决于其识别的表位[9]。为了寻找抗肝肿瘤更为有效的抗体,前期我们制备了7株抗GPC3 C端(编码359~580残基)的单克隆抗体[13],在本研究中,我们检测了这7株单抗是否通过ADCC杀伤肝肿瘤细胞,并分析了其识别的表位。
1 材料与方法
1.1 材料
7株抗GPC3 C端单抗由本室制备;HepG2细胞由本研究室留存;大肠杆菌DH5α感受态和BL21(DE3)感受态、小量质粒提取试剂盒和DNA凝胶回收试剂盒、DNA标准marker均购自北京全式金生物技术有限公司;克隆载体pMD18-T、限制性内切酶、SolutionⅠ连接酶均购自TaKaRa公司;原核表达载体 pGEX-4T-1、苯甲基磺酰氟(PMSF)购自 Amer⁃sham公司;IPTG购自Promega公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自北京中杉金桥公司;ELISA用显色液和终止显色液购自北京万泰药业有限公司;多功能酶标仪购自BioTek公司;West⁃ern印迹显色试剂盒购自北京普利莱基因技术有限公司;牛血清白蛋白(BSA)购自Sigma公司;胎牛血清、DMEM培养基购自Gibico公司;重组人白细胞介素2(IL-2)购自北京双鹭药业公司;引物由上海生工生物工程有限公司合成。
1.2 抗GPC3 C端抗体辅助杀伤肝肿瘤细胞的活性检测
单克隆抗体的杀伤肿瘤活性检测使用细胞增殖法[14]检测ADCC效应,以小鼠脾细胞为效应细胞,靶细胞为表达GPC3的肝癌细胞HepG2。实验分为ADCC杀伤组、效应细胞非特异杀伤组、抗体非特异毒性对照组和单独靶细胞组。其中,ADCC杀伤组体系中包含效应细胞、靶细胞和单抗(共7个处理,分别用1~7号单抗),效应细胞非特异杀伤组体系中包含效应细胞和靶细胞,抗体非特异毒性对照组包含靶细胞和单克隆抗体(共7个处理,分别用1~7号单抗),单独靶细胞组只包括HepG2靶细胞。靶细胞数目为8000/孔,效应细胞与靶细胞的比例为2∶1。另外,每组均加入重组人IL-2 100 U/mL。每组均重复6次。
上述体系加入96孔细胞培养板中,于5%CO2、37℃培养箱中培养72 h后,在样品和空白孔中每孔加入20 μL 5 mg/mL的MTT溶液,于5%CO2、37℃培养箱中继续培养4 h,吸弃孔内上清,每孔加入150 μL DMSO混匀溶解后测量D490nm值,以检测存活的细胞数目。以P<0.05为检验水准,判定ADCC杀伤组与效应细胞非特异杀伤组间D490nm值、抗体非特异毒性对照组与单独靶细胞组间D490nm值差异是否具有统计学意义,从而判定不同抗体是否具有辅助杀伤肝肿瘤的活性。
1.3 GPC3 C端蛋白的截短表达载体构建
根据GenBank中GPC3已知序列(GenBank登录号:L47125.1),用生物信息学分析软件GoldKey对GPC3 C端进行蛋白结构及抗原表位分析,预测其优势表位,并据此将其分4个片段进行截短表达,分别命名为F1~F4,设计克隆引物名称和序列如表1。
以前期构建的含GPC3 C端359~580残基编码基因的质粒为模板,PCR扩增F1~F4编码基因,分别连接pMD18-T克隆载体,经序列测定后将序列正确的克隆用BamHⅠ和SalⅠ酶切,回收目的片段后分别连接经同样酶切回收的pGEX-4T-1原核表达载体,氨苄西林抗性选取单克隆菌落,扩增后提取质粒,用PCR方法鉴定,扩增片段理论大小分别为213、153、153和195 bp。将经PCR鉴定正确的质粒交北京奥科鼎盛生物科技公司测序,正确重组的克隆分别命名为pGEX-GPC3C-F1~pGEX-GPC3CF4。

表1 GPC3 C端截短片段基因克隆引物
1.4 GPC3截短片段重组蛋白的表达及纯化
将构建的pGEX-GPC3C-F1~pGEX-GPC3C-F4质粒分别转化大肠杆菌BL21(DE3)感受态细胞,以1 mmol/L IPTG诱导4 h以表达蛋白,离心收菌后加入PBS重悬,以4×SDS上样缓冲液处理样品,以未诱导细菌为对照进行SDS-PAGE,分析GST-GPC3CF1~GST-GPC3C-F4共4种蛋白的表达,4种蛋白的理论相对分子质量分别约为 34×103、32×103、32×103和33×103。将成功表达的克隆菌转接250 mL LB培养液,IPTG过夜诱导以大量表达蛋白,离心收菌后加入超声缓冲液(20 mmol/L磷酸钠,500 mmol/L NaCl,pH7.8)和终浓度为1 mmol/L的PMSF,用超声波细胞破碎机以100 W的功率超声15 min,离心后沉淀以包涵体洗涤液(50 mmol/L Tris-HCl,100 mmol/L NaCl,10 mmol/L EDTA,0.5% Triton-X100)洗涤3次后溶于含8 mol/L尿素的包涵体溶解液中,样品于-80°C保存。采用已报道的方法[15]切胶回收,浸提纯化蛋白后进行SDS-PAGE,观察4种蛋白的纯化结果。
1.5 间接ELISA法分析抗GPC3 C端单克隆抗体识别的表位
将纯化的 GST-GPC3C-F1~GST-GPC3C-F4蛋白定量后分别稀释至 0.5 μg/mL,100 μL/孔、4℃过夜包被于酶标板中,每种蛋白包被一个96孔板。以封闭液(含2%BSA的PBS溶液)封闭后,均以不加抗体作为阴性对照,以7株抗GPC3 C端单抗(以1∶100为起始稀释度,倍比稀释12个梯度)为一抗、HRP标记的山羊抗小鼠IgG(1∶10 000稀释)为二抗。分别加入一抗和二抗,37℃各温育1 h后加入显色液显色10 min,终止显色,以多功能酶标仪测定D450nm值,观察各抗体在以不同片段蛋白包被情况下的D450nm值大小及随抗体浓度下降D450nm值的下降情况,以初步判定其表位结合情况。
1.6 Western印迹分析抗GPC3 C端单克隆抗体识别的表位
将GST-GPC3 C端全长蛋白及纯化的GSTGPC3C-F1~GST-GPC3C-F4蛋 白 进 行 7次 SDSPAGE,电转移至PVDF膜上,转移后的膜于封闭液(含5%脱脂牛奶的TBS溶液)中封闭后,分别与7株抗GPC3 C端单抗(1∶500稀释)和HRP标记的山羊抗小鼠IgG(1∶10 000稀释)共孵育,洗膜后加入化学发光剂ECL,在暗室中曝光,显影,定影,在胶片上获得相应的条带,观察各抗体与GST-GPC3 C端全长蛋白及纯化后的GST-GPC3C-F1~GST-GPC3CF4蛋白的结合情况,从而判定其表位结合情况。
2 结果
2.1 抗体辅助杀伤肝肿瘤的活性检测
依据上述分组及实验方法铺96孔细胞培养板,于5%CO2、37℃培养箱中培养72 h后,MTT法检测D490nm值。经统计学分析,抗体非特异毒性对照组与单独靶细胞组间D490nm值差异均无统计学意义(图1A),说明单独抗体对肝肿瘤HepG2细胞无直接杀伤作用;而各株抗体对应的ADCC杀伤组与效应细胞非特异杀伤组间D490nm值差异均有统计学意义(图1B),表明7株抗体均具有不同程度的辅助杀伤作用,其中以5号单抗的杀伤效果最好。
2.2 GPC3 C端的表位预测分析及重组表达
用生物信息学技术对GPC3 C端抗原表位进行分析,预测发现4个优势表位,其相应的位置和氨基酸序列见表2。
根据表位位置,将GPC3 C端截短为4个片段,分别为GPC3C-F1(359~425残基)、GPC3C-F2(426~472残基)、GPC3C-F3(473~525残基)和GPC3C-F4(526~580残基)。PCR扩增GPC3C-F1~GPC3C-F4编码基因,分别连接pMD18-T克隆载体,经序列测定后依据上述方法连接到pGEX-4T-1原核表达载体中,氨苄西林抗性选取单克隆菌落,扩增后提取质粒,用PCR方法进行鉴定,结果如图2所示,鉴定正确的质粒经测序后证明与GST正确融合且未发生序列突变(图3),提示GPC3 C端4个截短表达载体构建成功。

表2 GPC3 C端蛋白抗原表位预测分析结果
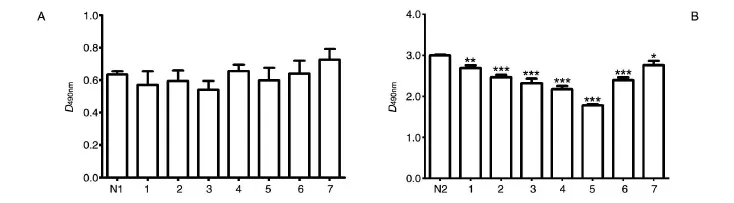
图1 7株抗体的ADCC活性检测
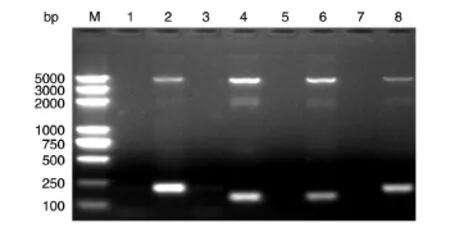
图2 pGEX-GPC3C-F1~pGEX-GPC3C-F4质粒的PCR鉴定
图3 pGEX-GPC3C-F1~pGEX-GPC3C-F4质粒的部分测序结果
将构建的pGEX-GPC3C-F1~pGEX-GPC3C-F4质粒分别转化大肠杆菌BL21(DE3)感受态细胞进行重组表达,4种重组蛋白的大小均与理论值一致,且均以包涵体形式表达;大量诱导表达蛋白,采用切胶回收浸提的方法纯化,将重组蛋白分别命名为GST-GPC3C-F1~GST-GPC3C-F4。参见图4。
2.3 GPC3 C端单克隆抗体的识别表位分析
2.3.1 ELISA检测抗GPC3 C端单抗与不同重组截短蛋白的反应 将纯化的GST-GPC3C-F1~GSTGPC3C-F4蛋白作为抗原,以上述方法对7株抗GPC3 C端单抗进行间接ELISA检测,测量D450nm值,结果7株单抗体与GST-GPC3C-F1、-F2、-F4蛋白反应的D450nm最大值均小于0.2,且随稀释度的增加迅速下降到0.05以下(未显示结果),而7株单抗与GST-GPC3C-F3蛋白反应的D450nm最大值均大于0.3,且D450nm值随稀释度的增加而下降得不明显(图5),提示7株单抗均与GST-GPC3C-F3蛋白而不与GST-GPC3C-F1、-F2、-F4蛋白反应。初步说明GPC3C-F3含有7株单抗特异性识别的表位。
2.3.2 Western印迹分析抗GPC3 C端单抗识别的抗原表位 以Western印迹对7株抗体的识别表位进行进一步分析,结果见图6,7株单抗均特异性结合GST-GPC3C-F3,与ELISA结果一致。
上述2项实验充分说明,7株抗GPC3 C端单克隆抗体所识别的表位区为GPC3(473~525残基)的53残基长度的肽段,而且是线性抗原表位。
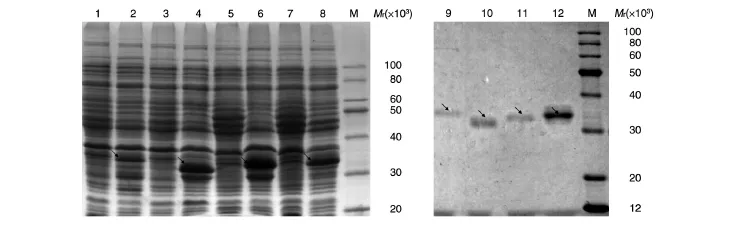
图4 SDS-PAGE检测GST-GPC3C-F1~GST-GPC3C-F4蛋白的表达及纯化
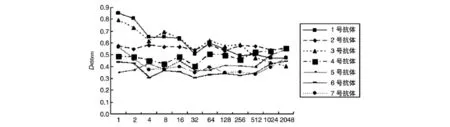
图5 间接ELISA法检测7株单克隆抗体的识别表位(以GST-GPC3C-F3为抗原)

图6 Western印迹检测抗GPC3 C端单克隆抗体的表位识别结果
3 讨论
原发性肝癌是全球最常见的恶性肿瘤之一,我国肝癌的发病率及死亡率均位于恶性肿瘤的第二位。早期诊断、早期治疗对提高肝癌患者生存质量具有十分重要的意义。研究表明,GPC3与许多肿瘤的发生发展有关,可能是新的肝癌早期诊断标志物,同时GPC3还被作为肝癌免疫治疗靶点进行研究。Ishiguro等将GPC3 C端524~563残基片段免疫小鼠,筛选出产生的抗体与抗原具有高度结合特性的杂交瘤细胞克隆,获得了单克隆抗体GC33,发现该抗体可以抑制HepG2或Huh7移植小鼠模型的肿瘤生长,促进化疗药物对肿瘤的杀伤作用,其作用归功于ADCC作用,充分说明了抗GPC3抗体可能发展成为肿瘤治疗的一种手段。
为了寻找抗肝肿瘤更为有效,且具有自主知识产权的抗GPC3抗体,我们制备了7株抗单克隆抗体。为了检测这些抗体是否具有辅助杀伤肝肿瘤细胞的活性,我们以小鼠脾细胞为效应细胞、肝癌细胞HepG2为靶细胞,对7株单抗的ADCC作用进行了初步探索。结果显示,制备的7株单抗均具有不同程度的辅助杀伤作用。为了研究上述肿瘤抑制效果差异是否与其识别的蛋白表位不同有关,我们利用Goldkey软件分析了GPC3 C端的优势表位分布情况,并根据表位分析将GPC3 C端编码基因分为4个截短片段,通过PCR获得基因片段,经序列测定后,分别连接到原核表达载体pGEX-4T-1中,在宿主菌中大量表达和纯化了4种蛋白,用间接ELISA和Western印迹检测了GPC3 C端单克隆抗体的表位识别情况。结果显示,7株抗体均特异性结合含473~525残基的蛋白片段,是否识别473~525残基区域内的不同位置还有待于进一步研究。总之,经初步检测,我们前期制备的7株抗GPC3 C端单克隆抗体在细胞水平上均具有抗肝肿瘤活性,而且上述抗体所识别的表位为GPC3 C端的53个残基片段的线性表位。这些单抗在动物水平上是否具有抗肝肿瘤效果,尚待进一步的研究证实。
[1]Befeler A S,Di Bisceglie A M.Hepatocellular carcinoma:di⁃agnosis and treatment[J]. Gastroenterology, 2002,122:1609-1619.
[2]周赟,谈冶雄,胡栋平,等.抗人GPC3单克隆抗体在肝脏肿瘤组织学检测中的应用[J].第二军医大学学报,2010,31(7):711-714.
[3]Filmus J,Selleck S B.Glypicans:proteoglycans with a sur⁃prise[J].J Clin Invest,2001,108:497-501.
[4]Capurro M,Wanless I R,Sherman M,et al.Glypican-3:a novel serum and histochemical marker for hepatocellular carci⁃noma[J].Gastroenterology,2003,125(1):89-97.
[5]李慎菁,满晓波,王红阳,等.GPC3/mxr7基因在原发性肝癌及其它肿瘤组织中的表达[J].中华肝胆外科杂志,2004,10(1):35-37.
[6]Filmus J,Capurro M.Glypican-3 and alphafetoprotein as diag⁃nostic tests for hepatocellular carcinoma[J].Mol Diagn,2004,8(4):207-212.
[7]Nakatsura T,Nishimura Y.Usefulness of the novel oncofetal antigen glypican-3 for diagnosis of hepatocellular carcinoma and melanoma[J].BioDrugs,2005,19(2):71-77.
[8]Wang H L,Anatelli F,Zhai Q J,et al.Glypican-3 as a use⁃ful diagnostic marker that distinguishes hepatocellular carcino⁃ma from benign hepatocellular mass lesions[J].Arch Pathol Lab Med,2008,132:1723-1728.
[9]Nakano K,Orita T,Nezu J,et al.Anti-glypican 3 antibodies cause ADCC against human hepatocellular carcinoma cells[J].Biochem Biophys Res Commun,2009,378:279-284.
[10]Ishiguro T,Sugimoto M,Kinoshita Y,et al.Anti-glypican 3 antibody as a potential antitumor agent for human liver cancer[J].Cancer Res,2008,68:9832-9838.
[11]Takai H,Kato A,Kato C,et al.The expression profile of glypican-3 and its relation to macrophage population in hu⁃man hepatocelluarcarcinoma[J].LiverInt,2009,29(7):1056-1064.
[12]Takai H,Kato A,Kinoshita Y,et al.Histopathological analy⁃ses ofthe antitumor activity ofanti-glypican-3 antibody(GC33)in human liver cancer xenograft models:the contribu⁃tion of macrophages[J].Cancer Biol Ther,2009,8:930-938.
[13]ZhangHuina,LiJunfeng,Yu Hong,etal.Expression of GPC3 recombinant protein and preparation of GPC3 monoclo⁃nal antibody[J].Chin J Med Lab Technol,2011,7(1):23-29.
[14]黄瑾,马忠森,林树青.细胞增殖法检测单核/巨噬细胞ADCC效应方法的建立[J].中国免疫学杂志,1999,15(4):177-179.
[15]胡冬,李军锋,于虹,等.HCCR重组蛋白的表达及其单克隆抗体的制备[J].中国卫生检验杂志,2008,18(12):2473-2476.

