单克隆抗体纯化过程中内毒素去除方法分析
李彦英 ,王珙 ,李凌瑞 ,周振海 ,李娜 ,毛赟赟 ,李凯 ,王笑非 ,董晓杰
1.军事医学科学院 生物工程研究所,北京 100071;2.上海丰茂生物技术有限公司,上海 201506
细菌内毒素是热原的一种,来自革兰阴性菌的外膜。极微量的内毒素进入动物或人体内都会引发强烈的炎症反应,导致轻微如发热,重则死亡的严重后果[1]。各国药监部门对生物产品中的内毒素含量均有严格规定。欧洲药典规定注射剂内毒素限度不得高于5 EU/(kg·h)[2],EU为内毒素单位,每EU内毒素约相当于100 pg。
细菌污染的风险在生物制药工艺中广泛存在。防止细菌污染,控制产品中内毒素含量是广大生物制药从业人员所面临的巨大挑战。生物药物中,单克隆抗体药物因为使用剂量大(几十到几百毫克),对内毒素限度的要求因而更高。单克隆抗体作为一类靶向药物,以其突出的疗效和较低的不良反应获得了医药界的极大重视,单抗药物的研发也异常活跃。单克隆抗体作为生物大分子药物,生产和纯化工艺复杂,有诸多环节可能将内毒素带入生产工艺之中。因此,纯化工艺步骤中有效去除内毒素的能力将为产品符合内毒素标准提供保障。
内毒素是脂多糖(LPS),其结构包含3个区域,即类脂A区、核心多糖区和特异性多糖区[3]。其中,核心区的磷酸化导致内毒素在一般蛋白溶液中带负电荷[4]。内毒素的类脂部分为疏水区,使内毒素可以像一些双极性分子一样形成微球或微囊结构,将疏水区包裹在里面。内毒素单体的相对分子质量为10×103~20×103,其聚合形态的相对分子质量可超过1000×103[5]。
因为内毒素分子结构复杂且不均一,导致内毒素可以多种方式与溶液中的蛋白质相互作用,形成复合物,大大增加了去除的难度[6-7]。在蛋白溶液中去除内毒素需要着重考虑所用方法对内毒素的特异选择性,即尽量减小蛋白的损失,又对内毒素有较高的亲和力。多聚赖氨酸即表现出对内毒素有亲和作用,以其作为配体的层析介质可以选择性结合内毒素[8]。因为内毒素一旦在水溶液中聚集,分子大大增加,膜过滤/超滤法有望通过分子大小的不同将内毒素与蛋白分子分离[9]。同样利用层析原理,精氨酸溶液冲洗已被证明可以将附着在固定相上的单抗分子内毒素去除[10]。
我们探讨了以上3种方法在单克隆抗体纯化过程中去除内毒素的应用,并分析了它们规模放大的可能性。
1 材料与方法
1.1 材料
单克隆抗体为中国仓鼠卵巢细胞(CHO)表达的重组蛋白,生产规模300 L,经多步纯化,纯度高于98%,抗体溶液为柠檬酸缓冲液(pH5.5)。
Pierce填料和试剂盒来自Thermo Fisher公司;2个规格的纳米滤器均来自Millipore公司,Viresolve NFP Opticap 4英寸纳米滤器膜面积0.16 m2,Vire⁃solve Pro Modus滤器膜面积0.22 m2,两者孔径均为20 nm,前者配0.1 μm PES膜除菌滤器为预过滤器,后者用 POD Viresolve Prefilter,面积 0.11 m2;蛋白A填料Mabselect来自GE公司;精氨酸和组氨酸均为国产分析纯产品。
1.2 填料法
0.5 mL Spin柱的使用方法参见Thermo Fisher公司的产品说明书。先用0.2 mol/L NaOH/95% 乙醇和 2 mol/L NaCl对柱子再生,用 Tris-Cl(pH7.0)平衡后加入3.5 mL蛋白样品,室温摇动1 h,1500 r/min离心收集毒素去除样品。
1.3 纳滤法
纳米滤器和预过滤器使用前先用缓冲液冲洗平衡,再用蠕动泵打入料液。控制流速,使纳米滤器上游压力保持在1~2 bar,超过2 bar即为堵塞,不能继续使用。
1.4 氨基酸清洗法
蛋白A柱经3倍柱体积的Tris缓冲液(pH7.4)平衡后上样,载量按35 mg/mL计算。此方法来自Rit⁃zen等的报道[10]并有所改动。蛋白上样后经1倍柱体积的平衡缓冲液冲洗,即开始氨基酸溶液冲洗,随后氨基酸被20倍柱体积的平衡缓冲液冲洗去除,单抗即由洗脱液(50 mmol/L柠檬酸缓冲液,pH3.8)洗脱。其中,精氨酸溶液为0.5 mol/L(pH7.4),组氨酸溶液为0.5 mol/L(pH6.3)。
1.5 单抗和残留内毒素的检测
单抗浓度检测采用紫外吸光度法,按照该单抗吸光系数计算单抗浓度。内毒素检测参照中国药典2010年版内毒素凝胶限度法进行[11],鲎试剂检测限度为0.25 EU/mL。样品经过1/2梯度稀释,经判断凝胶的形成获得溶液内毒素浓度范围。本工作中显示的内毒素范围不同,系样品稀释率不同所致。
2 结果
2.1 内毒素去除填料法
Pierce内毒素去除填料是一款离子交换介质,由多聚赖氨酸共价连接在纤维素基质上制成。多聚赖氨酸在填料pH值范围内(pH6~8)带正电荷,可以与带负电荷的内毒素结合,并常用于去除内毒素的工艺中[8]。
蛋白溶液和填料混合孵育1 h后,用Spin柱收集流穿的蛋白样品,发现起始含量为0.8(批次1)~8 EU/mg(批次2),小量单抗溶液中的内毒素均去除了70%,而单抗蛋白几乎没有损失(表1),与填料说明书中描述的可以达到的内毒素最低限度一致。
在进一步用内毒素去除填料的实验中,对填料的使用条件,如静态(将填料和蛋白溶液在室温或4℃孵育4 h,并不断搅拌,再经过沉淀分离蛋白溶液和填料)和动态结合、样品蛋白浓度、溶液pH值、溶液离子强度等分别做了考察。结果发现,仅溶液pH值调整为7.4时可使内毒素含量进一步下降50%,其他条件的改变均没有明显提高内毒素去除的程度,未达到预期结果。
2.2 纳滤法
如表2所示,在第一组实验中,含有250 EU/mL内毒素的蛋白溶液(蛋白浓度33.24 mg/mL)经纳滤过滤后,内毒素含量下降了89%,不弱于使用Pierce内毒素去除填料的效果。在过滤过程中,20 nm滤器出现堵塞现象,跨膜压力差大幅增加,可能是内毒素在膜前蓄积造成膜的堵塞。这种现象在内毒素含量低的蛋白料液过滤中没有发生,因此判断不是由于单抗分子造成的。第二组实验在纳滤膜包的上游安装了配套的前滤器,其性质是一种带正电荷的深层滤器,可以拦截颗粒状物质,增加纳滤膜包的处理量。在加装了深层预过滤器的纳滤中,总体内毒素去除也达到88%,与没有预过滤器的情况一致,但料液处理量大幅增加,由每平方米纳滤膜41.6 g蛋白提高到874.8 g,达21倍。
2.3 氨基酸清洗法
Ritzen等报道,将单抗结合在蛋白A柱上后,可以通过精氨酸溶液冲洗,去除混杂在抗体中的内毒素[10]。精氨酸冲洗去除内毒素的机理尚不清楚,但其残基带正电,可能利用电荷作用将内毒素与带正电荷蛋白质分开,达到去除的效果。
蛋白A柱广泛用于单抗纯化,方便进行工艺放大。蛋白A柱结合精氨酸冲洗的方法分别用26和800 mL等2个规格进行了去除内毒素的研究。在精氨酸作用的同时,也考察了另一带正电的氨基酸,即组氨酸对内毒素去除的作用。
单抗按照35 mg/mL动态载量结合在蛋白A柱上,用10个柱体积的0~0.5 mol/L精氨酸溶液梯度冲洗层析柱,并接续使用6倍柱体积的0.5 mol/L精氨酸溶液冲洗,在20倍柱体积的柱平衡液冲洗充分去除残留精氨酸之后,将单抗蛋白洗脱。结果显示,在0.5 mol/L精氨酸梯度冲洗过程中,精氨酸在150 mmol/L水平即可洗脱大量内毒素(50~100 EU/mL)(图1A)。内毒素的洗脱在后续梯度及6个柱体积的冲洗中一直持续,并略有降低(最低为2.5~25 EU/mL)。精氨酸溶液之后的柱平衡液(20 mmol/L Tris/100 mmol/L NaCl,pH7.4)冲洗仅能获得很低的内毒素浓度(2.5 EU/mL),可见精氨酸溶液的作用在冲洗过程中持续存在。最终单抗洗脱液的内毒素含量下降至 3~6 EU/mL(0.2~0.3 EU/mg)(表 3),优于内毒素去除填料和纳滤的方法。结果也提示,若增大精氨酸溶液冲洗的体积,单抗洗脱液中的内毒素含量有可能进一步降低。
组氨酸溶液洗脱结果(图1B)与精氨酸溶液相似。用10个柱体积的组氨酸溶液的0~0.3 mol/L梯度冲洗,随后进行10个柱体积的0.5 mol/L冲洗。结果显示,0.3 mol/L组氨酸溶液即已将大部分内毒素去除,单抗洗脱液的内毒素达到3~4.5 EU/mL(0.2~0.3 EU/mg)的最终浓度(表3)。因0.5 mol/L组氨酸在pH7.4时发生盐析,本实验中的组氨酸溶液pH值为6.3。与精氨酸相比,组氨酸相对较低的浓度和相对较小的冲洗体积可取得相似的内毒素去除效果。
用5 cm层析柱、800 mL装柱量的条件下,精氨酸冲洗可以获得和小规模实验一致的结果,并在4个循环中表现出很好的重复性,均有97%的去除效果(表3)。因此可初步认为,用蛋白A柱/氨基酸溶液冲洗的方法可以显著去除单抗中的内毒素,工艺可以有效放大。

表1 Pierce填料去除单抗溶液中的内毒素
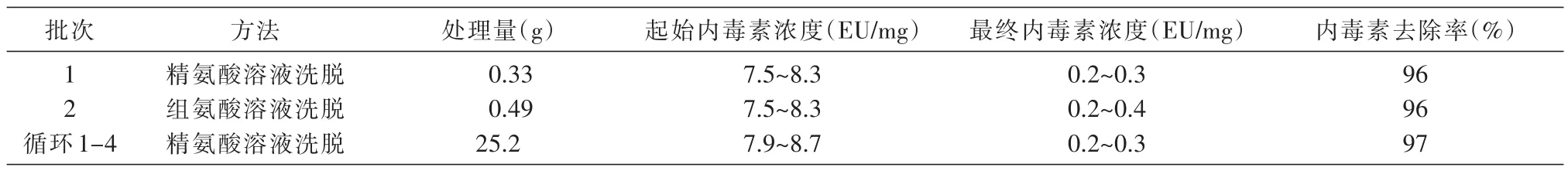
表3 蛋白A柱结合氨基酸溶液冲洗去除单抗溶液中的内毒素
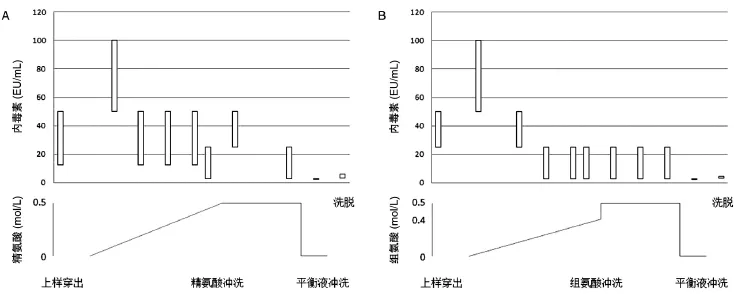
图1 氨基酸溶液冲洗连接在蛋白A柱上的单抗
因单抗与蛋白A柱结合对溶液电导不敏感,使用0.5 mol/L的2种氨基酸溶液均没有导致单抗与蛋白A柱的脱离,从而保持单抗的高回收率(数据未示)。组氨酸和精氨酸作为天然氨基酸,对单抗分子没有影响,对人体也不存在毒性。相比于其他一些需要添加物的内毒素去除方法,添加物如表面活性剂等都会给产品及后续纯化工艺带来各种问题[6]。
3 讨论
Pierce内毒素去除填料中的多聚赖氨酸配基在中性pH值条件下带正电荷,以离子交换的形式与内毒素结合[8]。目标单抗pI为pH8~9,这样带正电荷的蛋白质在阳离子交换柱中会有与层析介质竞争内毒素的现象[5]。因此,用单纯的离子交换法去除带正电荷的蛋白质溶液中的少量内毒素是很困难的[7]。虽然此方法可将内毒素含量从一个较高水平大幅降低,但残留的少量内毒素通过和蛋白质的相互作用而变得顽固。在本实验中,碱性的单抗溶液内毒素含量降低至5 EU/mL水平之后,便很难进一步降低。
Pierce内毒素去除填料可以装柱进行层析操作,有规模放大的潜力。但是,为了获得有效的作用时间,样品的上样速度缓慢(重力流穿),这就大大增加了污染的风险,导致实际操作性差。
内毒素的结构包亲水特异性多糖区和疏水类脂A区,在水溶液中易形成聚合物[5]。内毒素的这种分子复合体形成双层膜状结构,体积和分子都很大,在很多应用中可以利用这一特征将其去除,例如超滤法[9]。单抗相对分子质量达150×103,一般不认为可以有效地通过分子质量的区分将两者分开。但是,在本实验中观察到,经过纳滤的单抗溶液内毒素含量显著降低,提示大量的内毒素是以超过纳滤孔径20 nm的复合体形式存在的。
纳滤前滤器在去除内毒素中的作用不清楚。因其带电特性,可能通过离子交换实现一定程度的结合内毒素的功能[4]。实验结果显示,在有纳滤预过滤器的情况下,纳滤的处理量大幅提高,提示大量内毒素可能因为滞留在预过滤器中,没有过早地堵塞纳滤膜包。纳滤膜包价格昂贵,且容易堵塞。鉴于在实验中观察到深层滤器可能有巨大的去除内毒素的能力,单独使用深层滤器将溶液中内毒素降低将是较好的选择,值得进一步探讨。
纳滤膜包和前滤器组合本是单抗纯化工艺中去除病毒的装置。其对蛋白结合很少,可以保证较高的收率(>90%)。在本实验中,6 L单抗溶液在2 h内完成过滤,而且对单抗蛋白浓度、溶液pH值和电导等参数均无超出常规除病毒过滤工艺的特殊要求,非常适合处理中试或以上规模的单抗溶液。
纳滤虽然可以去除形成聚合体的内毒素,但在蛋白溶液中,很多内毒素还是以单体形式存在的,并与蛋白质形成复合物,无法通过过滤的方法去除。纳滤之后的12.5~25 EU/mL的内毒素,还需要采取其他方法进一步去除。
从满足工艺放大的条件上看,使用柱层析方法去除内毒素是最方便的[12]。相比较内毒素与固定相结合的动力学特征,将单抗结合在层析柱上而使用不同的流动相洗去内毒素似乎更加方便。在用氨基酸溶液冲洗去除内毒素的实验中,测试的2个氨基酸虽然都带有正电荷,但其去除内毒素的原理未必相同。组氨酸作为配体被连接在层析基质上,作为除内毒素的介质早已商业化[13]。Petsch等认为组氨酸可以结合内毒素需要在pH<5的条件下,因为组氨酸残基上的咪唑基团pK=6.0[14]。但是,本实验中使用的pH6.3的组氨酸溶液可以有效洗脱内毒素,而这个条件下组氨酸的咪唑基团并不带电。有必要在后续工作中摸索氨基酸洗脱内毒素的最佳条件,如组氨酸溶液去除内毒素和pH值的关系,以及组氨酸和精氨酸搭配使用的效果。
比较本实验中考察的3种方法,内毒素去除填料价格高,操作时间长,内毒素去除较不彻底;纳滤法虽然适合中试水平单抗产品的内毒素去除,但仍不能充分降低残留内毒素水平;而氨基酸清洗法可以有效地进行工艺放大,层析操作方便,且可将内毒素残留量降至0.25 EU/mg水平,达到中国药典的要求。将这一步骤整合入单抗纯化工艺中,将有助于对纯化产品中的内毒素水平进行控制。
[1]Martich G D,Boujoukos A J,Suffredini A F.Response of man to endotoxin[J].Immunobiology,1993,187:403-416.
[2]CouncilofEurope.European Pharmacopoeia 7.0[S].Stras⁃bourg:EDQM,2010:General Notices:171-175.
[3]Raetz C R H.Biochemistry of endotoxins[J].Ann Rev Bio⁃chem,1990,59:120-170.
[4]Hou K C,Zaniewski R.Depyrogenation by endotoxin removal with positively charged depth filter cartridge[J].J Parenter Sci Technol,1990,44:204-209.
[5]Petsch D,Anspach F B.Endotoxin removal from protein solu⁃tions[J].J Biotechnol,2000,76:97-119.
[6]Kaplus T E,Ulevitch R J,Wilson C B.A new method for re⁃duction of endotoxin contaminations from protein solutions[J].J Immunol Methods,1987,105:211-220.
[7]Petsch D,Deckwer W D,Anspach F B.Proteinase K diges⁃tion improves detection of bacterial endotoxins by the Limu⁃lus amebocyte lysate assay:application for endotoxin removal from cationic proteins[J].J Mol Recognit,1998,11:220-230.
[8]Anspach F B,Hilbeck O.Removal of endotoxins by affinity sorbents[J].J Chromatogr A,1995,711:81-92.
[9]Sweadner K J,Forte M,Nelson L L.Filtration removal of en⁃dotoxin(pyrogens)in solution in different states of aggregation[J].Appl Environ Microbiol,1977,34:382-385.
[10]Ritzen U,Rotticci-Mulder J,Stromberg P,et al.Endotoxin re⁃duction in monoclonal antibody preparations using arginine[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,856:343-347.
[11]国家药典委员会.中华人民共和国药典[M].三部.北京:化学工业出版社,2010:附录ⅫE:95-96.
[12]陈昕.下游层析工艺中热源的去除[J].中国生物工程杂志,2002,22(4):100-104.
[13]Minobe S,Watanabe T,Sato T,et al.Characterizations and applications of adsorbents for pyrogen removal[J].Biotechnol Appl Biochem,1988,0:143-153.
[14]Petsch D,Beeskow T C,Anspach F B,et al.Membrane ad⁃sorbers for selective removal of bacterial endotoxin[J].J Chro⁃matogr B Biomed Sci Appl,1997,693:79-91.

