c-Fos不同结构域的真核表达及功能鉴定
付洁 ,王瑜 ,程龙 ,徐小洁 ,张浩 ,宋海峰 ,叶棋浓
军事医学科学院 a.生物工程研究所;b.放射与辐射医学研究所;北京 100850
激活蛋白1(activator protein 1,AP-1)是一类由即刻早期应答基因编码的核转录因子,在哺乳动物中,AP-1主要由 Fos家族(c-Fos、FosB、Fra-1和Fra-2)和Jun家族(c-Jun、JunB和JunD)组成。AP-1蛋白以同源(Jun-Jun)或异源二聚体(Fos-Jun)的形式发挥转录激活作用。基础条件下,细胞中的AP-1以Jun同源二聚体为主,其表达水平和活性均很低;当细胞受到生理和病理因素刺激时,如细胞因子、生长因子、应激信号、感染、致癌剂等的刺激,细胞中的AP-1将以c-Fos和c-Jun异源二聚体为主,其表达水平和活性均迅速升高,激活下游信号转导通路,在多种肿瘤的生长、侵袭和转移中发挥重要作用[1-2]。AP-1作为对外界信号发生反应的转录因子而且位于信号级联反应的末端,使外界信号和细胞功能之间建立起一定的联系,因此已作为抗肿瘤药物开发的重要靶标之一。
调节AP-1活性的方式目前主要有以下几个层面:二聚体的组成成分和量的不同,会在肿瘤发生发展的不同阶段起到致癌或抑癌的效果[3-4];转录水平或翻译后水平的磷酸化修饰等调节方式[5-6];蛋白质间相互作用,如与癌蛋白(RAS)或辅助蛋白(糖皮质激素受体GR或维甲酸受体RAR)等的相互作用也是调节AP-1转录活性的重要方式之一[7]。尽管已发现一些与AP-1相互作用的蛋白质,但只能部分解释肿瘤发生发展机制,且许多与AP-1相互作用的蛋白质的临床意义不清楚。由于AP-1在肿瘤发生发展中起极其重要的作用,因此与AP-1相互作用的新因子还在不断被发现。哺乳动物Fos家族中以c-Fos最重要,Fos家族在调节AP-1活性和肿瘤发生发展过程等方面具有重要作用[8-10]。
我们拟构建c-Fos蛋白的不同结构域片段的真核表达载体,并在293T细胞中表达,利用免疫共沉淀技术确定构建的结构域的正确性,为进一步研究与c-Fos相互作用的蛋白及其区域定位奠定基础。
1 材料与方法
1.1 材料
人HEK293T细胞株由本实验室保存(用含10%热灭活小牛血清的DMEM培养基,培养于37℃、5%CO2细胞培养箱);大肠杆菌DH5α、FLAG-pcDNA3.0载体由本实验室保存;LipofectAMINE2000转染试剂、DMEM培养基购自Invitrogen公司;小牛血清购自杭州四季青公司;限制性内切酶、DNA连接酶、PrimeSTAR HS DNA聚合酶购自TaKaRa公司;质粒提取试剂盒、凝胶回收试剂盒、PCR回收试剂盒、显色液均购自康维世纪公司;预染蛋白marker购自Fermentas公司;琼脂糖珠偶联的抗FLAG抗体购自Sigma公司;抗FLAG和抗HA标签抗体、蛋白酶抑制剂cocktail均购自Sigma公司;扩增基因片段的PCR引物由上海生工生物有限公司合成。
1.2 c-Fos基因结构域划分及引物设计
以本实验室保存的FLAG-c-Fos(GenBank登录号为NM_005252)质粒为模板,根据文献[11]将c-Fos全长分为c-FosB、c-FosD和c-FosE等3个结构域片段(图1),用PCR技术设计引物(表1),将c-Fos分为3段结构域克隆到FLAG-pcDNA3.0载体中,酶切位点采用BamHⅠ和EcoRⅠ。因为构建的表达载体在3'端含有FLAG标签编码序列,因此将各结构域扩增片段后的终止密码子在引物中去掉,使目的蛋白与标签融合表达。

图1 c-Fos基因结构域划分模式图

表1 引物及序列
1.3 PCR程序和体系
参照PrimeSTAR HS DNA聚合酶说明书进行。在0.2 mL离心管中依次加入1 μL质粒模板、引物各0.5 μL(储存浓度 10 μmol/L)、5×PS缓冲液10 μL、dNTP 4 μL、0.5 μL PrimeSTAR 酶 ,用ddH2O将体系补足至50 μL。将上述混合液轻轻混匀,短暂离心。PCR反应程序:95℃ 10 min,然后以95℃ 20 s、55℃ 20 s、72℃ 1 min 进行 30 个循环,72℃ 7 min。取9 μL PCR产物,加入10×上样缓冲液1 μL,混匀,上样,进行1.5%琼脂糖凝胶电泳检测,紫外凝胶成像仪验证条带是否正确。
1.4 FLAG-c-Fos不同结构域片段真核表达载体的构建
琼脂糖凝胶回收PCR产物,与FLAG-pcDNA3.0载体质粒分别用BamHⅠ/EcoRⅠ双酶切,将酶切后的目的基因与载体DNA分别用1.5%和1%琼脂糖凝胶电泳回收,用T4DNA连接酶于16℃连接过夜。连接产物转化大肠杆菌DH5α,涂板后37℃温箱中倒置培养至长出克隆菌落。挑取克隆菌落放入5 mL含氨苄西林的LB培养基中,37℃、220 r/min振荡过夜培养,用质粒小量纯化试剂盒少量提取质粒。表达载体质粒经双酶切鉴定无误后,将样品送上海生工公司测序。
1.5 表达载体质粒的提取
将测序结果序列比对后,样品接入10 mL含有氨苄西林的LB培养基中,37℃、220 r/min振荡过夜培养,用Promega公司的质粒提取试剂盒提取质粒,紫外分光光度法测定浓度和纯度,D260nm/D280nm为1.8~1.9的质粒保存在-20℃待用。
1.6 细胞转染和收集
293T细胞用含10%胎牛血清、2 mmol/L谷酰胺、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液培养。将105细胞铺24孔板,次日细胞融合率约为70%时用LipofectAMINE2000转染试剂将1.5 μg FLAG-c-FosB、FLAG-c-FosD 和 FLAG-c-FosE质粒转染,转染后24~36 h以1000 r/min离心收集细胞,弃上清,用PBS洗涤一次,置冰上,加入1×SDS上样缓冲液,充分裂解细胞后行SDS-PAGE,Western印迹检测片段表达正确与否。
进行免疫共沉淀的转染实验,细胞培养条件同上,将106细胞铺35 mm直径的小皿,次日细胞融合率约为70%时用LipofectAMINE2000转染试剂将5 μgHA-c-Jun和 5 μgFLAG-c-FosB、FLAG-c-FosD、FLAG-c-FosE分别共转染,转染后24~36 h,以1000 r/min离心收集细胞,弃上清,用PBS洗涤一次,置冰上。
1.7 共转染蛋白分子的免疫沉淀
用0.5 mL预冷的细胞裂解液[1 mol/L Tris-HCl(pH8.0)2 mL、5 mol/L NaCl 2.5 mL、NP-40 0.25 mL、0.5 mol/L EDTA 1 mL、蛋白酶抑制剂0.1 mL、1 mol/L DTT 0.1 mL,用 ddH2O 补至 100 mL]冰浴30 min后超声波裂解细胞,4℃、12 000 r/min离心,取适量上清与等体积2×SDS蛋白加样缓冲液混匀作为input,-70℃保存备用于免疫印迹分析。将其余上清转移到新的无菌管中,加入琼脂糖珠偶联的抗FLAG抗体,于4℃在旋转混合器上孵育结合4 h后用裂解液洗涤琼脂糖珠4次,每次4℃、3000 r/min离心3 min,洗涤完毕弃上清,向沉淀中加入30 μL 2×SDS蛋白加样缓冲液,-70℃保存备用于免疫印迹分析。
1.8 免疫沉淀标本的免疫印迹
将上述收集的免疫沉淀标本煮沸10 min变性,经10%SDS-PAGE分离,采用半干转印仪,以15 V恒压转印50 min,将凝胶中的蛋白质转移至PVDF膜上,以含30 g/L脱脂奶粉的TTBS[100 mmol/L Tris-HCl(pH7.5)、9 g/L NaCl,0.1%Tween-220]室温封闭1 h,加1∶5000稀释的HA-HRP或FLAGHRP抗体室温孵育1 h,用TTBS洗涤后,用A/B液于X线胶片上曝光检测。
2 结果
2.1 c-Fos不同结构域的构建
c-Fos不同结构域片段的构建如图1,PCR扩增后获得c-FosB、c-FosD和c-FosE片段,分别为441、237、531 bp(图 2A),经酶切、连接、转化和挑取菌落,对重组质粒进行双酶切鉴定(图2B),将酶切正确的质粒送奥科生物公司测序,证实重组质粒构建正确(数据未示)。
2.2 c-Fos不同结构域的表达
将c-Fos不同结构域片段的表达载体转染293T细胞后,收集细胞进行Western印迹。c-FosB(147残基)、c-FosD(79残基)、c-FosE(176残基)的理论相对分子质量分别为 18×103、10×103、22×103,因连接有FLAG标签,表达产物比理论值略大(图3)。
2.3 HA-c-Jun和FLAG-c-Fos不同结构域片段的免疫共沉淀实验
免疫共沉淀方法检测到FLAG琼脂糖珠能将FLAG-c-FosB、FLAG-c-FosD和FLAG-c-FosE从细胞裂解液中沉降下来,并且在FLAG-c-FosD组可以特异性地检测到HA-c-Jun的存在(图4),说明本实验构建的FLAG-c-FosD可特异性地与HA-c-Jun结合,而FLAG-c-FosB、FLAG-c-FosE不与HA-c-Jun结合,这与文献报道的c-Fos和c-Jun形成异源二聚体依赖于bZIP区[16-17]相符。
3 讨论
蛋白质间相互作用存在于机体每个细胞的生命活动过程中,包括复制、转录、翻译、细胞周期调控和信号转导等,特定蛋白质相互作用发生改变可以导致疾病的发生,因此,基于信号转导通路的关键蛋白进行与其相互作用蛋白的筛选,是新药研发的重要内容之一。在AP-1信号途径中,AP-1与其他蛋白质的相互作用是AP-1发挥功能活性的重要方式之一。这些与AP-1相互作用的蛋白不但能改变AP-1活性,而且其本身基因结构和/或表达水平在病理状态下也可能发生改变,因此这些相互作用蛋白也是药物开发的潜在靶标。
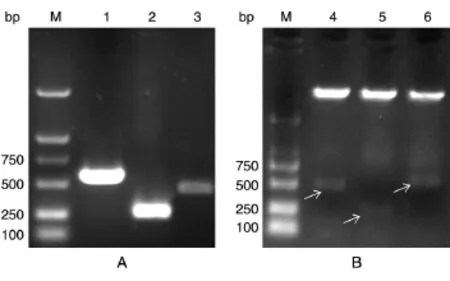
图2 c-Fos不同片段结构域的构建鉴定

图3 利用FLAG标签抗体对c-Fos不同结构域片段进行表达鉴定

图4 FLAG标签 c-Fos不同结构域片段与HA-c-Jun的免疫共沉淀
AP-1通过蛋白质间相互作用来发挥其功能至少有以下几种方式:①通过AP-1不同成员之间的相互作用调节AP-1转录活性。细胞中AP-1的组成和各组分的相对比例决定了AP-1的功能[3-4]。②通过AP-1与其他蛋白质的相互作用调节AP-1转录活性。如c-Jun或c-Fos可与一些Maf蛋白(v-Maf和c-Maf)相互作用形成异源二聚体;c-Fos还能与MafB、MafF、MafG和MafK相互作用,c-Jun则不能。通过这些相互作用,AP-1的功能大大增强[12-13]。一些调节蛋白也可通过与AP-1的相互作用抑制AP-1的功能。LaminA/C蛋白通过与c-Fos的相互作用改变c-Fos的亚细胞定位、抑制AP-1的DNA结合活性、抑制AP-1靶基因的转录激活,并导致细胞周期改变[14]。③AP-1通过与其他转录因子的相互作用调节AP-1或其他转录因子的转录活性[15]。如属于转录因子的雌激素受体(ER)可与AP-1相互作用并调节AP-1转录活性[6],AP-1与转录因子Smad结合后可调节Smad介导的转化生长因子β(TGF-β)信号通路活性。因此,构建AP-1家族主要蛋白的不同结构域片段,对于研究其相互作用蛋白并进一步功能定位,具有重要意义。
哺乳动物细胞中,AP-1家族的主要成员为Fos和Jun家族,其中,c-Fos是Fos家族的最重要成员。根据现有文献报道[16-17],c-Fos有多个结构域可以激活或调节转录,其中C端结构域有3个Fos激活分子(Fos activation modlues,FAM),其中2个FAM区含HOB1和HOB2基序,第三个FAM区含TBP结合基序(TBP binding motif,TBM),TBM的TBP结合活性可以被含有HOB1和HOB2的激活结构域放大;C-fos的N端含有一个抑制性结构域(inhibitory do⁃main,ID1),可作用于含有HOB1基序的FAM区,使之沉默;C-Fos含有碱性亮氨酸拉链(bZIP)的DNA结合结构域。我们希望获得可以和c-Fos相互作用的蛋白,因此并未对c-Fos的N端和C端的结构域进行细分,而只分为3个结构域。本研究中免疫共沉淀结果也表明,bZIP与c-Jun结合,从而佐证了c-Fos不同结构域构建的正确性。
[1]Verde P,Casalino L,Talotta F,et al.Deciphering AP-1 func⁃tion in tumorigenesis[J].Cell Cycle,2007,6(21):2633-2639.
[2]Malnou C E,Brockly F,Favard C,et al.Heterodimerization with different Jun proteins controls c-Fos intranuclear dynam⁃ics and distribution[J].J Biol Chem,2010,285(9):6552-6562.
[3]Bakiri L,Matsuo K,Wisniewska M,et al.Promoter specifici⁃tyand biologicalactivityoftethered AP-1 dimers[J].Mol Cell Biol,2002,22(13):4952-4964.
[4]van Dam H,Castellazzi M.Distinct roles of Jun:Fos and Jun:ATF dimersin oncogenesis[J].Oncogene,2001,20(19):2453-2464.
[5]O'Donnell A,Yang S H,Sharrocks A D.MAP kinase-mediat⁃ed c-fos regulation relies on a histone acetylation relay switch[J].Mol Cell,2008,29(6):780-785.
[6]Portal M M,Ferrero G O,Caputto B L.N-terminal c-Fos ty⁃rosine phosphorylation regulates c-Fos/ER association and c-Fos-dependentphospholipid synthesisactivation[J]. Onco⁃gene,2007,26(24):3551-3558.
[7]Herrlich P.Cross-talk between glucocorticoid receptorand AP-1[J].Oncogene,2001,20(19):2465-2475.
[8]Milde-Langosch K.TheFosfamilyoftranscription factors and their role in tumourigenesis[J].Eur J Cancer,2005,41(16):2449-2461.
[9]Lu C,Shen Q,DuPré E,et al.c-Fos is critical for MCF-7 breast cancer cell growth[J].Oncogene,2005,24(43):6516-6524.
[10]Durchdewald M,Angel P,Hess J.The transcription factor Fos:a Janus-type regulator in health and disease[J].Histol Histopathol,2009,24(11):1451-1461.
[11]John M,Leppik R,Busch SJ,et al.DNA binding of Jun and FosbZip domains:homodimersand heterodimersinducea DNA conformational change in solution[J].Nucleic Acids Res,1996,24(22):4487-4494.
[12]Chinenov Y,Kerppola T K.Close encounters of many kinds:Fos-Jun interactions that mediate transcription regulatory spec⁃ificity[J].Oncogene,2001,20(19):2438-2452.
[13]Eferl R,Wagner E F.AP-1:a double-edged sword in tumori⁃genesis[J].Nat Rev Cancer,2003,3(11):859-868.
[14]Ivorra C,Kubicek M,González J M,et al.A mechanism of AP-1 suppression through interaction of c-Fos with lamin A/C[J].Genes Dev,2006,20(3):307-320.
[15]Lopez-Bergami P,Lau E,Ronai Z.Emerging roles of ATF2 and the dynamic AP1 network in cancer[J].Nat Rev Cancer,2010,10(1):65-76.
[16]Brown H J,Sutherland J A,Cook A,et al.An inhibitor do⁃main in c-Fosregulatesactivation domainscontaining the HOB1 motif[J].EMBO J,1995,14(1):124-31.
[17]Metz R,Bannister A J,Sutherland J A,et al.c-Fos-induced activation of a TATA-Box-containing promoter involves direct contactwith TATA-box-binding protein[J].MolCellBiol,1994,14(9):6021-6029.

