一种用于流感病毒亚单位疫苗纯度分析的改进方法
田文莉 ,邵铭 ,祁骥 ,刘淑珍 ,谷堃 ,李长贵 ,杨旭 ,李小强
1.天士力金纳生物技术(天津)有限公司,天津 300410;2.中国食品药品检定研究院,北京 100050
流感病毒表面散布着几种形态不一的蛋白突起,其中含量最多的是血凝素(haemagglutinin,HA),它是流感病毒感染宿主细胞的关键蛋白[1],也是流感病毒亚单位疫苗中有效的免疫原性物质[2-4]。在组成流感病毒的所有蛋白质中,HA约占总蛋白量的30%,核蛋白(nucleocapside protein,NP)次之,占总蛋白量的25%左右。基质蛋白(matrix protein,M)包括M1和M2,M1是病毒粒子中最丰富的一种多肽。HA分子由重链(HA1)和轻链(HA2)组成,由一个精氨酸(Arg)残基相连,同时具有若干个糖基化位点,糖基化位点的数目和位置随毒株不同而异[5-7]。
肽N-糖苷酶F(PNGase F)是一种酰氨酶,可以在N-糖蛋白的高甘露糖、杂合和复合寡糖部分最内侧的N-乙酰葡萄糖胺(GlcNAc)和天冬酰氨残基之间进行切割,几乎可以水解糖肽/糖蛋白中所有N-聚糖链[8-9]。
由于糖蛋白在还原型SDS-PAGE中的迁移率不同于无糖基化的蛋白质[10],因此我们拟采用PNGase F对不同型别的流感病毒亚单位疫苗中间体进行了去糖基化处理,消除了血凝素亚基糖基化对电泳迁移率的影响,使样品中不同组分的蛋白质得到了更好的分离,从而提高了对杂质的分辨力。
1 材料与方法
1.1 材料
流感病毒亚单位疫苗超离中间体(ultracen⁃tri-fugation intermediate)为疫苗生产过程中经蔗糖密度梯度离心分离得到的产物,主要成分为HA,由天士力金纳生物技术(天津)有限公司生产。H1N1亚型流感病毒毒株为NYMC X-181 reassortant de⁃rived from A/California/7/2009,H3N2亚型毒株为IVR-155 reassortantderived from A/Victoria/210/2009。
本研究以疫苗生产过程中经蔗糖密度梯度离心分离的杂质峰(简称超离杂峰,ultracentrifugation impurity peak)为对照样品,由天士力金纳生物技术(天津)有限公司生产技术部提供。该样品除含有少量HA外,还含有流感病毒颗粒中的其他蛋白质成分,其毒株来源与对应的疫苗中间体样品相同。
PNGase F购自New England Biolabs(500 000 U/mL);糖苷酶贮存液[50 mmol/L NaCl,20 mmol/L Tris-HCl(pH7.5),5 mmol/L Na2EDTA,50% 甘油];SDS-PAGE用试剂购自Sigma公司;SDS-PAGE低分子量蛋白质marker由中国科学院上海生物化学研究所监制;染色液(0.25%考马斯亮蓝R250溶于脱色液中);脱色液(无水乙醇∶冰醋酸∶水=9∶9∶2)。
1.2 去糖基化处理
将样品稀释至总蛋白浓度约为1000 μg/mL,参照文献[11-12]所述方法取稀释后的样品36 μL,加入10×Glycoprotein Denaturing Buffer 4 μL,混匀后100℃水浴10 min,使蛋白质变性;冷却至室温后分别加入 10×G7 Reaction Buffer 5 μL、10%NP-40 5 μL及50 000 U/mL的PNGase F(以糖苷酶贮存液进行1/10稀释)1 μL,混匀后37℃水浴过夜(约16 h)。
1.3 SDS-PAGE
分别取36 μL未经处理样品加入15 μL PBS(使其与处理后的蛋白浓度一致),作为去糖基化处理前的对照。向去糖基化处理前和处理后的样品管中分别加入6×还原型上样缓冲液10 μL,混匀后100℃水浴5 min,冷却至室温后上样。

图1 H1N1亚型样品去糖基化处理前、后的SDS-PAGE
采用Bio-Rad Mini-PROTEAN Tetra Cell电泳装置进行实验,聚丙烯酰胺电泳凝胶(丙烯酰胺单体与N,N'-甲叉双丙烯酰胺单体的比例为37.5∶1),浓缩胶浓度为5%,分离胶浓度为12%。每孔上样15 μL,浓缩胶60 V、分离胶120 V,恒压电泳,待染料迁移至凝胶边缘时终止电泳,取出凝胶进行固定、染色、脱色、成像。
2 结果
2.1 H1N1亚型中间体杂质分析
取H1N1亚型超离中间体和超离杂峰去糖基化处理前、后的样品进行SDS-PAGE,结果见图1。由泳道1、2条带可以看出,糖基化的HA1与NP的电泳条带重合,去糖基化处理后可以清楚地区分这2个蛋白;HA2在去糖基化后也能观察到其电泳迁移率的改变。由泳道3、4可以看出,H1N1亚型超离中间体样品去糖基化后仍然只能观察到HA1和HA2蛋白条带,说明该样品的血凝素纯度很高,几乎不含其他蛋白。
其中,第2泳道的超离杂峰样品在去糖基化处理时加入的是未经稀释的糖苷酶,图中可见相对分子质量为36×103的糖苷酶条带;而第4泳道的超离中间体样品则使用稀释后的糖苷酶,其含量低于考马斯亮蓝染色的检测限。
2.2 H3N2亚型中间体杂质分析
取H3N2亚型超离中间体和超离杂峰去糖基化处理前、后的样品进行SDS-PAGE,结果见图2。可以看出,经去糖基化处理后,HA1和HA2的迁移率均有明显改变。第1泳道超离杂峰样品未经去糖基化处理前M蛋白与HA2的电泳条带紧密相邻难以分辨,经去糖基化处理后2种蛋白即可被清楚地区分。此外,泳道4超离中间体样品去糖基化后仍然只能观察到清晰的HA1和HA2条带,说明该样品血凝素纯度很高。
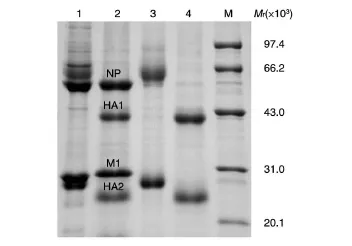
图2 H3N2亚型样品去糖基化处理前、后的SDS-PAGE
3 讨论
流感病毒亚单位疫苗的生产,首先是用各型别的毒种分别接种鸡胚以制备大量的流感病毒;然后将病毒裂解,通过蔗糖密度梯度超速离心获得以各型别HA为主要成分的超离中间体,再经柱纯化后得到各型别的单价原液;最后将规定型别、经检验合格的单价原液按照一定的HA浓度混合制得流感病毒亚单位疫苗[13]。其中,蔗糖密度梯度离心是HA和其他杂质蛋白的分离中最直接、最关键的步骤,因此超离中间体中HA的含量及纯度就直接关系着流感病毒亚单位疫苗质量的优劣。
在本研究中,我们以生产过程中分离到的杂质样品作为对照,研究和分析了不同型别流感病毒亚单位疫苗的中间产品,针对血凝素是糖蛋白的特性对其进行去糖基化处理,然后再以还原型SDS-PAGE来分析,显著提高了纯度分析的分辨力。
[1]Wang C C,Chen J R,Tseng Y C,et al.Glycans on influen⁃za hemagglutinin affect receptor binding and immune response[J].Proc Natl Acad Sci USA,2009,106(43):18137-18142.
[2]Laver W G,Webster R G.Preparation and immunogenicity of a purified influenza virus haemagglutinin and neuraminidase subunit vaccine[J].Postgrad Med J,1976,52(608):373-378.
[3]van Damme P, Arnou R, Kafeja F, et al. Evaluation of non-inferiority of intradermal versus adjuvanted seasonal influ⁃enza vaccine using two serological techniques:a randomised comparative study[J].BMC Infect Dis,2010,10:134.
[4]Gildea S,Arkins S,Walsh C,et al.A comparison of anti⁃body responses to commercial equine influenza vaccines fol⁃lowingannualboostervaccination ofNationalHuntHorssa randomised blind study[J].Vaccine,2011,29(22):3917-3922.
[5]郭元吉,程小雯.流行性感冒病毒及其实验技术[M].北京:中国三峡出版社,1997:18-19.
[6]Valentine R C,Isaacs A.The structure of influenza virus fila⁃ments and spheres[J].J Gen Microbiol,1957,16(1):195-204.
[7]Choppin P W,Murphy J S,Stoeckenius W.The surface struc⁃ture of influenza virus filaments[J].Virology,1961,13:548-550.
[8]Maley F,Trimble R B,Tarentino A L,et al.Characterization of glycoproteins and their associated oligosaccharides through the use ofendoglycosidases[J].AnalBiochem,1989,180(2):195-204.
[9]Plummer T H Jr,Tarentino A L.Purification of the oligosac⁃charide-cleaving enzymesofflavobacterium meningosepticum[J].Glycobiology,1991,1(3):257-263.
[10]Anderson M,Cawston T,Cheeseman G G.Molecular-weight estimates of milk-fat-globule-membrane protein-sodium dodec⁃yl sulphatecomplexesbyelectrophoresisin gradient acryl⁃amide gels[J].Biochem J,1974,139(3):653-660.
[11]Harvey R,Wheeler J X,Wallis C L,et al.Quantitation of haemagglutinin in H5N1 influenza viruses reveals low haemag⁃glutinin content of vaccine virus NIBRG-14(H5N1)[J].Vac⁃cine,2008,26(51):6550-6554.
[12]邵铭,李娟,宋颖丽,等.流感疫苗血凝素含量测定替代方法的建立及验证[J].生物制品学杂志,2010,23(7):770-773.
[13]Huebner R C,Harmon M W.Influenza virus subunit conju⁃gates:US Patent,5612037[P].1997-03-18.

