基于生物量的白灵菇菌株筛选及其深层发酵培养条件优化
冀 宏,赵黎明
(1.天津大学管理与经济学部,天津 300072;2.常熟理工学院生物与食品工程学院,江苏 常熟 215500)
摘 要:以深层发酵菌丝体生物量为考察指标,对白灵菇液体深层发酵的培养基及发酵条件进行优化。通过正交试验(L9(34))确定发酵培养基最佳配方。在此基础上,基于三因素三水平的Box-Behnken设计试验,采用响应曲面分析法对影响白灵菇菌丝体生长的发酵温度、摇瓶转速和发酵周期进行优化。结果表明:最佳培养基组分为
(g/100mL):可溶性淀粉3.50、牛肉膏0.40、磷酸二氢钾0.25、硫酸镁0.25;当摇瓶发酵温度为26℃、转速为160r/min,发酵周期7.5d(180h)时,发酵菌丝体生物量可达1.6004g/100mL 。
关键词:白灵菇;深层发酵;生物量;正交试验;响应面法
基于生物量的白灵菇菌株筛选及其深层发酵培养条件优化
冀 宏1,2,赵黎明1
(1.天津大学管理与经济学部,天津 300072;2.常熟理工学院生物与食品工程学院,江苏 常熟 215500)
摘 要:以深层发酵菌丝体生物量为考察指标,对白灵菇液体深层发酵的培养基及发酵条件进行优化。通过正交试验(L9(34))确定发酵培养基最佳配方。在此基础上,基于三因素三水平的Box-Behnken设计试验,采用响应曲面分析法对影响白灵菇菌丝体生长的发酵温度、摇瓶转速和发酵周期进行优化。结果表明:最佳培养基组分为
(g/100mL):可溶性淀粉3.50、牛肉膏0.40、磷酸二氢钾0.25、硫酸镁0.25;当摇瓶发酵温度为26℃、转速为160r/min,发酵周期7.5d(180h)时,发酵菌丝体生物量可达1.6004g/100mL 。
关键词:白灵菇;深层发酵;生物量;正交试验;响应面法
白灵菇(Pleurotus nebrodensis)属真菌门、担子菌纲、伞菌目、侧耳科、侧耳属,又名阿魏蘑、阿魏菇、阿魏侧耳等,是国内主要人工栽培食用菌种类之一[1]。目前,白灵菇栽培工艺主要采用固体菌种技术,受到季节和原材料的限制,且生产周期长、成本高和易污染。实践证明[2],通过食用菌深层液体发酵工艺制备的液体菌种可替代固体菌种用于栽培生产,相对于固体制种技术,液体菌种具有生产周期短、菌龄一致、发育点多、菌丝生长速度快、成本低等优势[3],因此,对白灵菇深层液体发酵技术的研究展现出诱人的应用前景。
国外Choi等[4]对白灵菇液体培养条件进行了研究,当温度为25℃、接种量为5%、初始pH6.5~7.0时菌丝体生物量可达1.284g/100mL 。在国内,根据王广耀[5]、危茂贵[6]、黄聪亮[7]等的研究,以玉米粉、葡萄糖、黄豆粉、蔗糖、蛋白胨、KH2PO4、MgSO4为培养基主要成分,得到的发酵白灵菇菌丝体生物量最高可达2.75g/100mL 。在发酵培养条件方面,根据任海霞[8]、孟俊龙[9]、兰蓉[10]、胡顺珍[11]等的研究,以接种量、装液量、初始pH值、培养温度、摇床转速、发酵时间为主要的考察条件,得到的白灵菇菌丝体生物量最高可达2.16g/100mL 。
本实验通过从来自国内不同产区的19个白灵菇生产菌种中筛选出生长速度快,品质好的菌株(河北武安天山2号)为出发菌株,以白灵菇发酵菌丝体干质量为测定指标,采用正交试验和响应面分析法对发酵培养基组分及发酵条件进行优化,旨在缩短发酵周期、提高菌丝体生物量,为深层发酵制备白灵菇液体菌种技术提供理论和实验依据。
1 材料与方法
1.1 菌种与培养基
1.1.1 白灵菇菌种
分别自相关高校、科研院所及合法食用菌生产销售机构获得国内不同产区的19个白灵菇菌种(表1)。并采用内转录间隔区(rDNA ITS)序列多态性分析技术对上述菌种进行了遗传学鉴定(相关研究内容另文报道)。以上各菌株经PDA培养基活化,保藏。
1.1.2 培养基
优势菌株筛选培养基(g/L):马铃薯200、葡萄糖20、琼脂20,pH值自然。
一级摇瓶培养基(g/L):葡萄糖20、胰蛋白胨4、磷酸二氢钾3、硫酸镁1.5、VB10.02,pH值自然。
碳源供试培养基(g/L):胰蛋白胨4.0、磷酸二氢钾3.0、硫酸镁1.5、碳源20(葡萄糖、麦芽糖、果糖、乳糖、蔗糖、可溶性淀粉),pH值自然。
氮源供试培养基(g/L):葡萄糖20、磷酸二氢钾3.0、硫酸镁1.5、氮源4.0(牛肉膏、胰蛋白胨、酵母膏、硝酸铵、硫酸铵、硝酸钾),pH值自然。
1.2 仪器与设备
ZQLY-180型振荡培养箱 上海知楚仪器有限公司;CH1200893型分析天平 伯拉莫贝林精密仪器有限公司;CJ-1S型超净工作台、WGL-45B电热鼓风干燥箱天津市泰斯特仪器有限公司;PQX-280A-22HM人工气候箱 宁波莱福科技有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.3 方法
1.3.1 菌丝体生物量测定
菌丝体生物量的测定采用菌丝体干质量法,将发酵醪液过80目不锈钢标准筛,用蒸馏水冲洗3次,将过滤所得的菌丝体于60℃数显电热鼓风干燥箱中烘干至恒质量,用分析天平称质量,得菌丝体干质量[12]。
1.3.2 优势菌株筛选
在同等条件下,将不同产区白灵菇菌种分别接入马铃薯葡萄糖琼脂培养基(PDA)中,重复3次。置于25℃恒温培养箱中培养,观察并记录菌丝萌发情况。待菌丝在培养基表面开始生长,用十字交叉法测定菌落直径,每隔24h测量1次,连续测量5次,计算菌丝体日均生长速率;同时观察记载菌丝长势:菌丝粗细、浓密程度及色泽等[13]。选择菌丝体日均生长速率最快,长势较好的菌株作为供试菌株。菌丝体日均生长速率利用如下公式计算。
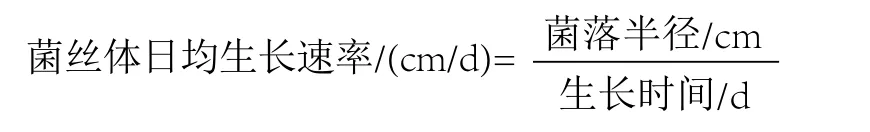
1.3.3 一级摇瓶菌种的制备
配制一级摇瓶培养基,将配好的培养基分装入250mL的摇瓶中,每瓶分装100mL,于121℃灭菌20min,冷却备用。取白灵菇优势菌株,无菌操作接种0.5cm×0.5cm的菌种块(10日菌龄)于摇瓶内,注意尽量使菌块漂浮在液面上。每瓶接种3块。26℃静置培养24h,然后置于26℃恒温振荡培养,摇床转速180r/min,培养时间12d。
1.3.4 发酵培养基最佳碳源和氮源筛选实验
1.3.4.1 不同碳源对产菌丝体的影响
将配制好的1.1.2节碳源供试培养基分装入250mL的摇瓶中,每瓶分装100mL,于121℃灭菌20min,冷却之后在无菌条件下将预先制备的白灵菇一级摇瓶菌丝体接种到培养基中,接种量为10%,置于26℃,180r/min的恒温摇床上振荡培养6d。每组设置3个平行。并对筛选出的最佳碳源进行单因素试验,以确定最佳水平范围。
1.3.4.2 不同氮源对产菌丝体的影响
配制1.1.2节氮源供试培养基,方法同1.3.4.1节。并对筛选出的最佳氮源进行单因素试验,以确定最佳水平范围。
1.3.5 发酵培养基正交试验
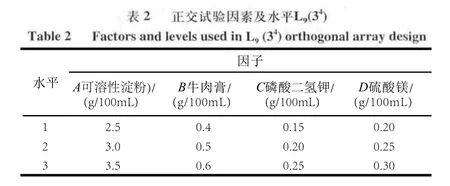
基于最佳碳、氮源筛选结果,进行四因素三水平正交试验(L9(34))设计,对发酵培养基成分进行优化。发酵条件:26℃、摇瓶转速180r/min、培养液装量100mL/250mL 三角瓶、接种量为10%、pH值自然、发酵时间6d,以菌丝体生物量为考察指标,每个实验组设3个平行。因素及水平设计见表2。
1.3.6 发酵条件单因素试验
选用最佳发酵培养基,分别考察发酵温度、摇床转速和发酵周期对白灵菇产菌丝体的影响,确定各影响因子的最佳范围。
艾迪仅在属于她的唯一一篇内心独白中发声,其内心独白被福克纳浓缩至寥寥数语,却又如此丰富。《在我弥留之际》更以艾迪·本德伦的视角为核心,在艾迪的视角下,她对这场葬礼的感知是:对丈夫安斯的复仇。她在内心独白中如是说:“而我的报复将是他永远也不知道我在报仇。达尔出生后我要求安斯做出许诺,等我死后把我运回杰弗逊去安葬。”[3]
1.3.6.1 发酵温度的影响
分别设定发酵温度24、25、26、27、28℃5个水平。分别在接种量10%、摇床转速180r/min条件下发酵6d,测定菌丝体生物量,每个水平试验设置3个平行。
1.3.6.2 摇床转速的影响
在发酵温度26℃条件下,设定摇床转速为120、140、160、180、200r/min分别考察对发酵产菌丝体的影响。其他条件及方法同1.3.6.1节。
1.3.6.3 发酵时间的影响
设定发酵24h后每隔24h测定发酵菌丝体生物量和发酵液pH值,共测定9d,考察不同发酵周期对产菌丝体的影响。培养温度26℃、摇床转速180r/min,其他条件及方法同1.3.6.1节。
1.3.7 响应面试验设计
采用响应面法(RSM)中Box-Behnken模型对影响白灵菇深层发酵菌丝体生长的关键因素进行优化。数据处理软件为SAS软件。
参照文献[14-20]进行Box-Behnken试验,按照Box-Behnken试验设计的要求,根据单因素试验结果,利用响应面分析法(RSM)设温度、摇床转速和发酵周期为自变量,分别为X1、X2、X3;每一自变量的低、中、高水平分别以-1、0、1进行编码,以菌丝体生物量为因变量,进行实验设计,所有实验重复3次,每次3个平行,如表3所示。

2 结果与分析
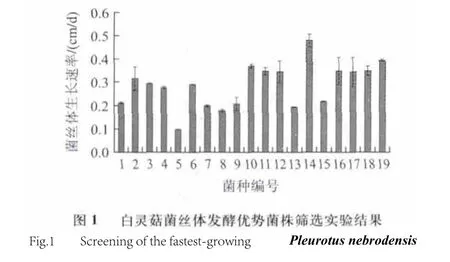
白灵菇菌丝体发酵优势菌株筛选实验结果见图1。以菌丝体日均生长速率为指标,14号菌株(河北武安天山2号)的菌丝体日均生长速率要高于其他18种白灵菇菌株,其菌丝体日均生长速率达0.48cm/d。通过平板培养过程的观察,河北武安天山2号菌株的生长速率较快,长势较好且菌丝粗壮,这也有利于工业生产上缩短发酵周期,因此选择河北武安天山2号作为进一步研究的菌株。
2.2 发酵培养基最佳碳源和氮源筛选
2.2.1 碳源筛选结果
碳源是细胞 结构的重要组成成分,又是菌体产生各种代谢产物和细胞内贮藏物质的主要原料[21]。因此,选出适宜的碳源对其深层发酵至关重要。
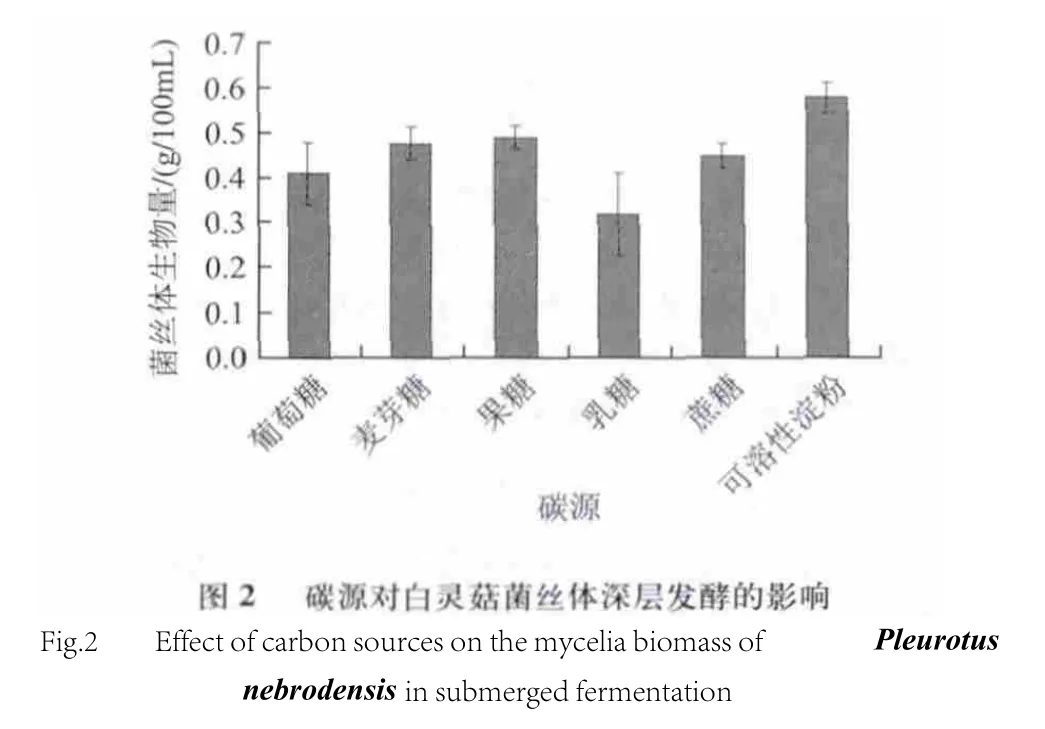
由图2可知,最佳碳源为可溶性淀粉,生物量为0.577g/100mL 。其次为果糖。乳糖对菌丝体生长的促进作用最小,生物量仅为0.318g/100mL 。由数据可知白灵菇对多糖的利用明显好于单糖和二糖。这是因为结构简单的糖一般能被菌体快速利用,但过多会过分加速呼吸,使溶氧不能满足需要,并使一些中间产物不能完全氧化而积累,影响某些酶的活性,从而抑制菌体生长和产物合成。对白灵菇这样的真菌培养时间较长,如只将单糖或二糖作为碳源,必然导致菌体中后期生长受抑制;而多糖则需经菌体产生的胞外酶水解成单糖后再被吸收利用,克服了单糖、二糖代谢过快的缺点[22]。
2.2.2 氮源筛选结果
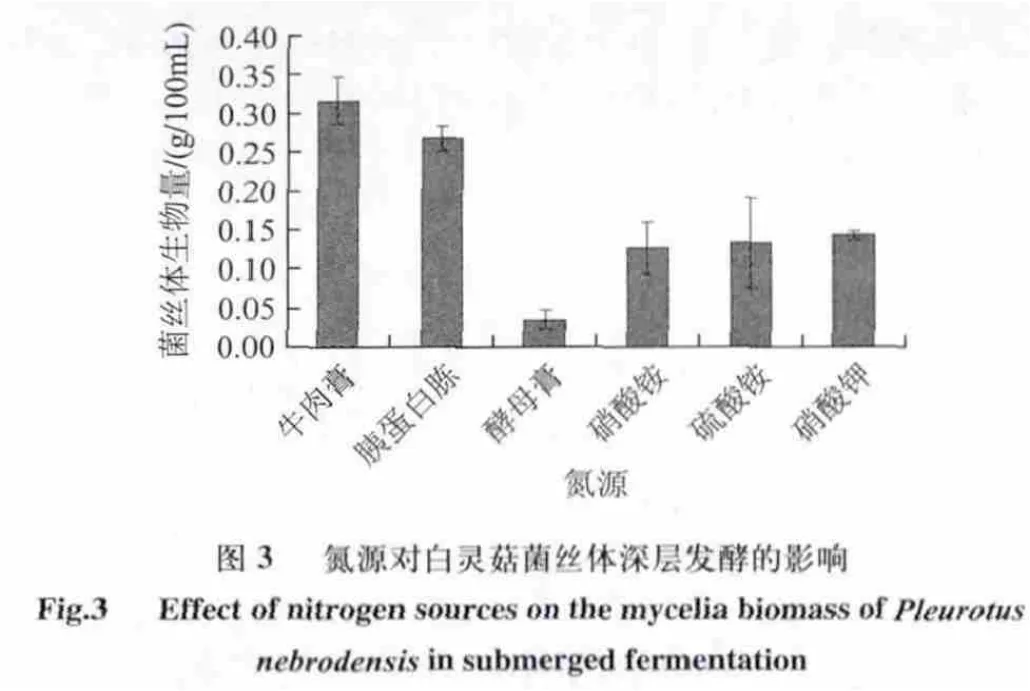
由图3可知,最佳氮源为牛肉膏,生物量达到0.317g/100mL ;其次为胰蛋白胨;酵母膏对菌丝体生长的促进作用最小,生物量仅为0.035g/100mL 。白灵菇在无机氮中生长缓慢,这是因为无机氮源不能提供白灵菇自身不能合成而生长发育所必需的一些氨基酸[23]。
2.3 最佳碳源、氮源、无机盐单因素试验
2.3.1 碳源质量浓度对白灵菇菌丝体深层发酵的影响
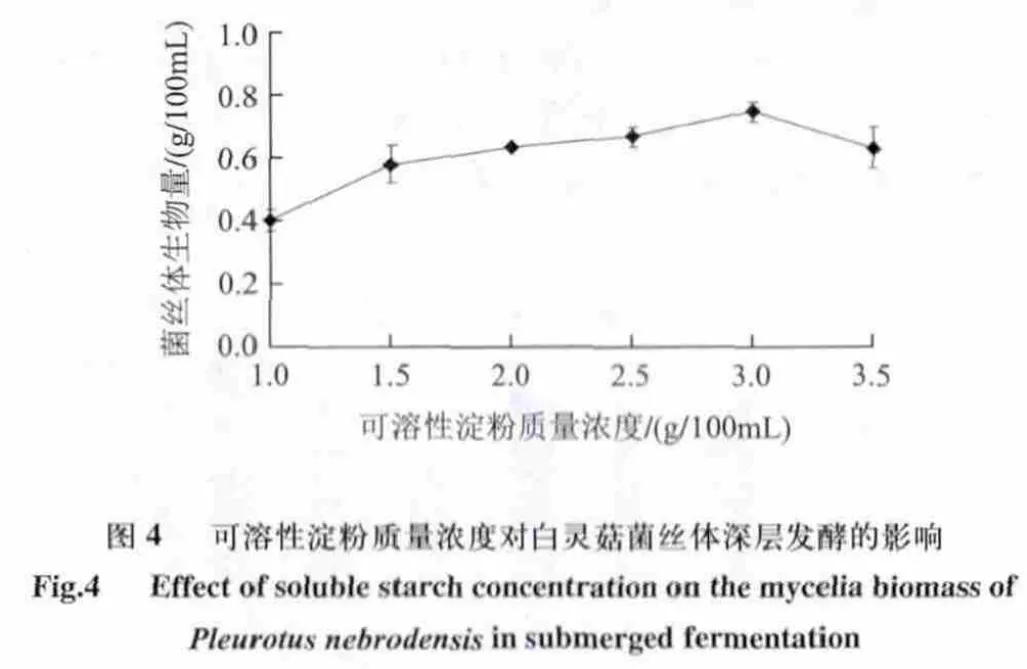
由图4可知,当可溶性淀粉质量浓度达到3.0g/100mL时菌丝体产量达到最高,生物量为0.746g/100mL ,其质量浓度过高和过低都不利于白灵菇菌丝体产量的提高,故可溶性淀粉质量浓度在2.5~3.5g/100mL为宜。
2.3.2 氮源质量浓度对白灵菇菌丝体深层发酵的影响
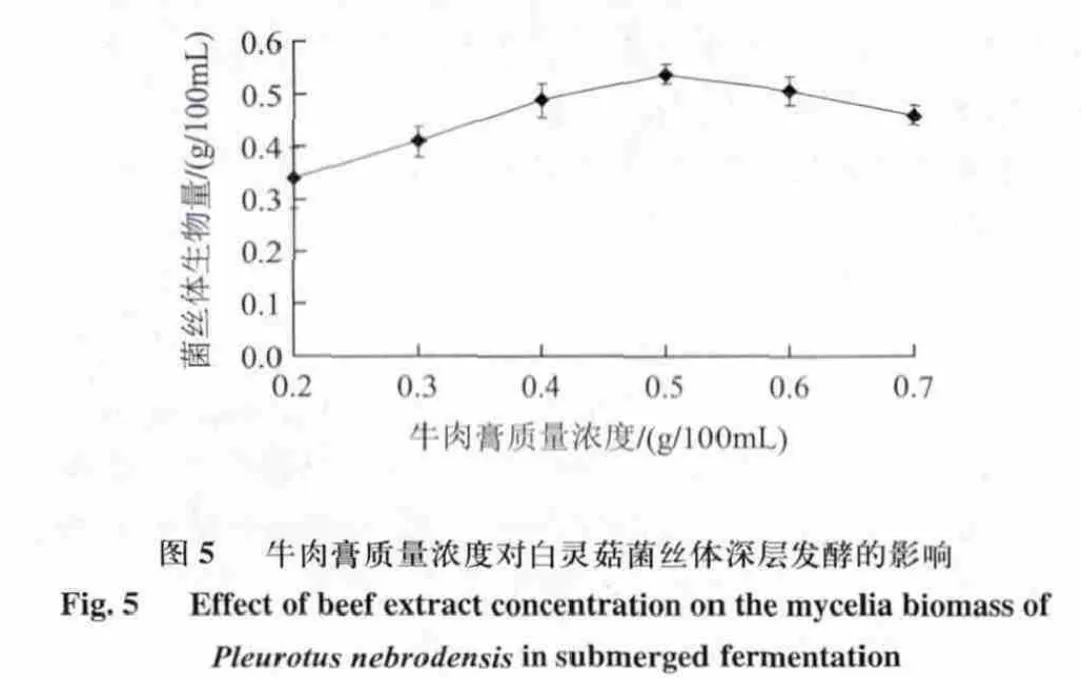
由图5可知,当牛肉膏质量浓度达到0.50g/100mL 时菌丝体产量达到最高,生物量为0.539g/mL,其质量浓度过高和过低都不利于白灵菇菌丝体产量的提高,故牛肉膏质量浓度在4~6g/L为宜。
2.3.3 无机盐质量浓度对白灵菇菌丝体深层发酵的影响
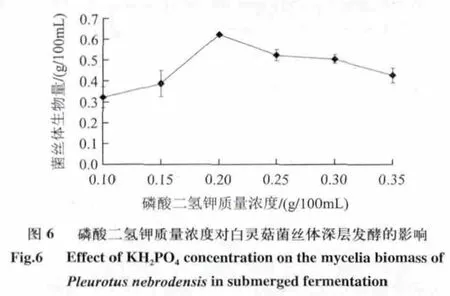
由图6可知,当磷酸二氢钾质量浓度达到0.20g/100mL 时菌丝体产量达到最高,为0.621g/100mL ,其质量浓度过高和过低都不利于白灵菇菌丝体产量的提高,故磷酸二氢钾质量浓度在0.15~0.25g/100mL 为宜。
2.3.4 硫酸镁质量浓度对白灵菇菌丝体深层发酵的影响
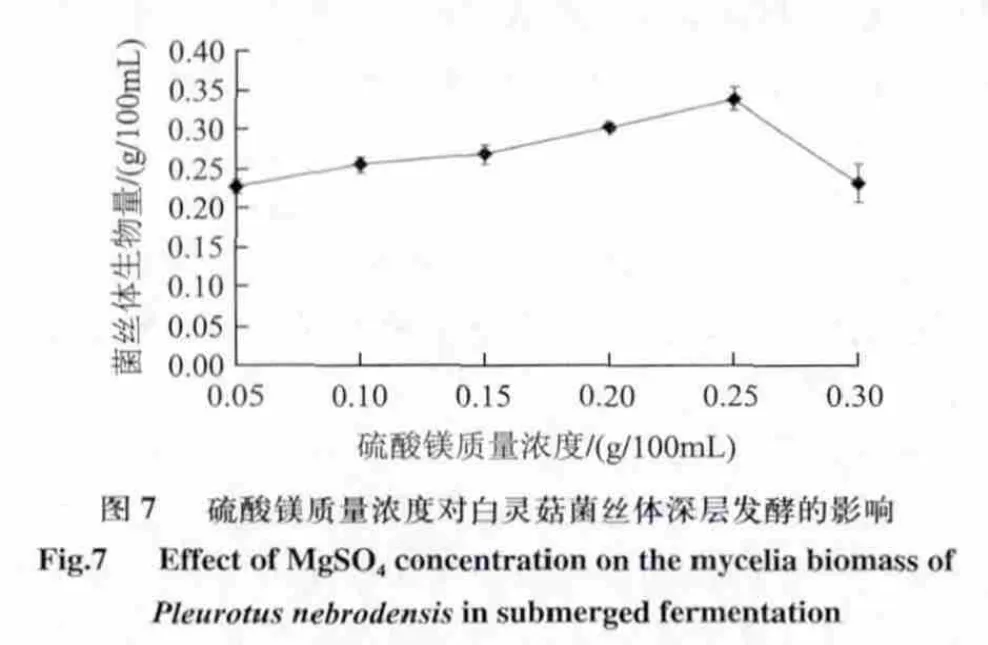
由图7可知,当硫酸镁质量浓度达到0.25g/100mL 时菌丝体产量达到最高,生物量为0.339g/100mL ,其质量浓度过高和过低都不利于白灵菇菌丝体产量的提高,故硫酸镁质量浓度在0.2~0.3g/100mL为宜。
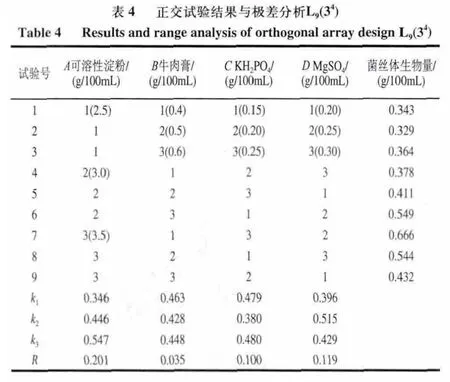
2.4 发酵培养基正交试验优化
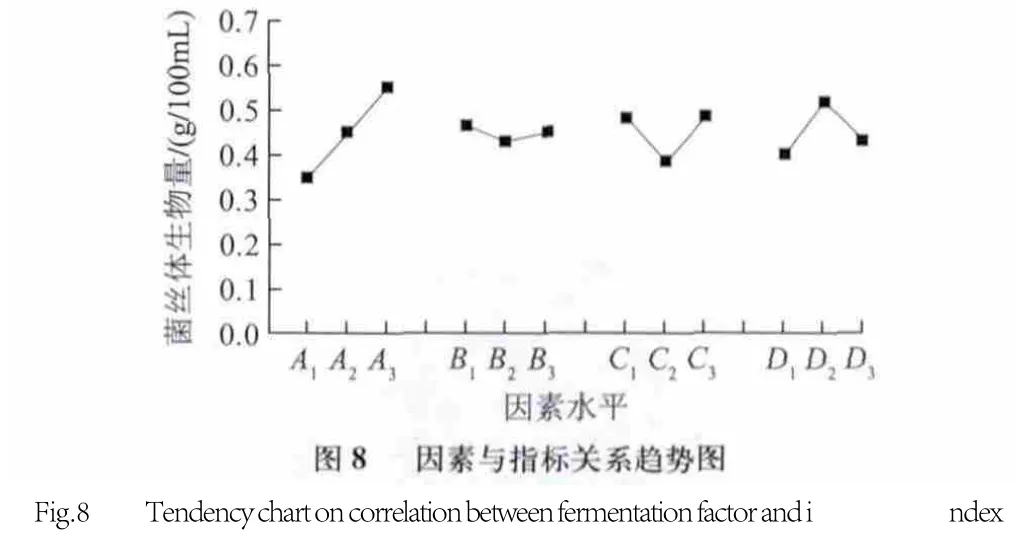
采用可溶性淀粉为碳源,牛肉膏为氮源,磷酸二氢钾、硫酸镁为无机盐的发酵培养基,进行1.3.5节正交试验(L9(34)),测定菌丝体干质量,结果和数据分析见表4和图8。由表4直观反映,第7号实验组合条件A3B1C3D2的菌丝体生物量最大(0.666g/100mL ),是各实验组中效果最好的;k值与极差分析显示,影响菌丝体发酵的因素主次顺序为:A(可溶性淀粉)>D(硫酸镁)>C(磷酸二氢钾)>B(牛肉膏)。理论最优条件组合为A3B1C3D2,即发酵培养基中可溶性淀粉、牛肉膏、磷酸二氢钾和硫酸镁质量浓度分别为3.50、0.40、0.25、0.25g/100mL 时,发酵白灵菇生物量最高。而由表4磷酸二氢钾k值可知,k1和k3数值基本相等,则磷酸二氢钾的质量浓度可选取水平1(0.15g/100mL)和水平3(0.25g/100mL),对此进行验证,结果表明,在相同工艺条件下采用发酵培养基组合A3B1C3D2得发酵菌丝体干质量0.632g/100mL ,高于A3B1C1D2条件下菌丝体干质量0.542g/100mL ,故发酵培养基优化方案确定为A3B1C3D2。
2.5 发酵条件单因素试验
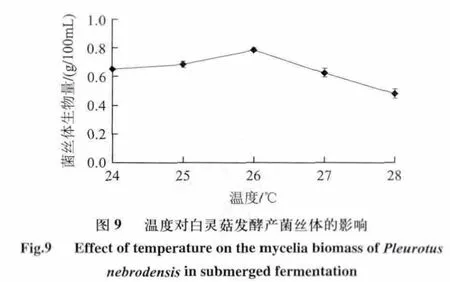
图9表明,温度从24℃上升到26℃的过程中,菌丝体生物量逐渐升高,增加趋势较明显,可能是由于随着温度升高与白灵菇菌丝体细胞生长代谢相关的酶活性逐渐增加所致。随着培养温度升至26~28℃,菌丝体生物量明显下降,原因一方面可能是与白灵菇菌丝体细胞生长代谢相关的酶耐热性差,随培养温度继续升高,酶活生物量,甚至变性失活;另一方面可能是由于白灵菇属于低温型食用菌,菌种在高温时大部分已死亡,无法继续生长。综合以上分析确定白灵菇发酵温度为26℃。
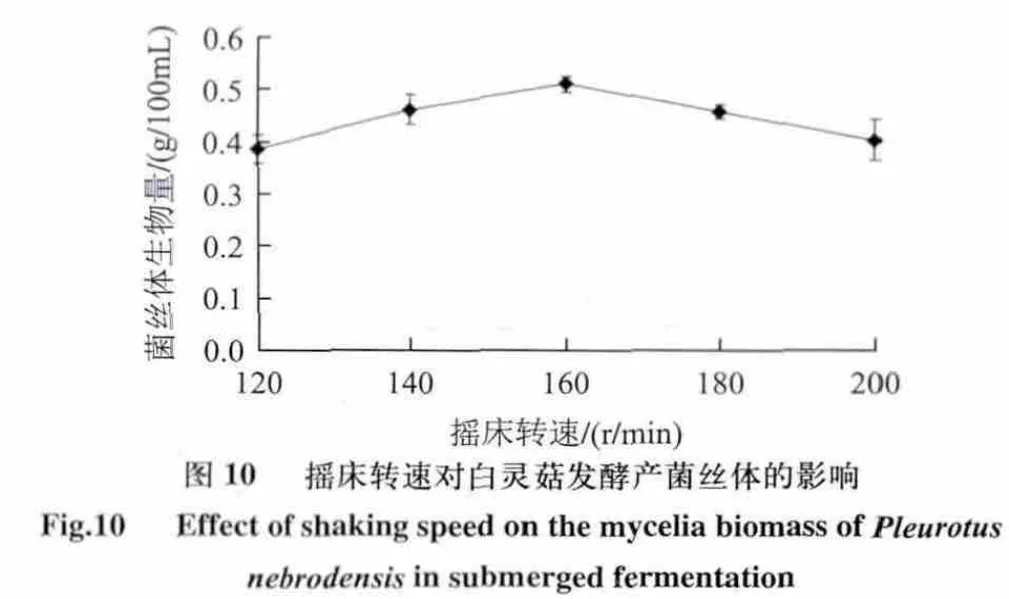
摇床转速直接影响摇瓶通气量的大小。当摇床转速过低时,通气量小,培养基内溶氧不足,难以满足菌丝体对氧气的需求;转速过高则剪切作用增强,增大了对菌球的机械刺激,亦不利于菌丝体的生长[24-25]。图10表明,在摇床转速160r/min时,菌丝体生物量最高,转速过高或过低均不利于白灵菇菌丝体的生长。
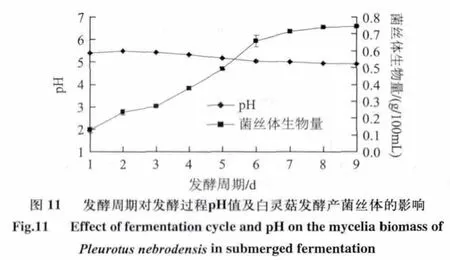
由图11可知,从发酵开始至6d左右,随着发酵时间的延长,菌丝体生物量呈快速上升趋势,发酵液的pH值则呈现逐渐下降的趋势;6d之后菌丝体生物量呈缓慢上升直至基本稳定,同时,发酵液pH值下降趋势趋缓至基本稳定。6d后白灵菇菌丝体增长缓慢可能有两方面的原因:一是再培养过程中菌丝球直径增大,导致营养物质和溶解氧向内传递越来越困难,使得菌丝体增加越来越困难,进入生长稳定期;二是随着发酵的进行,培养液中营养成分被不断消耗,代谢产物不断积累,使得菌丝体吸收不到足够的营养,生长缓慢。pH值下降可能是因为白灵菇菌丝体在生长过程中会产生酸性物质,随着时间的推移,酸性物质不断积累,导致培养液内pH值不断下降,最后由于菌丝体受到养分不足和代谢产物等的影响,生长缓慢并趋于稳定,因此,发酵液内的pH值也随之趋于稳定。综合考虑发酵时间延长必将增加生产成本等因素,故将白灵菇菌丝体液体发酵时间设定在7d。
2.6 响应面试验结果与优化分析
2.6.1 响应面设计及结果
根据单因素试验所确定的水平,采用Box-Behnken试验设计对白灵菇菌丝体发酵条件进行三因素三水平的响应面试验(表3),包括12个析因实验和3个中心实验,结果如表5所示。回归方程的方差分析结果归纳见表6。
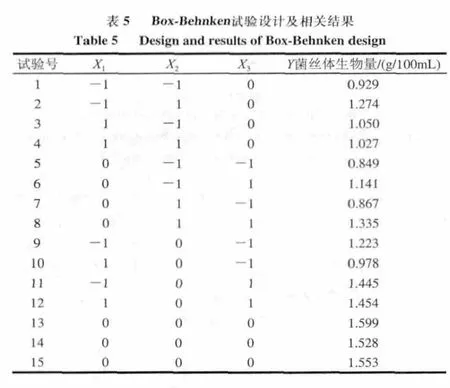
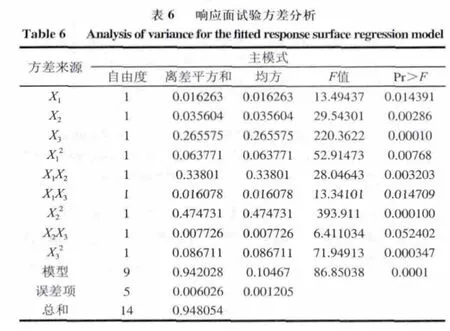
由表6回归方程各项的方差分析结果表明,X2、X3、X1
2、X1X2、X22、X3
2项影响是极为显著(P<0.01);由此所建立的模型也是极为显著(P<0.01);X1、X1X3对白灵菇发酵产菌丝体生物量的影响为显著(P<0.05);X2X3对白灵菇发酵产菌丝体生物量的影响不显著(P>0.05)。因此各具体实验因子对响应值的影响不是简单的线性关系,而是呈二次抛物面关系。复相关系数的平方R2=0.9936,说明由这3个因素及其二次项所建立的模型能解释白灵菇发酵产菌丝体生物量变化的99.36%,因此回归方程给白灵菇发酵产菌丝体提供了一个合适的模型。
由表6可知,各因素影响程度主次顺序为:X3(发酵周期)>X2(摇床转速)>X1(发酵温度)。由上述结果得出温度(X1)、摇床转速(X2)、发酵周期(X3)与菌丝体生物量(Y)的二次多项回归方程(编码后)为:Y=1.559767-0.045088 X1+0.066713 X2+0.1822 X3-0.131421 X12-0.091925 X1X2+0.0634 X1X3-0.358571 X22+0.04395 X2X3-0.153246 X32。
图12为运用SAS软件分析得到的响应面图,从图中可以直观地看出,各因子对响应值的影响变化趋势,而且回归模型存在最大值,即白灵菇菌丝体生物量在各因素所选择的范围内存在极值,即响应面的最高点。
为了求出最佳点的编码值,对回归方程取一阶偏导并整理得最佳发酵条件为温度(X1)=25.89℃,摇床转速(X2)=163r/min,发酵周期(X3)=7.48d(即179.52h),此时白灵菇菌丝体生物量最大估计值Y=1.632g/100mL 。考虑到实际操作的便利,确定发酵条件的最佳组合为:温度26℃,摇床转速160r/min,发酵周期7.5d(即180h)。
2.6.2 验证实验
为检验预测结果的可靠性,用以上得到的最佳组合进行验证实验,重复5次。得到的白灵菇菌丝体生物量为1.6004g/100mL ,与预测值Y=1.632g/100mL 拟合较好,说明回归方程为白灵菇菌丝体发酵提供了一个合适的模型。
3 结 论
实验从来自中国不同产区的19株白灵菇生产菌种中筛选出河北武安天山2号,该菌株生长速率快,品质好。
以河北武安天山2号菌株为实验菌株,通过正交设计及响应面设计试验能够实现白灵菇菌丝体深层发酵工艺的优化。实验确定的最佳发酵培养基组分为可溶性淀粉3.50g/100mL 、牛肉膏0.40g/100mL 、磷酸二氢钾0.25g/100mL 、硫酸镁0.25g/100mL ,pH值自然;优化发酵条件为温度26℃、摇床转速160r/min、发酵周期7.5d(180h)。此条件下发酵菌丝体生物量可达到1.6004g/100mL,实际值较预测值小1.94%,达到实验要求。
本实验为白灵菇菌丝体深层发酵技术的应用和工艺优化研究提供了依据、方法和途径。与已有的其他研究结果相比,本研究简化了白灵菇液体发酵培养基组分,缩短了培养周期,降低了液体发酵的生产成本,对于生产实际具有较好参考价值。
[1] 官志远, 任海霞, 李瑾, 等. 白灵菇菌丝生长营养物质优化试验[J].山东农业科学, 2008(7): 74-76; 79.
[2] 李玉梅, 陈艳秋. 黑木耳液体菌种应用于生产应注意的几个问题[J].食用菌, 2006(5): 34-35.
[3] 李书倩. 白灵菇深层发酵和多糖提取工艺的研究[D]. 沈阳: 沈阳农业大学, 2006.
[4] CHOI D B, NAM H G, CHA W S. Studies on cultivation and biological activities of Pleurotus nebrodensis inzenga[J]. Korean Journal of Chemical Engineering, 2006, 23(2): 241-246.
[5] 王广耀. 白灵菇液体菌种培养及栽培技术研究[D]. 北京: 中国农业科学院, 2007.
[6] 危茂贵, 钟卫民, 欧阳建华. 白灵菇液体菌种培养条件及栽培试验[J]. 食用菌学报, 2005, 12(2): 47-52.
[7] 黄聪亮, 唐玉琴. 白灵菇液体培养工艺研究[J]. 安徽农业科学, 2007, 35(35): 11382-11383.
[8] 任海霞, 官志远, 曲玲, 等. 白灵菇液体培养工艺的初步研究[J]. 中国农学通报, 2009, 25(4): 183-186.
[9] 孟俊龙, 闰辉, 杨杰, 等. 白灵菇深层发酵条件的优化[J]. 山西农业大学学报, 2010, 30(6): 548-552.
[10] 兰蓉, 张震, 吴迪, 等. 白灵菇多糖液体发酵工艺的优化[J]. 中国食用菌, 2010, 29(2): 42-44.
[11] 胡顺珍, 许梅, 贾乐. 白灵菇产胞外多糖液体培养条件优化[J]. 食品工业科技, 2007, 28(7): 76-78; 81.
[12] 宋瑞清, 向儒江, 翟传叶. 高效降解石油外生菌根真菌的室内筛选[J]. 菌物研究, 2010, 8(2): 96-102.
[13] 张长青, 王红英, 张建民, 等. 适宜白灵菇菌丝生长条件的研究[J].特产研究, 2003(4): 12-14; 18.
[14] 欧宏宇, 贾士儒. SAS软件在微生物培养条件优化中的应用[J]. 天津轻工业学院学报, 2001(1): 14-16; 27.
[15] 牛广财, 朱丹, 李志江, 等. 响应面法优化桑黄菌产胞外多糖的培养条件研究[J]. 中国酿造, 2009(2): 68-71.
[16] 张智, 朱宏亮, 钮宏禹, 等. 响应面法优化枯草芽孢杆菌产蛋白酶的发酵条件[J]. 食品科学, 2008, 29(12): 400-404.
[17] 王永斌, 王允祥. 翘鳞伞胞外多糖液体培养条件响应曲面法优化研究[J]. 试验报告与理论研究, 2008, 11(11): 22-26.
[18] MONTGOMERY D C. 实验设计与分析[M]. 汪仁官, 陈荣, 译. 北京: 中国统计出版社, 1998: 373.
[19] 郝学财, 余晓斌, 刘志钰, 等. 响应面方法在优化微生物培养基中的应用[J]. 食品研究与开发, 2006, 27(1): 38-41.
[20] THOMPSON D R. Response surface experimentation[J]. Journal of Food Processing and Preservation, 1982(6): 155.
[21] 李正鹏, 林毅, 蔡永萍, 等. 白灵菇液体发酵工艺[J]. 生物学杂志, 2006, 23(1): 28-30.
[22] 刘晓鹏, 姜宁, 魏璐, 等. 白灵菇深层发酵培养基的优化研究[J]. 中国酿造, 2009(3): 65-68.
[23] 丁玉萍. 以豆渣为原料培养白灵菇菌丝体的研究[J]. 中国食用菌, 2008, 27(2): 43-45.
[24] 李正鹏. 白灵菇液体发酵及其胞外多糖生物活性的研究[D]. 合肥:安徽农业大学, 2006.
[25] 貟建民,李赟,高静. 中药大黄对白灵菇液态发酵多糖含量的影响[J]. 食品与发酵工业, 2006, 34(10): 116-119.
Strain Screening of Pleurotus nebrodensis and Optimization of Submerged Culture Conditions for Biomass P rodution
JI Hong1,2, ZHAO Li-ming1
(1. Department of Management and Economics, Tianjin University, Tianjin 300072, China;2. School of Biology and Food Engineering, Changshu Insti tute of Technology, Changshu 215500, China)
Pleurotus nebrodensis Tianshan No.2 from Wuan, Hebei province was selected as the fa stest-growing of 19 strains. The culture medium for submerged fermentation of st rain Tianshan No.2 were optimized for the maximum biomass (dry cell weight, DCW) production using an orthogonal a rray design L9(34), and th ree culture conditions including temperature, shaking speed and time were optimized by response surface analysis based on a three-variable, three-level Box-Behnken experimental design. The results showed that the optima l medium composition (per 100 mL) was 3.50 g of soluble starch, 0.40 g of beef extract, 0.25 g of monopotassium phospha te and 0.25 g of magnesium sulfate. The mycelia biomass of strain Tianshan No.2 was 1.6004 g /100 mL after 7.5 d (180 h) of shaking culture at 26 ℃ with a shaking speed of 160 r/min using the optimized medium.
Pleurotus nebrodensis;submerged fermentation ;mycelia biomass ;orthogonal array design;response surface methodology
Q815
A
1002-6630(2013)23-0221-07
10.7506/spkx1002-6630-201323046
2013-06-22
苏州市科技局应用基础研究项目(SYN201007)
冀宏(1969—),男,教授,博士,研究方向为技术经济及管理、食用菌工程技术。E-mail:jihong@cslg. cn

