鸡肝乳糜流变及低场核磁性质研究
王 鹏,王华伟,邵俊杰,孙 健,赵颖颖,夏天兰,徐幸莲,周光宏
(肉品加工与质量控制教育部重点实验室,南京农业大学食品科技学院,江苏 南京 210095)
随着人民生活水平的提高,口感与风味独特的鹅肥肝受到了高档消费者的青睐。但鹅肥肝的原料有限且价格昂贵,所以研究者对利用鸡、鸭肝生产鹅肥肝的模拟产品——鸡肝酱开始重视。但已有的研究原料和加工方法各异,且主要以工艺探索为主,缺乏流变学等理论基础支撑[1-3]。
以往的鸡肝酱研究中,鸡肝和畜禽肉是其主要原料[2],猪背膘被用来改善原料的脂肪不足并提升产品风味[3]。其中的背膘脂肪具有乳化稳定肉糜、改善产品硬度、多汁性、风味等多种功能。在剪切作用下,猪背膘被分散为固态脂肪颗粒或者液态脂肪滴,畜禽肉的功能性单位——肌原纤维蛋白可在脂肪球表面形成一个乳化蛋白膜将脂肪固定在肉糜中。但是背膘脂肪用量高(通常为30%),而且其脂肪构成中饱和脂肪酸的比例高对人体的健康不利[4-5]。根据英国著名医学杂志《柳叶刀》2011年的报道,对199个国家和地区的研究证实,全球肥胖症男子比例从1980年的5%上升到2008年的10%。虽然2008年的统计数据表明,中国男性和女性的体质指数(Body Mass Index,BMI)低于世界平均水平,但中国男性过去28年内体质指数的增长速度高于全球平均值[6]。因此研究利用植物油代替背膘脂肪来生产鸡肝乳糜,具有一定的现实价值和理论意义。
和肉类乳化性能的较多研究相比,鸡肝对于乳糜体系的贡献以及鸡肉和鸡肝在乳糜体系中的关系现在尚无相关研究。本研究在前期工艺研究以及参考相关文献的基础上,以鸡肝、鸡胸肉和植物油为材料,经过剪切乳化后建立乳糜样品。研究乳糜体系流变和低场核磁性质,旨在从动态流变、水分布状态的角度对不同来源蛋白质乳化相互作用进行研究,从而为功能性鸡肝乳糜制品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
鸡肝、鸡胸肉和大豆油购于江苏南京苏果超市。化学试剂为分析纯。
1.2 仪器与设备
HH-42水浴锅 常州国华电器有限公司;MCR301旋转流变仪 奥地利安东帕公司;NMR PQ001低场核磁共振分析仪 上海纽迈电子有限公司;MUL-9000 H20纯水机 昆山总馨机械有限公司;RSD-5002食品搅拌机 九阳股份有限公司;DGG-9240A干燥箱 武汉中科万通仪器有限公司;2300型自动凯氏定氮仪 丹麦FOSS公司;MF-0617P马福炉 北京华港通科技有限公司;SOX500索氏抽提仪 济南海能仪器有限公司。
1.3 方法
1.3.1 化学指标测定
蛋白质、脂肪、水分、灰分的测定分别参照GB 5009.5—2010《食品中蛋白质的测定》[7]、GB/T 14772—2008《食品中粗脂肪的测定》[8]、GB 5009.3—2010《食品中水分的测定》[9]、GB 5009.4—2003《食品中灰分的测定》[10]。
1.3.2 乳糜配方及剪切乳化
设置鸡肝-大豆油乳糜、鸡胸肉-大豆油乳糜和鸡肝-鸡胸肉-大豆油3个实验组。第3组中原料鸡胸肉和鸡肝的质量比为0.75:1。3组的总脂肪含量统一标准化为35%,NaCl用量为2.5%。鸡肝和鸡肉剪为边长约1cm的立方体,而后将所有原料在搅拌机中按1000~1400r/min离心20s乳化为乳糜。乳糜(4±2)℃贮藏,12h内完成所有测定。
1.3.3 动态流变测定
将样品均匀涂布于测试平台,赶掉气泡。测试参数参考Wang Peng[11]、陈昌[12]等的方法:频率为0.1,应变为2%,上下板狭缝为1mm,升温过程为首先20~80℃线性升温(速率1℃/min)。平行板外蛋白与空气接触处用液体石蜡封住,防止加热过程中蛋白溶液蒸发。各处理测定3个重复。测定指标为流变储能模量G’,损耗模量G”,相位角δ。
1.3.4 低场核磁测定
NMR弛豫测量在台式脉冲NMR分析仪上进行。测试条件测试参数参考Wang Peng[11]、韩敏义[13]等的方法:质子共振频率为22.6MHz,测量温度为32℃。大约2g样品放入直径15mm核磁管。将样品进行水浴加热,从20℃以约1℃/min线性升温至80℃,并在80℃保温20min形成凝胶,接着从水浴锅中取出迅速放入冰屑中冷却,置于4℃冷库中放置24h,然后进行低场NMR测定。所使用参数为:τ值(90°脉冲和180°脉冲之间的时间)为200μs。重复扫描32次,重复间隔时间为6.5s得到12000个回波。自旋弛豫时间T2用CPMG序列进行测量。每个测试有4个重复。
1.4 数据处理与统计分析
应用SAS(V.8.0)统计软件进行方差分析和多重比较,方差分析采用ANOVA分析,Duncan’s法多重比较。主成分分析用Statistaica7.0软件完成。
2 结果与分析
2.1 鸡肝及鸡胸肉的基本化学成分
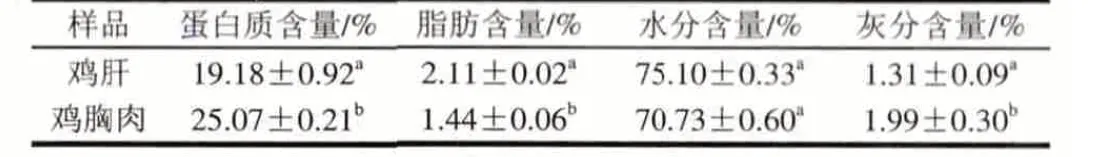
表 1 鸡肝和鸡胸肉基本化学成分Table 1 Chemical composition of chicken liver and chicken breast
由表1可知,鸡肝和鸡胸肉两者的基本化学成分只在水分含量一个指标上无显著差异(P>0.05),在蛋白质、脂肪、和灰分上都存在显著差异(P<0.05)。
2.2 鸡肝乳糜动态流变性质
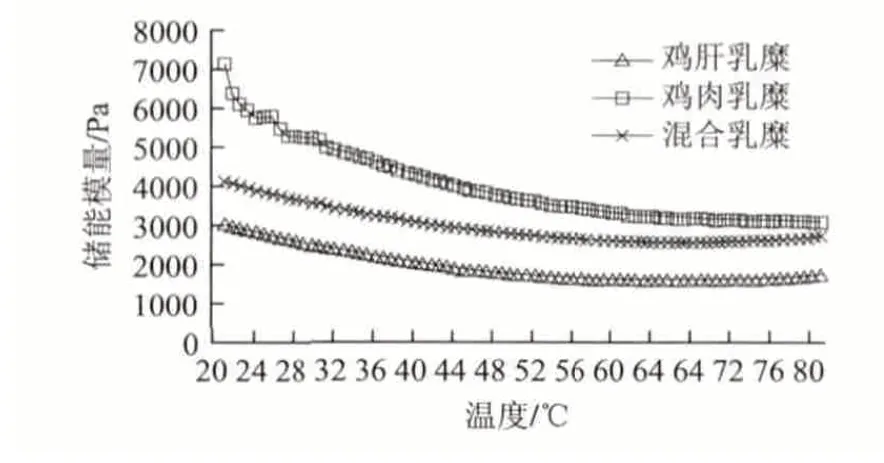
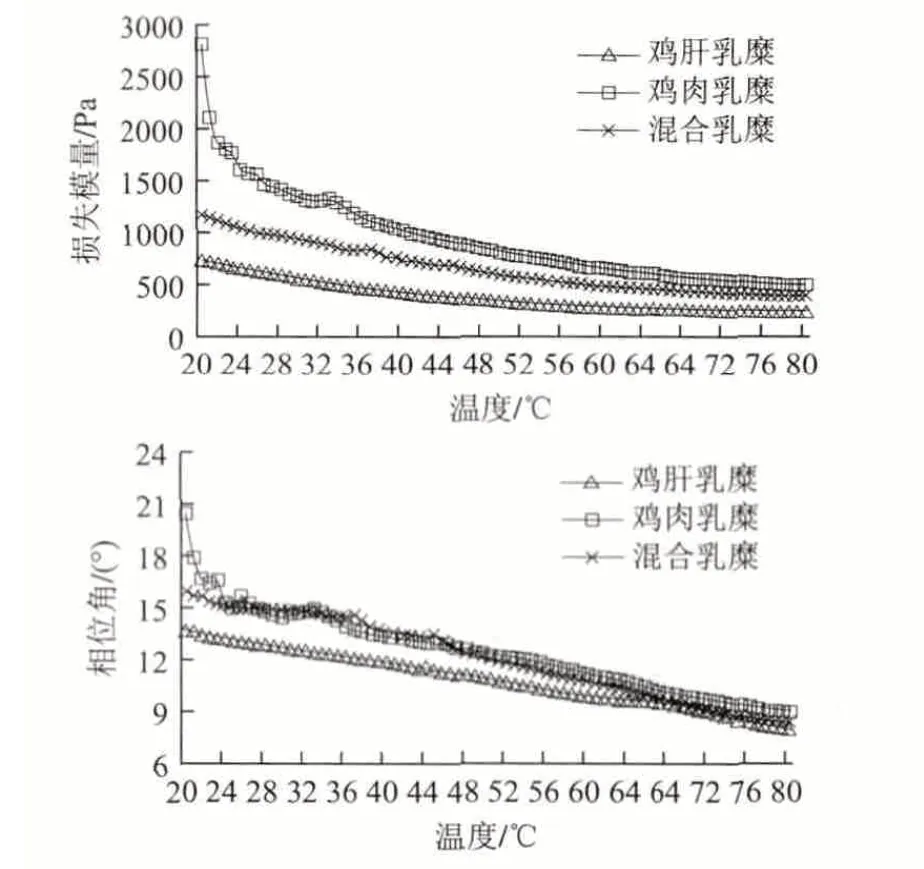
图 1 鸡肝乳糜的流变学特性Fig.1 Rheological characteristics of chicken liver emulsion composite gels
由图1可知,鸡肉乳糜、鸡肝乳糜和混合乳糜三者在程序升温加热情况下的储能模量变化趋势较为相似,都是随着温度的升高而逐渐降低,在三者中混合乳糜的变化趋势最为缓和,而鸡肉乳糜的实时测定值最高。热加工是保证乳糜产品卫生品质和口感的重要环节。从物理化学的角度看,乳糜体系是热力学不稳定体系,在外界能量的输入下,可能会发生破乳或者乳化状态的改变。
在温度设定范围、蛋白质含量以及是否采用纯化肌原纤维蛋白与相关研究[14-15]不同,因此结果也有所不同,而参与乳化蛋白质的数量、构成和在乳化膜的分布情况,对乳化体系稳定有重要影响[16-17]。所以,本实验中黏弹性下降的原因可能是因为原来包裹在脂肪球表面的胶原蛋白随着加热而流走进入连续相,使得整个体系的乳化性能发生变化[18]。在升温过程中,G’始终高于G”,这说明乳糜的弹性成分大于黏性成分。相位角可间接反映乳糜体系油滴大小,相位角越小,油滴直径越小,样品的弱凝胶特性越强[14,19];鸡肝、鸡肉和混合乳糜相位角分别处于7.9°、9.1°、8.4°的较低数值,这说明乳糜的凝胶态转变均已完成。将本实验中3个样品的最终相位角取正切后所得的数值较小,分布在0.14~0.16,说明乳糜体系已呈现了较强的呈现弱凝胶的特性,这与杨述[14]和Wu Mangang[20]的研究结果是一致的。
2.3 鸡肝乳糜低场核磁共振性质
不同种类的蛋白质之间,在热加工条件下可能会因为分子间相互作用力的关系而产生相互作用,进而影响其乳化状态与最终凝胶结构[21-22],而凝胶结构与毛细管水的存在直接相关[23]。由图2可知,拟合后3种乳糜的低场NMR T2弛豫时间分布为4个峰,所对应的T2弛豫时间分别为:T2b0.68~2.11ms、T2b-14.48~16.30ms、T2113.56.65~109.98ms、T22114.976~305.386ms。这4个弛豫时间段可能对应水的4种状态,即蛋白质结合水(T2b),乳化层水(T2b-1)、不易流动水(T21)和自由水(T22)。由图3可知,对应4种弛豫时间的峰面积比例中,鸡肝、鸡肉和混合乳糜的不易流动水比例(P21)分别是79.72%、68.50%和78.87%,也就是说呈不易流动状态的水(T21)占有乳糜都中最高的比例,这也就意味着3种乳糜都有较好的稳定性,在贮藏期间水分不易分离出来。这可能是因为3种乳糜都有较高的黏性模量(加热到80℃仍高于240Pa),整个体系的水主要以毛细管形式存在。在食品体系的贮藏变化和加工稳定性方面,低场核磁性质已被证实与乳化能力、稳定性以及凝胶稳定性相关[23-25],本研究也从水分分布的角度证实不同的原料对于乳糜低场核磁性质的影响。
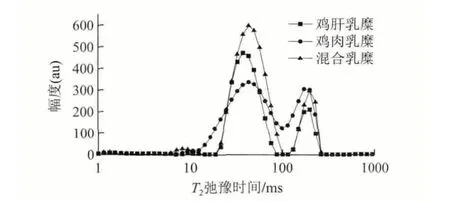
图 2 鸡肝乳糜的T2弛豫时间分布Fig.2 Distribution of T2 relaxation time of chicken liver emulsion composite gels

图 3 鸡肝乳糜的核磁峰面积百分数Fig.3 Percentage of four relaxation components of chicken liver emulsion composite gels
2.4 鸡肝乳糜主成分分析
鸡肝乳糜主成分分析是利用降维的思想,将多个变量通过线性变换以选出少数几个综合指标的一种多元统计分析方法[26]。从前3个主成分(PC)对总体方差的解释情况看,PC1、PC2和PC3分别解释了总体方差变异的62.83%、17.91%和11.22%,前3个主成分能够解释总体方差变异的91.96%,说明原始数据之间存在着很强的相关性。
每个变量对主成分的贡献情况见表2,第1主成分主要与化学成分指标中的灰分、蛋白质含量,流变测试中储能模量、损失模量和相位角的最终值,以及核磁测试中不易流动水的弛豫时间和自由水比例呈正相关;而与化学成分指标中的水分、脂肪以及核磁测试中不易流动水的比例呈较强(--)负相关。第2主成分主要与连续相蛋白结合水比例呈较强(++)正相关,而与核磁测试中不易流动水及自由水的弛豫时间,以及结合水的比例呈较强(--)负相关。
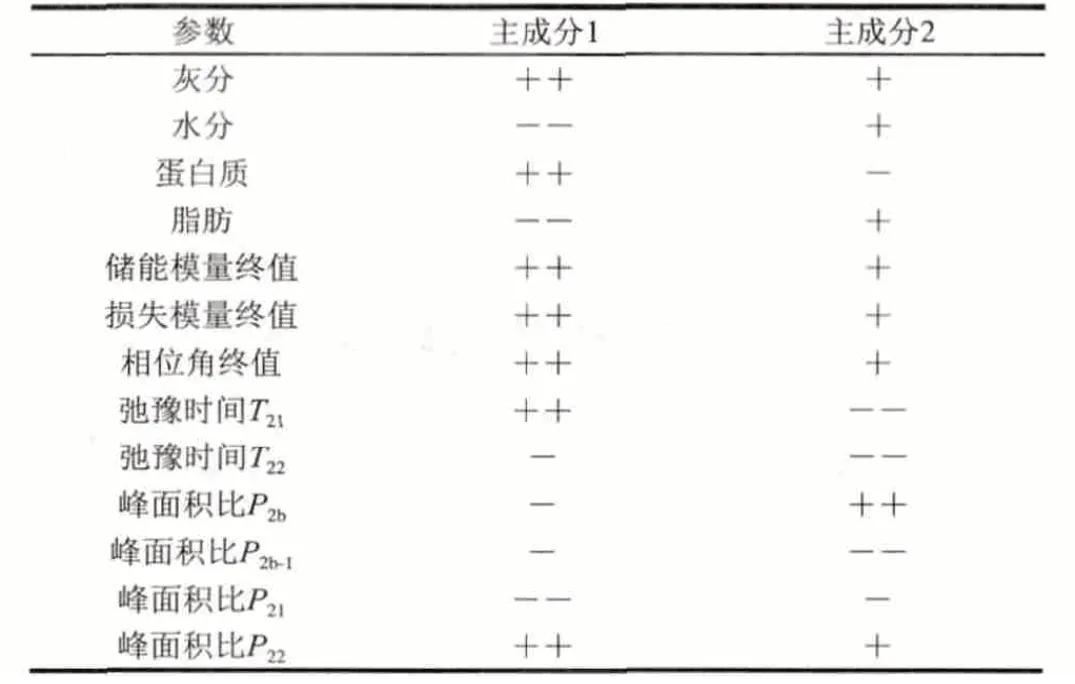
表 2 NMR反演结果的主成分分析中前两个主成分与各参数的系数Table 2 Principal component (PC) coefficients for NMR inversion data in principal component analysis

图 4 鸡肝乳糜的主成分评分图Fig.4 PCA score of chicken liver emulsion composite gels
由图4可知,由因子1和因子2构成的评分图中,鸡胸肉和鸡肝的乳糜分别分布在一二象限,表明二者的性质相差较多,而混合乳糜的分布在三四象限之间,结合流变与核磁的测定结果,其特征为较多的不易流动水比例以及适中的黏弹性,可以说是兼具了鸡肉和鸡肝乳糜的优势。
3 结 论
本实验研究鸡肝-鸡肉-大豆油复合乳糜的动态流变与低场核磁共振性质。结果显示复合乳糜在程序升温加热情况下储能模量和损失模量随着温度的升高而逐渐降低,在加热终点趋于稳定;乳糜的最终相位角呈现8.4°的较低数值,这说明乳糜的凝胶态转变已完成。复合乳糜中不易流动水高达78.87%,意味着其较好的货架期稳定性。主成分分析中,鸡胸肉乳糜和鸡肝乳糜的评分差异较大,而混合乳糜的性质介于二者之间。本研究说明利用副产物鸡肝开发不饱和脂肪酸含量较高的乳糜产品具有理论可行性,下一步工作的重点将是以此为基础进行不同饱和度植物油脂复配调节风味和口感的应用性探索。
[1] 罗欣, 杨玉身. 涂抹型肝泥肠的加工技术研究[J]. 肉类工业,1997(11): 32-34.
[2] 马元元, 杨雁, 袁书高, 等. 鸡肝酱的研制[J]. 肉类工业, 2012(1): 21-23.
[3] 赵希艳, 高光平, 杨洋. 鸡肝大蒜风味肠的研制[J]. 肉类工业,2009(10): 22-25.
[4] ARIHARA K. Strategies for designing novel functional meat products[J]. Meat Science, 2006, 74(1): 219-229.
[5] VANDENDRIESSCHE F. Meat products in the past, today and in the future[J]. Meat Science, 2008, 78(1/2): 104-113.
[6] FINUCANE M M, STEVENS G A, COWAN M J, et al. National,regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9 million participants[J]. The Lancet,2011, 377: 557-567
[7] 中华人民共和国卫生部. GB 5009.5—2010 食品安全国家标准 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[8] 中华人民共和国国家质量监督检验检疫总局. GB/T 14772—2008食品中粗脂肪的测定[S]. 北京: 中国标准出版社, 2008.
[9] 中华人民共和国卫生部. GB 5009.3—2010 食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2010.
[10] 中华人民共和国卫生部. GB/T 5009.4—2003 食品中灰分的测定[S]. 北京: 中国标准出版社, 2003.
[11] WANG Peng, XU Xinglian, HUANG Ming, et al. Effect of pH on heat-induced gelation of duck blood plasma protein[J]. Food Hydrocolloids, 2013, 35: 324-331.
[12] 陈昌, 王鹏, 徐幸莲. 不同质量比鸡胸肉, 鸡腿肉混合肌原纤维蛋白的热诱导凝胶特性[J]. 食品科学, 2012, 33(9): 58-63.
[13] 韩敏义, 费英, 徐幸莲, 等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2098-2014.
[14] 杨述, 高昕, 于甜, 等. 4 种蛋黄酱的流变特性比较研究[J]. 食品科学, 2011, 32(15): 121-125.
[15] WU Mangang, XIONG Youling L., CHEN Jie, et al. Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels[J]. Journal of Food Science, 2009, 74(4):207-217.
[16] JIANG Jiang, XIONG YoulingL.. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2012, 93(3): 469-476.
[17] SHAO Junhua, ZOU Yufeng, XU Xinglian, et al. Evaluation of structural changes in raw and heated meat batters prepared with different lipids using by raman spectroscopy[J]. Food Research International, 2011, 44(9): 2955-2961.
[18] 戴瑞彤, 杨龙江. 肉蛋白质的功能特性及其在肉品加工中的作用[J].肉类工业, 2000(11): 17-19.
[19] LIU He, XU Xueming, GUO Shidong. Rheological, texture and sensory properties of low-fat mayonnaise with different fat mimetics[J]. LWTFood Science and Technology, 2007, 40(6): 946-954.
[20] WU Mangang, XIONG Youling L., CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels:effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324.
[21] LIU Ru, ZHAO Siming, XIE Bijun, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906
[22] YIN Huaixia, WAN Yuting, PU Jianing, et al. Functional properties of protein fractions of channel catfish (Ictalurus punctatus) and their effects in an emulsion system[J]. Journal of Food Science, 2011, 76(3):E283-E290.
[23] HAN Mingyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670.
[24] JOHNS M L, HOLLINGSWORTH K G. Characterisation of emulsion systems using NMR and MRI[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2007, 50(2/3): 51-70.
[25] BOT A, DUVAL F P, BOUWMAN W G. Effect of processing on droplet cluster structure in emulsion gels[J]. Food Hydrocolloids,2007, 21(5): 844-854.
[26] WANG Peng, HAN Minyi, DONG Qingli, et al. Principal component analysis for textural properties of selected blood curd[J]. Journal of Texture Studies, 2010, 41(6): 757-773.

