黑灵芝葡聚糖高活性硫酸化产物的制备及分离纯化
张 汇,王君巧,聂少平,张莘莘,王远兴,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
灵芝(Ganoderma lucidum)是一种名贵真菌作物,在我国及其他东亚国家有着2000多年的食用或药用历史。如今,灵芝作为膳食补充剂成分,在西方国家也越来越受欢迎[1]。黑灵芝(G. atrum)广泛种植于我国江西赣南地区,和赤芝、紫芝等一起构成庞大的灵芝家族。近年来,黑灵芝的化学成分及药理研究越来越受到人们的关注。现已证实黑灵芝水提物的主要成分是多糖类化合物,具有抗肿瘤[2]、免疫调节[3]及抗氧化[4-5]等广泛的生物活性。然而,黑灵芝水提之后的残渣通常以废物的形式被丢弃,这给黑灵芝资源造成了极大的浪费。
人们普遍认为从真菌或植物中提取的β-(1→3)-葡聚糖具有免疫调节和抗肿瘤活性。然而对于α-(1→3)-葡聚糖,因其存在于真菌或植物细胞壁中,大多不溶于水,且不易用热水进行提取,被认为不具有生物学功能,因此对其的研究非常少。事实上,多糖的生物学功能与其水溶解性、分子质量大小、支化度及链构象等有着紧密的联系[6]。低支化度的α-(1→3)-葡聚糖在溶液中呈刚性链状,通常不发挥生物活性,而通过化学修饰(如硫酸化、磷酸化等)引入亲水性基团,可显著改善α-(1→3)-葡聚糖的水溶解性,并增强其生物活性[7]。Bao Xingfeng等[8]采用碱液从灵芝孢子粉中提取得到了水不溶性的α-(1→3)-葡聚糖,并证实通过化学修饰可以显著增强其免疫调节活性。而Zhang Pingyi等[9-10]采用同样的方法从香菇中提取水不溶性的α-(1→3)-葡聚糖,证实其硫酸化修饰产物具有抗肿瘤活性。
为充分利用和挖掘黑灵芝资源,实验室前期采用0.5mol/L NaOH溶液从黑灵芝水提残渣中提取活性成分,得到了一种水不溶性的多糖,经证实为一种低支化度的α-(1→3)-葡聚糖。为改善α-(1→3)-葡聚糖的水溶解性,本实验拟采用氯磺酸-吡啶法对其进行硫酸化修饰,通过凝胶渗透色谱和红外光谱进行表征,体外抗肿瘤实验筛选具有高活性的硫酸化多糖,在此基础上,进一步对筛选出的硫酸化多糖进行分离纯化及溶液性质分析,为黑灵芝作为新资源食品的开发及其副产物的综合利用提供新的研究思路。
1 材料与方法
1.1 材料与试剂
黑灵芝水不溶性多糖来源于本实验室的前期制备:采用0.5mol/L的NaOH溶液在4℃条件下浸提过夜,浸提液经中和、离心得到沉淀物,沉淀通过水洗和0.25mol/L LiCl的二甲基亚砜(DMSO)溶液溶解、透析、冻干,得到水不溶性的多糖。该多糖被证明是一种低支化度的α-(1→3)-葡聚糖,在DMSO中呈刚性链状。黑灵芝子实体采集于江西省赣州市,实验前晒干,切割成小块,用中药粉碎机反复粉碎。
HiLoadTM16/600 SuperdexTM200pg凝胶柱 美国Pharmacia公司;透析袋(截留分子质量为3600u) 美国Sigma公司;超纯水、乙醇、醋酸、硼氢化钠、氯磺酸(CSA)、吡啶、无水硫酸钠、甲酰胺、氢氧化钠、盐酸、硫酸钾、明胶、氯化钡等均为分析纯。
1.2 仪器与设备
ALPHA 1-2 LD冷冻干燥机 德国Martin Christ公司;ANKE TDL-5-A离心机 上海安亭分析仪器有限责任公司;TU-1901紫外双波长分光光度计 北京普析通用仪器有限公司;MULTISKAN MK3酶标仪 美国Thermo Electron公司;凝胶排阻色谱与多角度激光光散射联用仪(HPSEC-MALLS) (配有Shodex OHpak SB-G保护柱,Shodex OHpak SB-806 HQ (8mm×300mm),以及HELEOS-Ⅱ激光光散射检测器(MALLS),Visco Star-Ⅱ黏度检测器和Optilab rEX示差检测器) 美国Wyatt公司。
1.3 方法
1.3.1 正交试验设计制备不同酯化度的硫酸化衍生物
采用氯磺酸-吡啶法(CSA-Pyr)对黑灵芝水不溶性多糖进行硫酸化修饰,选取对多糖硫酸化修饰影响较大的CSA与Pyr的体积比(A),酯化温度(B)和反应时间(C)作为因素进行正交试验设计(表1),设置三因素三水平L9(33),并采用明胶比浊法来评价酯化效果。

表 1 三因素三水平L9(33)正交试验设计Table 1 Three factors and three levels used in orthogonal array design
1.3.2 酯化试剂的制备
根据表1设计,配制5mL的酯化试剂。量取无水吡啶(无水硫酸钠干燥),转入250mL三口烧瓶中,冰水浴中缓慢滴加CSA,搅拌,40min内加完。滴加完CSA后,再在室温下搅拌30min,低温保存备用。
1.3.3 多糖硫酸化过程
取水不溶性样品0.2g,悬浮于20mL无水甲酰胺中,反应瓶置于冰浴中,逐滴加入5mL酯化试剂,边搅拌边加入,按条件在三口烧瓶中进行反应。反应结束后,冷却至室温,用1mol/L NaOH溶液调节pH值至中性,离心除去不溶物,上清液置于透析袋中透析3d。将透析内液旋转浓缩至10~20mL,乙醇沉淀,离心,沉淀物用无水乙醇反复洗涤、冻干,得到不同酯化度的硫酸化多糖样品。
1.3.4 硫酸化多糖酯化度的测定
以硫酸钾为标准,采用明胶比浊法[11]测定硫酸基团的含量,按照公式(1)计算酯化度。

式中:DS表示酯化度;C表示硫元素含量/%。
同时以葡萄糖为标准,采用苯酚-硫酸法测定不同硫酸化多糖的总糖含量。
1.3.5 硫酸化多糖红外光谱分析
取适量硫酸化多糖样品(充分干燥粉末),以KBr混合研磨成粉,压片,在400~4000cm-1范围内扫描红外光谱图。
1.3.6 不同硫酸化多糖体外抗肿瘤活性筛选
S-180肉瘤细胞进行常规传代培养,选用对数生长期良好的细胞液收集于离心管中以1200r/min离心5min,弃上清液,用含10%胎牛血清的RPMI-1640培养基调节细胞浓度为5×105个/mL后,接种于96孔细胞培养板中,每孔100L;然后将不同体积的硫酸化多糖溶液加入孔板中,使终体积为200L,终质量浓度分别为25、50、100、200、400μg/mL,以用含10%的胎牛血清的RPMI-1640培养液培养的S-180细胞为对照,每组设5个复孔,在37℃、5%的二氧化碳培养箱中培养48h。用MTT法在570nm处测定细胞存活度,按照公式(2)计算抑制率,所有数据进行t检验。

式中:A给药组和A对照组分别表示给药组和对照组的吸光度。
1.3.7 高活性硫酸化多糖的分离纯化及纯度鉴定
采用HiLoadTM16/600 SuperdexTM200pg凝胶柱(16mm×60cm)对高活性的硫酸化多糖进行分离纯化。经初步摸索,确定洗脱条件为:多糖质量浓度为4mg/mL,洗脱液为超纯水,流速0.6mL/min,进样量1mL,6min/管进行收集,苯酚-硫酸法跟踪检测,收集峰尖各管,用超纯水透析2d,浓缩,冻干得到纯度较高的硫酸化多糖。
采用高效凝胶渗透色谱法(HPGPC)鉴定硫酸化多糖的纯度。色谱条件:Agilent 1200液相系统,配有BIDNDC/GPC检测器,PL柱(PL aquagel-OH 60 8μm)。将样品配成1mg/mL的水溶液,进样100μL,以0.02% NaN3溶液为流动相,流速0.6mL/min,柱温35℃,数据采集时间30min,BIC ParSEC Chromatography Software采集信号,观察样品的色谱峰。
1.3.8 高活性硫酸化多糖的溶液性质
采用高效凝胶渗透色谱与多角度激光光散射联用技术(HPSEC-MALLS)测定硫酸化多糖的分子质量及其分布。色谱条件为:色谱柱:Shodex OHpak SB-G保护柱与Shodex OHpak SB-806 HQ分析柱串联 (8mm×300mm),检测器:HELEOS-Ⅱ激光光散射检测器(MALLS),Visco Star-Ⅱ黏度检测器和Optilab rEX示差检测器,流动相为0.1mol/L NaNO3溶液(含有0.02%的NaN3),流速为0.6mL/min,柱温35℃,检测器温度为25℃,数据采集时间为60min,样品溶液的示差折光指数增量DN/DC取0.146,ASTRA软件采集并分析数据。
2 结果与分析
2.1 硫酸酯化修饰结果
多糖的硫酸化修饰有多种方法,但对于吡喃型多糖,氯磺酸-吡啶法最为常见和适用[12],在这个反应中,以CSA和Pyr的体积比、反应时间和反应温度3个因素对酯化效果影响最大[13]。因此,本实验以这3个因素进行正交试验设计,以酯化度(DS)、糖含量和凝胶渗透色谱行为作为指标评价黑灵芝水不溶性葡聚糖的硫酸化修饰条件,结果见表2和图1。
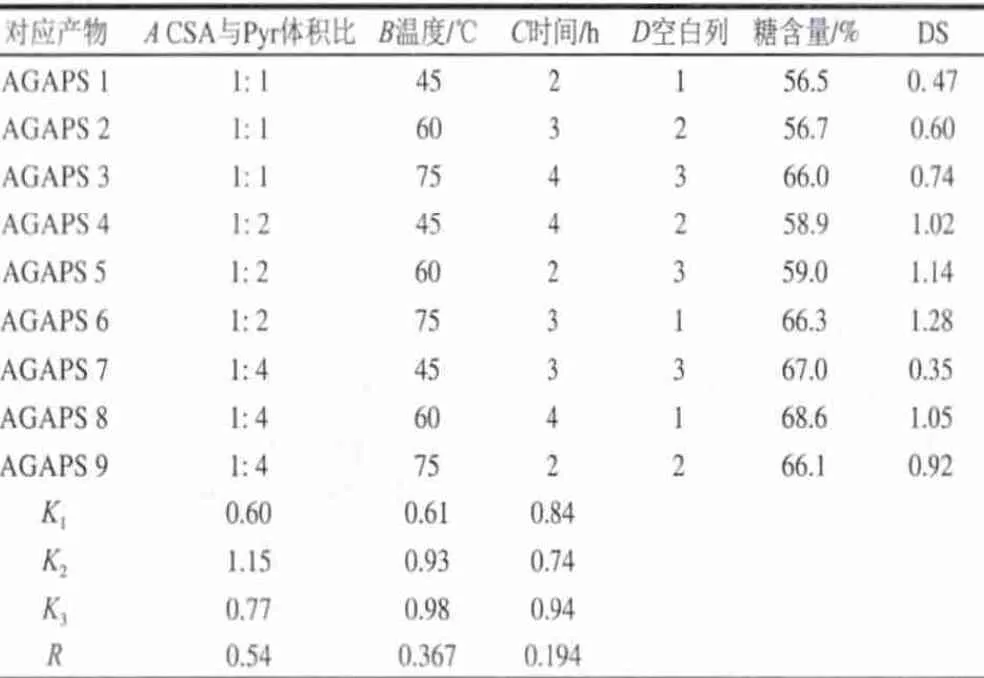
表 2 硫酸化修饰正交试验结果Table 2 Orthogonal array design and results for sulfated modification
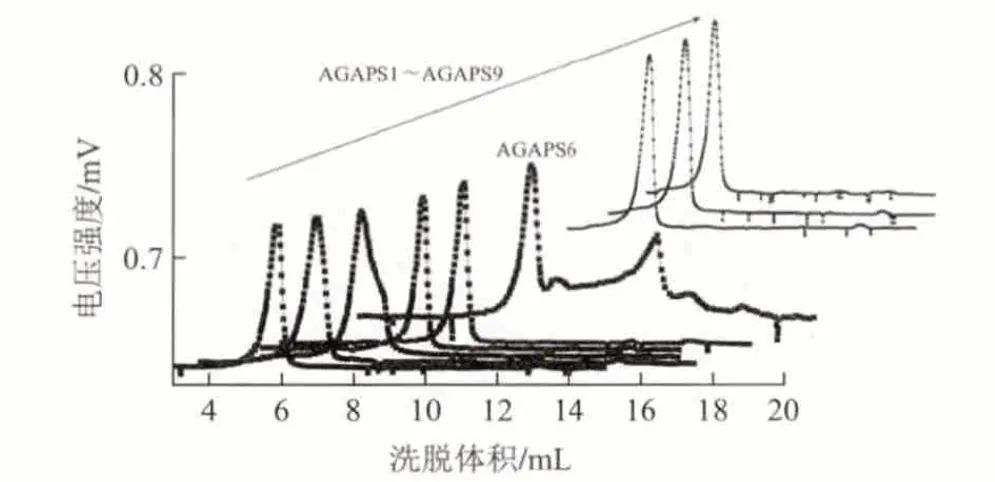
图 1 黑灵芝水不溶性葡聚糖硫酸化修饰产物凝胶渗透色谱行为Fig.1 HPSEC curve of sulfated derivatives of water-insoluble glucan from Ganoderma atrum
由表2可知,不同条件下得到的修饰产物酯化度不同,当CSA与Pyr的体积比为1:2时,酯化效果最好;当CSA比例偏高时(1:1),由于酯化试剂发生结块现象,CSA不能很好的发挥其活性,从而酯化效果不佳[11];当CSA比例降低时(1:4),温度和时间的影响得到加强。最终通过正交试验得到了9个不同酯化度的硫酸化修饰产物。以酯化度(DS)为指标,对正交试验结果进行统计学分析,发现酯化试剂比例(A)的极差最大,其次是反应温度(B)和反应时间(C),所以各因素对DS的影响程度依次为A>B>C,最佳组合为A2B3C3。表3方差分析结果表明,3个因素对酯化度的影响都没有显著性差异(P>0.05),因此,可根据实际情况来确定硫酸化修饰条件。验证实验结果表明:最佳组合A2B3C3得到的修饰产物酯化度为1.30,与组合A2B3C2的结果无显著性差异,考虑到酯化时间过长可能对多糖结构产生影响,因此,本实验选择A2B3C2组合作为最佳的硫酸化修饰条件。
从糖含量来看,不同酯化条件得到的硫酸化多糖其糖含量不同,且对于相同CSA比例的修饰产物,酯化度越高,其糖含量也相对增加,但差异不大。与硫酸化修饰前的AGAP样(糖含量为98.2%)进行比较发现,硫酸化修饰后糖含量都显著下降,这是因为硫酸化修饰产物结合上新的硫酸基团,相应的糖含量自然会有所下降[14]。
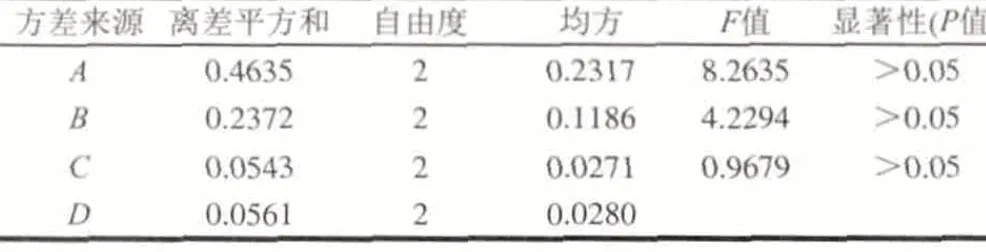
表 3 硫酸化修饰正交试验结果方差分析Table 3 Analysis of variance for sulfated modification
修饰产物的凝胶渗透色谱(HPGPC)行为分析发现,虽然在设定的最佳酯化A2B3C2条件下,得到AGAPS6酯化度最高(DS 1.28),但多糖分子链发生了一定的化学降解,而在其他条件下均未发生这种降解,表现为单一的色谱峰。这表明,在酯化过程中,苛刻的反应条件(如高温和高氯磺酸比例)会对多糖分子链产生一定的影响,并有降解糖链的趋势;本实验除AGAPS6外,其他酯化条件对黑灵芝水不溶性葡聚糖都没有造成结构的破坏,反应过程较为温和。
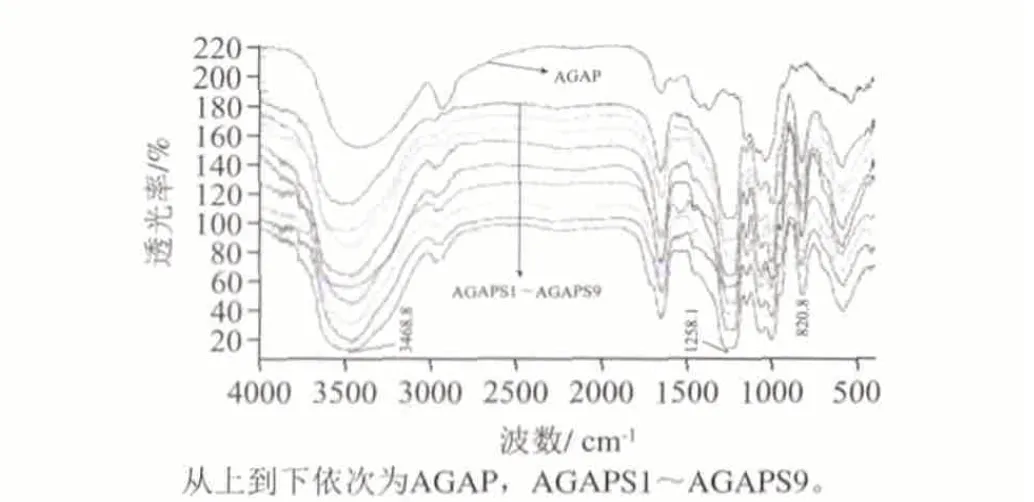
图 2 黑灵芝水不溶性葡聚糖硫酸化修饰产物红外光谱图Fig.2 FT-IR spectra of sulfated derivatives of water-insoluble glucan from Ganoderma atrum
由图2可知,硫酸酯化后的多糖保留了多糖母体特征吸收峰,主要差别在1260cm-1和820cm-1附近。硫酸酯化前的AGAP这两处均无特征吸收,经硫酸化后出现强吸收峰。其中1260cm-1为S=O的伸缩振动,820cm-1为糖环C-O-S的伸缩振动的特征峰[15]。此外3400cm-1附近的羟基吸收峰有所降低,表明部分羟基已被酯化,以上结论表明硫酸酯基已连接在多糖链上。
综上分析,本实验根据酯化度大小和多糖结构完整性选择了酯化度最低(AGAPS7)、最高(AGAPS5)和中等(AGAPS3)的3个样品作为进一步研究的对象,探讨硫酸化修饰产物的体外抗肿瘤活性及不同酯化度对抗肿瘤活性的影响,旨在筛选出具有高活性的硫酸化多糖。
2.2 硫酸化修饰产物体外抗肿瘤活性筛选结果
硫酸化修饰能增强多糖的生物活性,部分研究成果也已进入临床应用[16]。研究表明,硫酸化多糖在抗肿瘤活性方面有着显著的增强作用,如对S-180肉瘤细胞、人胃癌细胞SGC-790和肝癌细胞HepG2等都有直接的杀伤作用[17-18]。由图3可知,AGAPS3、AGAPS5和AGAPS7对S-180肉瘤细胞的生长有显著的抑制作用,且成剂量依赖关系。从酯化度来看,AGAPS5 (DS=1.14)的抑制作用最明显,当质量浓度达到400μg/mL时,抑制率达到67.74%,而AGAPS3(DS=0.74) 和AGAPS7 (DS=0.35)在相同质量浓度下的抑制率分别为42.44%和33.70%,这表明硫酸化多糖对S-180肉瘤细胞的抑制作用与酯化度成正相关。
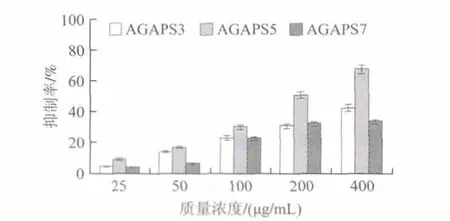
图 3 不同酯化度硫酸化多糖对S-180肉瘤细胞生长的抑制作用Fig.3 Inhibitory effects of sulfated polysaccharides with different DS on the growth of S-180 sarcoma cells
因此,本实验筛选酯化度高、抑制肿瘤细胞生长强的AGAPS5(DS=1.14)作为进一步的研究对象,对其进行分离纯化和溶液性质的分析。
2.3 高活性硫酸化多糖的分离纯化及纯度鉴定
采用Superdex G 200pg凝胶柱对AGAPS5进行分离纯化,苯酚-硫酸法跟踪检测,其洗脱曲线如图4所示。
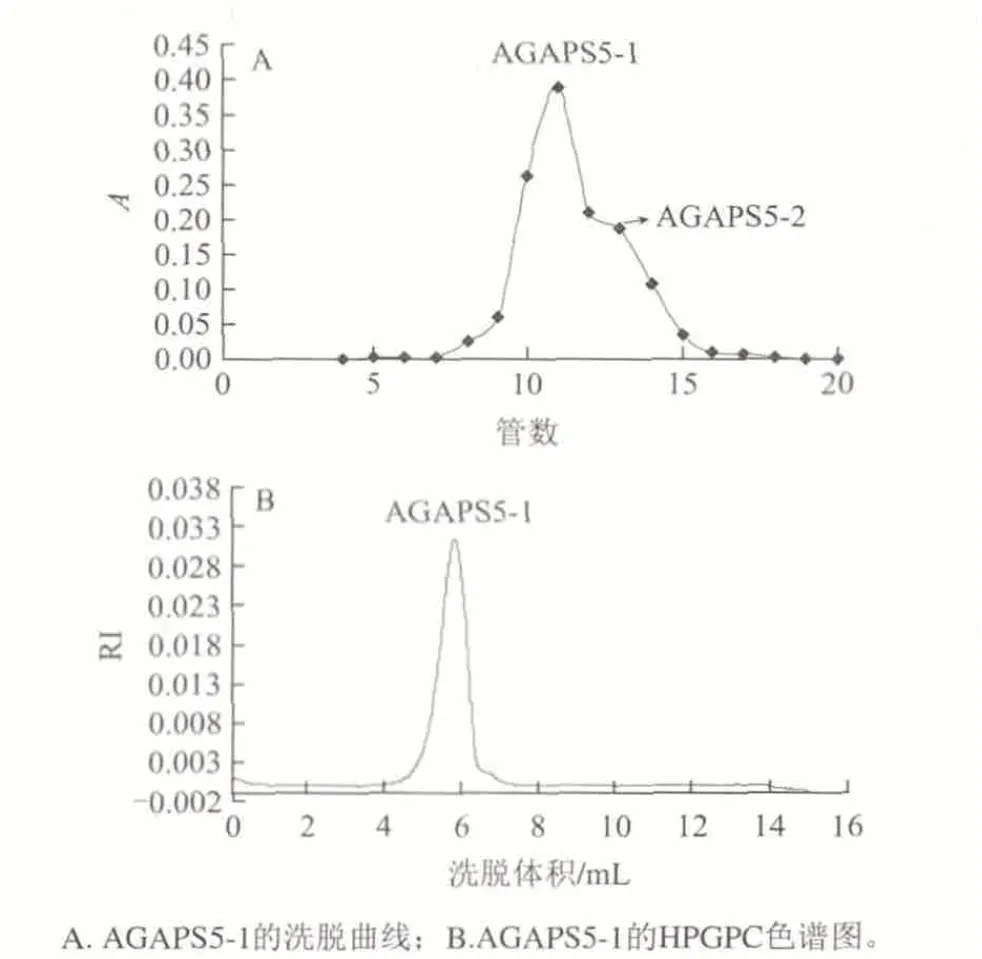
图 4 AGAPS5在HiLoadTM 16/600 Superdex G 200pg凝胶柱上的洗脱曲线(A)及纯度鉴定(B)结果Fig.4 Elution curve of AGAPS5 on HiLoadTM 16/600 Superdex G 200 pg column (A) and purity identification (B)
由图4可知,柱分离可得到两个不同组分的酯化多糖,而以第一个组分为主,将之命名为AGAPS5-1,得率为20.42%。经高效凝胶渗透色谱法(HPGPC)鉴定,AGAPS5-1的色谱峰为单一正态峰,证明其为高纯度的硫酸化多糖。
2.4 溶液性质分析结果
高效凝胶渗透色谱(HPSEC)与多检测器联用技术为高分子溶液的表征提供了方便。HPSEC与多角度光散射检测器(MALLS)和示差检测器(RID)联用被认为是测定多糖分子质量的绝对方法[19],而与黏度检测器的联用能提供多糖每个分子质量片段的特性黏度[η],从而能方便的计算出Mark-Houwink方程,并由此来判断分子在溶液中的构象行为。采用HPSEC-MALLS-RID-Vis联用技术测定了AGAPS5-1的分子质量及其分布等,结果见表4。

表 4 高活性硫酸化纯多糖(AGAPS5-1)的分子质量、分布及特性黏度分析结果Table 4 Molecular weight (Mw) distribution and intrinsic viscosity of AGAPS5-1
由表4可知,AGAPS5-1的Mw和Mn分别为5.19×104u和2.63×104u,多分散性系数PI为1.97,表明AGAPS5-1是宽分布的大分子物质;AGAPS5-1的z-均回旋半径<S2>z1/2为38.3nm,特性黏度[η]为27.28mL/g,根据体积排阻计算得到的Mark-Houwink方程指数α=0.623,表明AGAPS5-1在0.1mol/L NaNO3(含有0.02%的NaN3)溶液中呈无规线团分散[7]。由于硫酸基团的加入,硫酸化修饰能改变多糖在溶液中的构象行为,并最终导致理化性质及生物活性的改变[10,20]。黑灵芝水不溶性葡聚糖经硫酸化修饰后,由刚性链状变成无规线团分布,改善了其在水中的溶解性,从而为水不溶性多糖的研究开发和商业应用提供了可能和方便。
3 结 论
采用氯磺酸-吡啶法对黑灵芝水不溶性葡聚糖进行硫酸酯化修饰,得到9种不同酯化度的水溶性修饰产物,通过凝胶色谱行为和对肿瘤细胞毒性作用的研究,筛选了具有高活性的硫酸化多糖AGAPS5作为进一步研究的对象,其酯化度为1.14,糖含量为66.3%,对S-180肉瘤细胞生长的抑制率为67.74%。经HiLoadTM16/600 SuperdexTM200pg凝胶柱分离纯度得到高纯度的AGAPS5-1,HPSECMALLS联用技术分析表明AGAPS5-1在0.1mol/L NaNO3溶液中的Mw和Mn分别为5.19×104u和2.63×104u,呈多分散性,以无规线团状形式存在。本研究表明硫酸化修饰能改善黑灵芝水不溶性葡聚糖的水溶解性和溶液性质,增强体外抗肿瘤活性,为黑灵芝作为新资源食品的开发及其副产物的综合利用提供了新的研究思路。
[1] SULLIVAN R, SMITH J E, ROWAN N J. Medicinal mushrooms and cancer therapy: translating a traditional practice into western medicine[J].Perspectives in Biology and Medicine, 2006, 49(2): 159-170.
[2] LI Wenjuan, CHEN Yi, NIE Shaoping, et al. Ganoderma atrum Polysaccharide induces anti-tumor activity via the mitochondrial apoptotic pathwayrelated to activation of host immune response[J].Journal of Cellular Biochemistry, 2011, 112(3): 860-871.
[3] ZHANG Shenshen, NIE Shaoping, HUANG Danfei, et al.Immunomodulatory effect of Ganoderma atrum polysaccharide on CT26 tumor-bearing mice[J]. Food Chemistry, 2012, 136(3/4): 1213-1219.
[4] CHEN Yi, XIE Mingyong, NIE Shaoping, et al. Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008,107(1): 231-241.,
[5] 张汇, 鄢嫣, 聂少平, 等. 黑灵芝不同部位多糖成分分析及抗氧化活性[J]. 食品科学, 2011, 32(1): 56-61.
[6] ZHANG Mei, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mushrooms: a review on their isolation process,structural characteristics and antitumor activity[J]. Trends in Food Science & Technology, 2007, 18(1): 4-19.
[7] 李盛, 许淑琴, 张俐娜. 菌类多糖链构象及其表征方法研究进展[J].高分子学报, 2010(12): 1359-1375.
[8] BAO Xingfeng, DUAN Jinyou, FANG Xuya, et al. Chemical Modifications of the (1→3)-α-D-glucan from spores of Ganoderma lucidum and investigation of their physicochemical properties and immunological activity[J]. Carbohydrate Research, 2001, 336(2): 127-140.
[9] ZHANG Pingyi, ZHANG Lina, CHENG Sh uyao. Chemical structure and molecular weights of (1→3)-α-D-glucan from Lentinus dodes[J].Bioscience, Biotechnology, and Biochemistry, 1999, 63(7): 1197-1202.
[10] ZHANG Pingyi, CHEUNG P C K. Evaluation of sulfated Lentinus edodes. (1→3)-α-D-glucan as a potential antitumor agent[J]. Bioscience,Biotechnology, and Biochemistry, 2002, 66(5): 1052-1056.
[11] WANG Li, LI Xiaoxuan, CHEN Zhengxing. Sulfated modification of the polysaccharides obtained from defatted rice bran and their antitumor activities[J]. International Journal of Biological Macromolecules, 2009, 44(2): 211-214.
[12] 方积年. 硫酸酯化多糖的研究进展[J]. 中国药学杂志, 1993, 28(7):393-395.
[13] LU Yu, WANG Deyun, HU Yuanliang, et al. Sulfated modification of epimedium polysaccharide and effects of the modifiers on cellular infectivity of IBDV[J]. Carbohydrate Polymers, 2008, 71(2): 180-186.
[14] WANG Junlong, GUO Hongyun, ZHANG Ji, et al. Sulfated modification, characterization and structure-antioxidant relationships of Artemisia sphaerocephala polysaccharides[J]. Carbohydrate Polymers, 2010, 81(4): 897-905.
[15] 王顺春, 方积年. 香菇多糖硫酸化衍生物的制备及其结构分析[J].生物化学与生物物理学报, 1999, 31(5): 594-597.
[16] 黄小燕, 孔祥峰, 王德云, 等. 多糖硫酸化修饰和多糖硫酸酯的研究进展[J]. 天然产物研究与开发, 2007, 19(2): 328-332.
[17] 陶咏真, 张俐娜, 韩露, 等. 水溶性高支化多糖及硫酸酯衍生物抗癌活性研究[J]. 高分子学报, 2009(9): 852-859.
[18] 史宝军, 聂小华, 许泓渝, 等. 灰树花多糖硫酸酯的制备及其抗肿瘤活性[J]. 中国医药工业杂志, 2003, 34(8): 383-385.
[19] GABORIEAUM, CASTIGNOLLES P. Size-exclusion chromatography (SEC) of branched polymers and polysaccharides[J].Analytical and Bioanalytical Chemistry, 2011, 399(4): 1413-1423.
[20] 张丽萍, 张翼伸. 硫酸化对金顶侧耳多糖构象及生物活性的影响[J].生物化学与生物物理学报, 1994, 26(4): 417-421.

