槲皮素对人卵巢癌SKOV-3细胞增殖的影响*
邓晓慧, 宋海岩, 孙春莉
(新乡医学院人体解剖学教研室,河南 新乡 453003)
槲皮素对人卵巢癌SKOV-3细胞增殖的影响*
邓晓慧△, 宋海岩, 孙春莉
(新乡医学院人体解剖学教研室,河南 新乡 453003)
目的探讨槲皮素对人卵巢癌SKOV-3细胞增殖抑制和凋亡的影响,为卵巢癌临床治疗提供依据。方法不同浓度槲皮素处理卵巢癌SKOV-3细胞后,采用MTT实验检测细胞增殖抑制作用并计算抑制率,细胞免疫化学染色法鉴定细胞凋亡,流式细胞术检测细胞周期及细胞凋亡。结果槲皮素能够抑制SKOV-3细胞的增殖,且呈时间和剂量依赖性,免疫荧光显示槲皮素对SKOV-3细胞具有诱导凋亡作用,流式细胞术显示SKOV-3细胞被阻滞在S期, G2/M期细胞比例降低,凋亡率上升。结论槲皮素在体外能够抑制卵巢癌SKOV-3细胞的增殖,阻止细胞由S期向G2期移行,促进其凋亡。
细胞凋亡; 卵巢肿瘤; 槲皮素
卵巢癌是女性生殖器官常见的肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而位居第3位,但因卵巢癌死亡率占各类妇科肿瘤的首位[1],对妇女生命造成严重威胁。目前治疗卵巢癌的化疗药物不仅对肿瘤细胞具有杀伤力,对正常细胞的副作用也非常大,故寻找有效的化疗药物是当务之急。槲皮素(quercetin,Que)是黄酮类化合物的一种,在自然界广泛存在于水果、蔬菜以及植物中[2-3]。近年来槲皮素在抑制肿瘤细胞生长及防止恶性转移方面的研究表明槲皮素有望应用到临床抗肿瘤的治疗,它可以通过诱导肿瘤细胞凋亡或者是通过阻止细胞周期中某个环节来抑制癌细胞增殖[4-6]。我们前期实验发现槲皮素对胃癌、食管癌有抑制增殖作用,但是槲皮素对卵巢癌这方面的效果需进一步探讨,本文通过体外抗瘤实验为药物应用提供依据。
材 料 和 方 法
1材料
人卵巢癌SKOV-3细胞购于中国医学科学院肿瘤细胞库。Que购于Sigma,用二甲基亚砜(DMSO)溶解后-20 ℃保存,实验时用RPMI-1640培养基稀释。MTT和DMSO 购于Sigma,Dulbecco’s modified Eagle medium(DMEM)购于Invitrogen,胎牛血清购于武汉博士德生物工程有限公司,细胞周期及细胞凋亡试剂盒、细胞凋亡-Hoechst试剂盒购于碧云天生物技术研究所。
2方法
2.1细胞培养 卵巢癌SKOV-3细胞培养于含10% 胎牛血清的DMEM培养基中,同时加入1%青霉素和链霉素,置于37 ℃、5%CO2、饱和湿度孵育箱中培养。
2.2细胞抑制率检测 采用MTT法检测细胞活性并计算细胞抑制率,将对数生长期的SKOV-3细胞置于96孔板中(5×103cells/well),培养24 h后换液,同时在培养基中加入浓度不同的槲皮素(0、0.12、0.23、0.47、0.94、1.88、3.725、7.5、15、30 g/L),每个浓度设3个孔,继续培养24 h、48 h后,加入MTT(5 g/L)各20 μL,4 h后,吸出培养液每孔加入DMSO 150 μL,振荡10 min,用酶标仪570 nm波长下测吸光度(A)。
2.3细胞凋亡率检测 用Annexin V-FITC/PI双染色法分析槲皮素诱导SKOV-3细胞凋亡作用,分别收集0、15、30 g/L槲皮素作用24 h后的贴壁细胞于10 mL离心管中,调制成单细胞悬液浓度为1×109cells/L,1 000 r/min 4 ℃离心5 min,弃上清液,PBS洗涤离心后,把细胞重悬于200 μL孵育缓冲液加入10 μL Annexin V-FITC/PI避光室温反应15 min,加入孵育缓冲液300 μL,用流式细胞仪检测。
2.4免疫荧光凋亡鉴定 按照Hoechst试剂盒操作步骤,将细胞置于6孔板培养24 h,加入槲皮素培养48 h,取出6孔板中的盖玻片,PBS洗涤后加入0.5 mL固定液固定10 min,PBS洗涤2遍各 3 min,加入0.5 mL Hoechst 33258 染色液,于摇床上染色5 min后PBS 洗涤2遍,每次3 min,抗荧光淬灭封片液封片,荧光显微镜下检测细胞核,计算细胞凋亡率,细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
2.5细胞周期检测 取对数生长期细胞接种在12孔板中培养24 h,分别加入槲皮素(浓度为30 g/L)和培养基,培养48 h后用胰酶消化离心,PBS洗涤制成单细胞悬液,冰乙醇4 ℃固定过夜,碘化丙啶(propidium iodide,PI)染色1 h后流式细胞仪检测。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0进行统计学分析,各组间差异用单因素方差分析(ANOVA)比较,两组比较用t检验,以P<0.05为差异有统计学意义。
结 果
1槲皮素对SKOV-3细胞增殖抑制作用
卵巢癌SKOV-3细胞在含有不同浓度(0.12~30 g/L)槲皮素培养基中分别培养24 h和48 h后, MTT结果显示,细胞的生长活性明显降低,增殖受到抑制,相同药物剂量随培养时间延长细胞活性相应降低,槲皮素30 g/L培养48 h后细胞活性最低,增殖抑制率最高达58.72%,抑制率呈现剂量、时间依赖性,见图1。
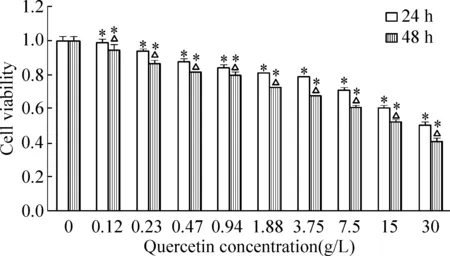
Figure 1. Effect of quercetin on the viability of SKOV-3 cells at 24 h and 48 h.Mean±SD.n=6.*P<0.05vs0 g/L;△P<0.05vs24 h.
图1槲皮素作用24h和48h对SKOV-3细胞活性的影响
2流式细胞术检测细胞凋亡
用Annexin V-FITC/PI双染色法检测槲皮素诱导SKOV-3细胞凋亡作用,正常细胞分布于分析图左下区,早期凋亡细胞分布于右下区,右上区为晚期凋亡细胞或死亡细胞,早、晚期凋亡率的和为总凋亡率。结果显示,15 g/L组的总凋亡率为(33.62±1.17)%,明显高于对照组[(7.13±0.92)%](P<0.01),30 g/L组的总凋亡率为(69.12±2.97)%,与低剂量组和对照组均有显著差异(P<0.01),见图2。
3细胞凋亡形态学结果
15 g/L组和30 g/L组与对照组相比凋亡数明显增多,凋亡率均高于正常对照组,差异显著(P<0.05),见图3。
4细胞周期结果
SKOV-3细胞用槲皮素作用48 h后,用流式细胞术对细胞周期进行分析,结果显示卵巢癌SKOV-3细胞被槲皮素处理后,细胞分裂周期中S期细胞比率明显增加, G2期细胞显著降低,减少至零,见图4,提示槲皮素主要使细胞大多停留在S期,导致凋亡。
讨 论
生物类黄酮由于其独特的生物特性, 近年来人们大量地从蔬菜水果中提取黄酮类化合物,据报道黄酮类化合物具有抗氧化、抗菌消炎、抗病毒、抗癌、预防癌症等作用[7-8]。近年来由于卵巢癌的高发病率以及高死亡率,迫切需要寻找一种有效的临床治疗方法。槲皮素为黄酮类的一种,研究发现它能够抑制结肠癌、胰腺癌、胃癌、膀胱癌以及乳腺癌等多种肿瘤细胞的增殖和诱导肿瘤细胞凋亡[9-11],本实验进一步探讨槲皮素对卵巢癌细胞的影响,旨在为槲皮素应用于卵巢癌的临床治疗提供实验依据。
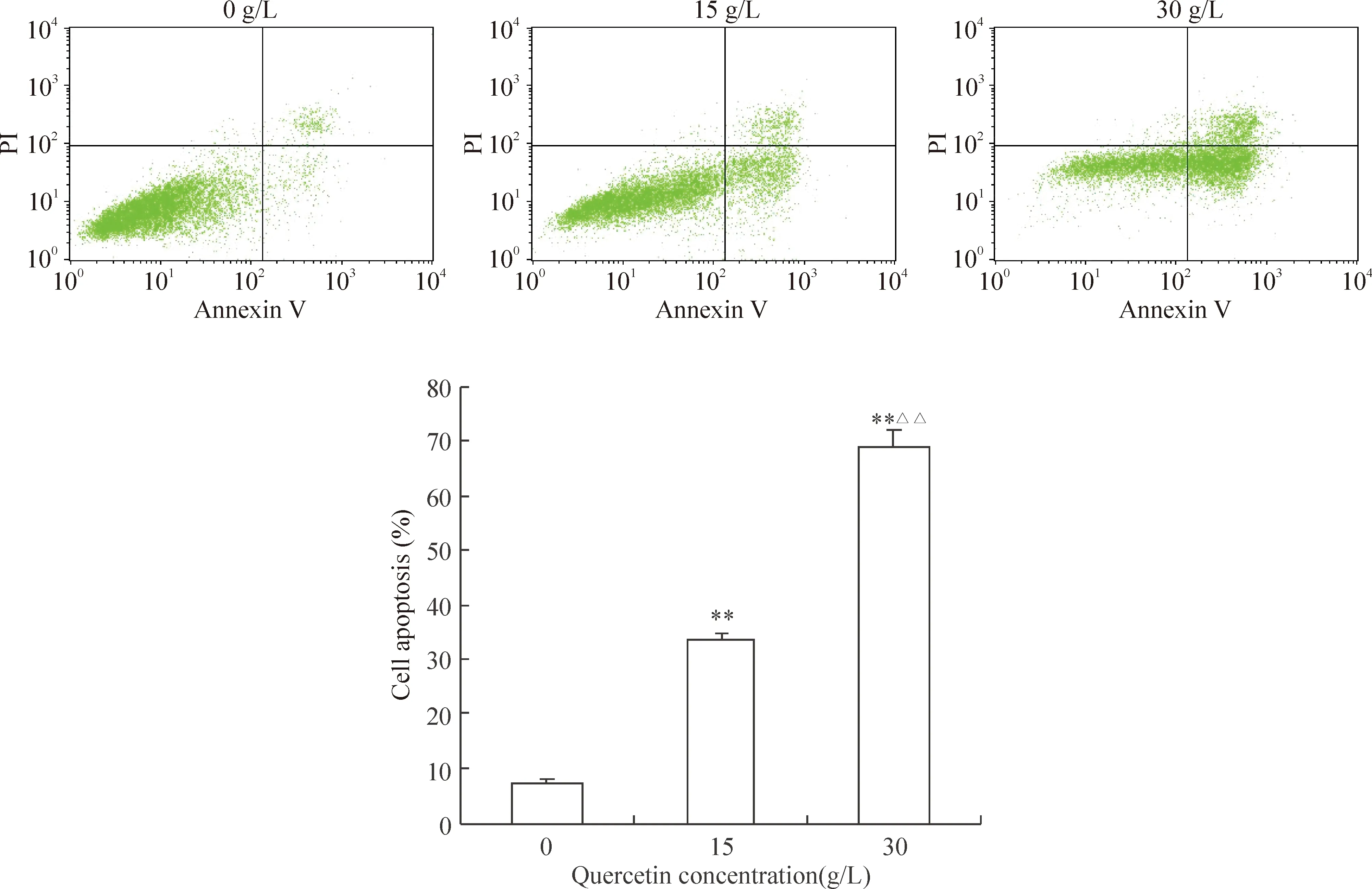
Figure 2. Detection of apoptosis of SKOV-3 cells by flow cytometry.Mean±SD.n=6.**P<0.01vs0 g/L;△△P<0.01vs15 g/L.
图2流式细胞术检测槲皮素对SKOV-3细胞凋亡的影响
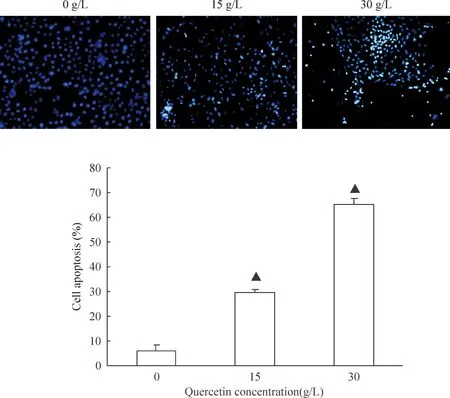
Figure 3. The results of Hoechst 33258 staining(×100).Mean±SD.n=6.▲P<0.05vs0 g/L.
图3各组细胞凋亡Hoechst33258染色结果
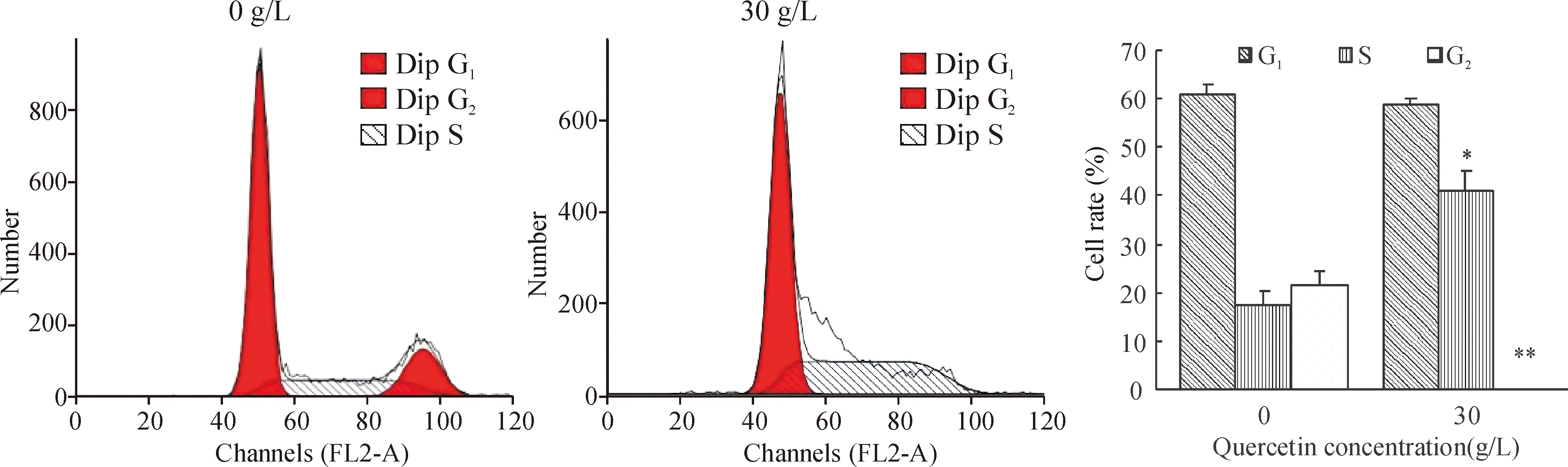
Figure 4. Effect of quercetin (0 g/L and 30 g/L) on the cell cycle of SKOV-3 cells.Mean±SD.*P<0.05,**P<0.01vs0 g/L.
图4槲皮素对SKOV-3细胞细胞周期的影响
本实验通过MTT检测不同剂量、不同作用时间的槲皮素对卵巢癌SKOV-3细胞生长活性的影响,结果显示槲皮素对卵巢癌细胞的生长活性具有抑制作用,其增殖抑制率与作用时间和剂量呈明显的相关性,随药物浓度增大,作用时间的延长,抑制率明显升高。流式细胞术分析细胞凋亡,SKOV-3细胞经过Annexin V-FITC/PI双染色,结果显示槲皮素对卵巢癌细胞有诱导凋亡作用,细胞凋亡率与剂量呈正相关性。Hoechst染色法在形态学上同时也验证了槲皮素能够诱导卵巢癌SKOV-3细胞凋亡。以上结果表明槲皮素能够抑制卵巢癌细胞增殖并诱导其凋亡。
凋亡在细胞坏死过程中起重要作用,在调控肿瘤细胞的增殖、肿瘤的形成和发展中起关键作用。本实验通过流式细胞术分析槲皮素抑制卵巢癌SKOV-3细胞增殖的可能机制。细胞周期结果显示,槲皮素作用后, S期细胞明显增加,G2/M期细胞相对减少,提示槲皮素主要使卵巢癌SKOV-3细胞在S期受到阻滞,阻止细胞向G2/M期移行,从而诱导凋亡,提示细胞周期阻滞为槲皮素抑制卵巢癌SKOV-3细胞生长、诱导凋亡的重要机制之一。
综上所述,槲皮素对卵巢癌SKOV-3细胞有抑制增殖和诱导凋亡的作用,但其详细的作用机制还有待进一步探讨研究,本实验仅仅从体外进行检测,若能在体内深入研究及进行相关临床实验,明确槲皮素对卵巢癌的作用机制,有望为卵巢癌的治疗方法提供实验依据,同时也有利于槲皮素相关新药的研发。
[1] Gilbert L,Basso O,Sampalis J,et al. Assessment of symptomatic women for early diagnosis of ovarian cancer: results from the prospective DOvE pilot project[J]. Lancet Oncol, 2012,3(13):285-291.
[2] Slusarz A, Shenouda NS, Sakla MS, et al. Common botanical compounds inhibit the Hedgehog signaling pathway in prostate cancer[J]. Cancer Res, 2010,70(8):3382-3390.
[3] Comalada M, Camuesco D , Sierra S, et al.Invivoquercitrin anti-inflammatory effect involves release of quercetin, which inhibits inflammation through down-regulation of the NF-κB pathway[J]. Eur J Immunol, 2005, 35(2):584-592.
[4] Ma L, Feugang JM, Konarske P, et al. Growth inhibitory effects of quercetin on bladder cancer cell[J]. Front Biosci,2006,11(9):2275-2285.
[5] Beniston RG, Campo MS. Quercetin elevates p27Kip1and arrests both primary and HPV16 E6/E7 transformed human keratinocytes in G1[J]. Oncogene, 2003, 22(35): 5504-5514.
[6] Yoshida M, Yamamoto M, Nikaido T. Quercetin arrests human leukemic T-cells in late G1phase of the cell cycle[J]. Cancer Res, 1992, 52(23): 6676-6681.
[7] 毕 伟,朱丽红,王传明, 等.槲皮素抑制鱼藤酮诱导的PC12细胞调亡[J].中国病理生理杂志,2011,27(1):82-85.
[8] Psahoulia FH, Drosopoulos KG, Doubravska L, et al.Quercetin enhances TRAIL-mediated apoptosis in colon cancer cells by inducing the accumulation of death receptors in lipid rafts[J]. Mol Cancer Ther, 2007, 6(9): 2591-2599.
[9] 王晓燕,张尤历,张 恒, 等.槲皮素对人胃癌细胞侵袭和MMP-2表达的影响[J].世界华人消化杂志,2012,20(3): 215-218.
[10]吕 蔡,张 杰.槲皮素的药理作用[J].国外医药:植物药分册,2005,20(3):108-112.
[11]Nguyen TT,Tran E,Nguyen TH,et al. The role of activated MEK-ERK pathway in quercetin induced growth inhibition and apoptosis in A549 lung cancer cells[J]. Carcinogenesis,2004,25(5):647-659.
EffectofquercetinonproliferationofhumanovariancancerSKOV-3cells
DENG Xiao-hui, SONG Hai-yan, SUN Chun-li
(DepartmentofHumanAnatomy,XinxiangMedicalUniversity,Xinxiang453003,China.E-mail:dengxhhappy@126.com)
AIM: To study the inhibitory effect of quercetin on the proliferation and apoptosis of human ovarian cancer SKOV-3 cells.METHODSSKOV-3 cells were treated with different doses of quercetin. The inhibitory effect of quercetin on the proliferation was detected by MTT assay. The cell apoptosis was determined by immunocytochemistry. The cell cycle and apoptosis were assessed by flow cytometry.RESULTSQuercetin inhibited the proliferation of ovarian cancer SKOV-3 cells in a time- and dose-dependent manner. Quercetin induced apoptosis of SKOV-3 cells. The proportion of S phase and the apoptotic rate were significantly increased, and the proportion of G2/M phase was reduced after treatment with quercetin.CONCLUSIONQuercetin inhibits the growth of ovarian cancer SKOV-3 cellsinvitro, and promotes apoptosis through S phase arrest.
Apoptosis; Ovarian neoplasms; Quercetin
R737.3
A
10.3969/j.issn.1000- 4718.2013.01.016
1000- 4718(2013)01- 0099- 04
2012- 10- 13
2012- 12- 12
新乡医学院高学历人才科研启动项目,2011新乡医学院重点领域招标课题(No.ZD2011-38)
△通讯作者 Tel:0373-3029051;E-mail:dengxhhappy@126.com

