Ghrelin对糖尿病大鼠下丘脑弓状核胃牵张敏感神经元放电活动及胃运动的调控*
徐 珞, 郭菲菲, 孙向荣, 高胜利, 公衍玲, 邱贝贝
(青岛大学医学院病理生理教研室,山东 青岛 266021)
Ghrelin对糖尿病大鼠下丘脑弓状核胃牵张敏感神经元放电活动及胃运动的调控*
徐 珞△, 郭菲菲, 孙向荣, 高胜利, 公衍玲, 邱贝贝
(青岛大学医学院病理生理教研室,山东 青岛 266021)
目的观察链脲佐菌素(STZ)所致糖尿病(DM)大鼠下丘脑弓状核(Arc)胃牵张(GD)敏感神经元放电活动及胃运动改变,探讨ghrelin对DM大鼠下丘脑Arc GD敏感神经元放电活动和胃运动的影响。方法采用STZ腹腔注射诱导DM大鼠模型;通过细胞外记录神经元单位放电和在体胃运动方法,观察ghrelin及其受体阻断剂[D-Lys3]-GHRP-6对DM大鼠下丘脑Arc GD敏感神经元自发放电活动和胃运动的影响;应用real-time PCR和荧光免疫组化方法,探讨DM大鼠Arc内ghrelin受体(GHS-R1a)mRNA及其免疫阳性物的表达。结果在正常大鼠Arc记录到的98个GD敏感神经元中,64.3%为GD兴奋性(GD-E)神经元,35.7%为GD抑制性(GD-I)神经元。在63个GD-E神经元中,Arc微量注射ghrelin可使其中73.0%神经元兴奋,其放电频率与生理盐水组比较显著增加(P<0.05);而在35个GD-I神经元中,Arc微量注射ghrelin可抑制其中60.0%神经元,放电频率显著降低(P<0.01);ghrelin改变GD神经元放电效应可被ghrelin 受体阻断剂[D-Lys3]-GHRP-6阻断(P<0.05);在DM大鼠,Arc记录到的66个GD敏感神经元中有56.1%为GD-E神经元,43.9%为GD-I神经元。Arc注射ghrelin可兴奋其中35.1%GD-E神经元,放电频率与生理盐水比较显著增加(P<0.05);而在29个GD-I神经元中,ghrelin可抑制其中21个神经元(72.4%),放电频率显著降低(P<0.01)。与正常大鼠比较,DM大鼠Arc GD敏感神经元中的GD-E和GD-I比例无显著改变(P>0.05),但ghrelin使GD-E神经元兴奋的比率明显降低(P<0.05),放电频率平均增加率也显著下降(P<0.05);但ghrelin使GD-I 神经元抑制比率和放电频率平均减少率均无显著改变(P>0.05)。在体胃运动研究结果显示,Arc微量注射ghrelin,可显著促进正常和DM大鼠胃运动,且呈显著量效关系(P<0.05,P<0.01),但ghrelin对正常大鼠的促胃运动作用显著强于其对DM大鼠的作用(P<0.05),[D-Lys3]-GHRP-6可完全阻断ghrelin该作用。Real-time PCR研究结果显示,DM大鼠下丘脑Arc GHS-R1a mRNA表达较正常大鼠明显减少(P<0.05);免疫荧光研究进一步证实DM大鼠下丘脑Arc GHS-R1a 免疫阳性物表达较正常大鼠明显减少(P<0.05)。结论下丘脑Arc ghrelin参与DM大鼠GD敏感神经元自发放电活动,并参与胃运动的调控,该效应可能是通过作用于ghrelin受体而实现的。
弓状核; 糖尿病; Ghrelin; 胃牵张敏感神经元; 胃运动; 大鼠
糖尿病(diabetes mellitus, DM)是由多种病因引起的以慢性高血糖为特征的代谢紊乱性疾病,已成为仅次于肿瘤、心脑血管疾病的严重威胁人类健康的世界第三大疾病。糖尿病胃轻瘫(diabetic gastro-paresis,DGP)是糖尿病并发症,近年来发病率逐年提高。研究资料显示,大约50%以上的糖尿病患者伴有胃轻瘫[1]。糖尿病胃排空障碍,发病机制十分复杂,目前尚未完全阐明,传统学说认为与多种因素有关,如高血糖及其导致的自主神经病变因素、饮食结构、遗传因素、肥胖因素等[1]。以往对糖尿病胃轻瘫的研究工作多集中在外周,如胃肠激素分泌异常、胃肠平滑肌变性、微血管病变等,近来中枢机制调控研究倍受关注。
Ghrelin是近年来发现的内源性生长激素促泌受体(growth hormone secretagogue receptor,GHS-R)的天然配体。1999年Kojima等[2]首次在大鼠及人的胃中分离了这一多肽。因其在促进生长素分泌,调节能量代谢过程和胃肠功能等多方面的重要作用[3],已成为当今研究热点之一。下丘脑是调控能量平衡的整合中枢[4],免疫组化研究显示,ghrelin在中枢神经系统主要分布于下丘脑弓状核(arcuate nucleus,Arc)[5],参与摄食及能量平衡调控[6]。本研究拟采用单神经元细胞外放电记录以及在体胃运动研究方法,观察ghrelin在Arc调控糖尿病大鼠胃的传入冲动以及对胃运动的影响,为ghrelin在能量代谢方面的作用提供新的理论和实验依据。
材 料 和 方 法
1动物及分组
实验采用健康成年雄性Wistar大鼠(由青岛市药检所提供)245只,体重250~350 g,置于室温25 ℃±2 ℃,12 h/12 h昼夜循环光照条件下生活,自由摄食、饮水。其中121只采用链脲佐霉素(streptozotocin,STZ)腹腔注射制作糖尿病大鼠模型,实验结束,糖尿病大鼠共有98只,其中53只用于观察细胞放电活动,35只用于观察胃运动改变,10只用于观察Arc ghrelin 及其mRNA表达。
2主要仪器及药品
MEZ8201型微电极放大器、VC-Ⅱ型双道记忆示波器和QC-111J型直方图分析仪均由日本光电公司生产。STZ和硫酸仲丁巴比妥购自Sigma。兔抗GHS-R1a多克隆抗体购自Chemicon;ghrelin购自American Peptide Company;GHS-R拮抗剂[D-Lys3]-GHRP-6由Anaspec提供。GHS-R1a引物(上游引物5’-GAGCCTAACGTCACGTTG-3’,下游引物5’-AGGCAGAAGACCGGTAGA-3’)和内参照β-actin 引物(上游引物5’-CTGCCGCATCCTCTrCCTC-3’,下游引物5’-CTCCTGCITGCTGATCCACAT-3’)由BenGCG软件设计和Gibco合成。
3糖尿病大鼠模型
健康9周龄雄性Wistar大鼠121只,体重250~350 g,置于室温25 ℃左右,12/12 h昼夜循环光照条件下生活,自由饮水。所有动物实验均符合《青岛大学实验动物保护和使用管理办法》。
参照Kirchner等[6]方法制作糖尿病病理模型。造模前先更换笼具,禁食(不禁水)12 h;造模组动物腹腔注射新鲜配制1% STZ液,注射剂量为35 mg/kg,第8 d再行第2次腹腔注射同等剂量1%STZ液,以注射相应剂量的0.1 mol/L柠檬酸缓冲液(1 mL/只)为对照组。各组大鼠尾尖采血测空腹血糖(fasting blood glucose,FBG), 筛选出FBG<16.7 mmol/L,同时伴有腹部胀大、体重减轻等胃轻瘫症状的大鼠98只。
4电生理实验
4.1动物手术 大鼠用硫酸仲丁巴比妥(100~150 mg/kg)经腹腔注射麻醉,颈部正中纵行切口,行气管插管术。胃部手术:腹部正中作纵行切口,经胃底部切口将胃内容物掏出,以温和生理盐水清洗。置入一个薄软胶气囊,经聚乙烯软管连至一个5 mL注射器,实验中注入生理盐水(3~5 mL,0.5 mL/s, 37 ℃)扩张胃,用以鉴别胃牵张敏感神经元,,缝合腹部。头部手术:头部正中切口,牙科钻颅骨钻孔,插入三管玻璃微电极至下丘脑Arc,定位参照Pa-xinos-Watson大鼠脑图谱(前囟后3.20 mm, LR: 0.40 mm, H: 9.80 mm),覆盖2%琼脂生理盐水与颅骨表面平齐,以保护脑皮层及作为颅骨表面定位标志;作小脑延髓池穿刺术引流以减少脑波动对微电极位置的影响。
4.2细胞外电记录 采用三管玻璃微电极 (尖端直径3~10 μm,阻抗5~15 MΩ),其中一管为记录电极,内充灌2.0%滂胺天蓝,另外两管分别充以1.5×10-8mol/L ghrelin、2.8×10-8mol/L [D-Lys3]-GHRP-6或生理盐水(NS)。通过监听器判断电极尖端进入空气与琼脂界面,用液压推进操纵器将微电极送至Arc区域内,鉴别胃牵张(gastric distension,GD)敏感神经元,以神经元放电频率的变化率超过20%作为神经元兴奋或抑制指标,神经元表现兴奋的确定为胃牵张兴奋型(GD-E)神经元,表现为抑制的确定为胃牵张抑制型(GD-I)神经元。观察细胞电信号与噪声比在3∶1以上,进行细胞外放电记录。信号经MEZ-8201型微电极放大器输入VC-11双道示波器,经SUMP-PC生物信号处理系统进行放电频率分析,并绘出序列密度直方图。
4.3组织学检查 每次实验结束后,微电泳滂胺天蓝入脑组织,以标记微电极所在位置;大鼠经心灌注固定,快速断头取脑,冰冻切片(50 μm),中性红染色,检查电极记录位置,位置不准确的资料不列入统计。
5胃运动记录
5.1下丘脑Arc埋置套管 术前动物禁食15~20 h,80 g/L水合氯醛(30 mg/kg)腹腔麻醉。参照Pa-xinos-Watson大鼠脑图谱,将自制不锈钢套管置入右侧Arc (AP: 2.12~4.30 mm, LR: 0.20~0.50 mm, H: 9.80~10.30 mm),将一小螺丝钉固定于颅骨表面,用502胶和自凝牙托粉固定套管,并置入不锈钢内芯防止阻塞。实验结束后,经套管注射1 μL滂胺天蓝,灌注固定,断头取脑,50 μm系列冠状切片,对照图谱观察套管尖端的定位,位置不准确者不计入统计。
5.2应力传感器(应变片)植入术 术前动物禁食15~20 h,硫酸仲丁巴比妥腹腔注射麻醉(100~150 mg/kg)。距幽门十二指肠连接处0.5 cm,将记录胃平滑肌收缩运动的应力传感器缝贴于胃窦浆膜面,导线经皮下隧道引至颈后,穿出体外。术后2 d待动物恢复正常饮食,无任何疼痛和应激反应,即可进行实验。
5.3胃运动记录 动物禁食15~20 h,自由饮水。实验时,将大鼠置于特制鼠笼内适应环境1 h。用RM-46胃运动记录仪连续描记胃运动曲线。以注射前测定胃运动幅度或频率值为正常值,注射后不同时点观察胃运动幅度和频率的变化。
6Real-timePCR
6.1总RNA的提取和单链cDNA(ss-cDNA)的合成 糖尿病和正常大鼠各5只,20%乌拉坦(1 g/kg)经腹腔麻醉,快速断头取脑,冰冻切片(200 μm),显微镜下参照Paxinos-Watson大鼠脑图谱Arc定位及毛细管打孔取样,迅速加入1 mL 冰冷Trizol匀浆。用Trizol reagent常规方法提取总RNA,紫外分光光度计测A值,A260/280比值为1.9~2.2。取总RNA 3 μL(1 g/L),引物 Oligo-(dT)161 μL(10 nmol/L),10×RT缓冲液2 μL,dNTPs 2.5 mmol/L 4 μL,RNase抑制剂1 μL,AMV逆转录酶 1 μL,至反应总体积为20 μL。反应条件:42 ℃ 1 h;95 ℃ 5 min。
6.2Real-time PCR 取1 μL ss-cDNA 产物作为待测样本。所有的待测样本均一式两份, 分别对GHS-R1a和看家基因β-actin进行扩增, 扩增反应用SYBR Green I定量PCR试剂盒(TaKaRa)和5700型定量PCR仪完成。扩增条件:94 ℃ 1 min; 94℃ 30 s,53 ℃ 15 s, 72 ℃ 15 s, 40个循环。 随之观察该PCR产物的熔解曲线(94 ℃ 0 s,55 ℃ 15 s,94 ℃ 0 s;温度变化速度为0.1 ℃/s),并由电脑自动分析系统进行定量分析。以不含ss-cDNA 模板的PCR 反应体系设为阴性对照。
7荧光免疫组化研究
糖尿病和正常大鼠各5只,20%乌拉坦(1 g/kg)经腹腔麻醉,灌注固定,断头取脑,显微镜下参照Paxinos-Watson大鼠脑图谱行冰冻切片(20 μm)。切片经4%正常羊血清/0.5% Triton X-100/PBS孵育2 h,与兔抗GHS-R1a(1∶300稀释)抗体孵育,4 ℃过夜。加入异硫氰酸荧光素(FITC)交联的羊抗兔IgG(1∶50稀释),置于黑暗湿盒内孵育2 h(避光),0.01 mol/L PBS冲洗,甘油/PBS封片剂封片,激光共聚焦显微镜下观察免疫阳性细胞。以正常羊血清代替Ⅰ抗为阴性对照,其它步骤同前。
8统计学处理
计量资料均用均数±标准差(mean±SD)表示。各组神经元放电活动以配对t检验进行同一细胞给药前后放电频率差别比较,两组或多组实验数据用非配对t检验和One-way ANOVA;real-time PCR结果分析采用ΔCt值表示[8][检测待测基因cDNA进入PCR指数增长期的起始点即循环阈值(cycle thres-hold, Ct)],以同一样本中GHS-R1a和看家基因β-actin之间的Ct差值(即ΔCt=CtGHS-R1a- Ctβ-actin)进行组间资料的t检验(Prism 3.0 统计软件)。以P<0.05为差异有统计学意义。
结 果
1Ghrelin对正常大鼠下丘脑Arc内GD敏感神经元放电活动的影响
在79只正常大鼠Arc记录到98个神经元单位放电,胃扩张刺激可兴奋其中的63个神经元 (63/98, 64.3%),神经元的平均放电频率由(2.15±0.33) Hz增加至(3.71±0.54) Hz (P<0.01),鉴定为GD-E神经元;另外有35个神经元对GD刺激表现为抑制反应(35/98, 35.7%),神经元的平均放电频率由(1.24±0.19)Hz下降至(0.52±0.14)Hz (P<0.01),鉴定为GD-I神经元。
在63个GD-E神经元中,微量注射ghrelin可兴奋其中46个神经元(46/63, 73.0%),放电频率由(2.13±0.46) Hz增加至(2.71±0.54) Hz(P<0.01),平均增加27.2%±5.8%,与生理盐水(NS)组相比其放电频率显著增加(18.2%±6.1%,P<0.05);另外有14个神经元的放电频率无明显变化,有3个神经元在给予ghrelin后出现抑制反应。GD-E神经元给予ghrelin受体阻断剂[D-Lys3]-GHRP-6和ghrelin混合液后, 其兴奋反应不再出现。
在35个GD-I神经元中,Arc微量注射ghrelin可抑制其中21个神经元(21/35,60.0%),放电频率由(1.41±0.40) Hz下降至(0.92±0.29) Hz,平均减少53.3%±8.9%(P<0.01)与NS组相比(16.5%±4.1%)差别有统计学意义(P<0.01);另外有11个神经元的放电频率无明显变化,有3个神经元出现兴奋反应。同样,GD-I神经元给予ghrelin受体阻断剂[D-Lys3]-GHRP-6和ghrelin混合液后, 其抑制效应不再出现。
2Ghrelin对糖尿病大鼠下丘脑Arc内GD敏感神经元放电活动的影响
在53只糖尿病大鼠Arc记录到66个神经元单位放电,胃扩张刺激可兴奋其中的37个神经元 (37/66, 56.1%),神经元的平均放电频率由(2.31±0.78) Hz增加至(3.92±1.02) Hz (P<0.01); 另外有29个神经元对GD刺激表现为抑制反应(29/66, 43.9%),神经元的平均放电频率由(1.33±0.41)Hz下降至(0.61±0.23)Hz (P<0.01)。与正常大鼠比较,糖尿病大鼠Arc内GD-E和GD-I神经元的放电频率,以及GD-E和GD-I神经元在总GD敏感神经元中所占比例均无显著差异(P>0.05)。
Arc微量注射ghrelin,可使35.1%的GD-E神经元兴奋(13/37),放电频率由(1.98±0.35)Hz增加至(2.45±0.61) Hz(P<0.05),平均增加23.7%±4.3%,与NS组(11.1%±3.0%)相比差别有统计学意义(P<0.01)。给予ghrelin受体阻断剂[D-Lys3]-GHRP-6和ghrelin混合液, ghrelin的兴奋反应不再出现,见图1A。与正常大鼠比较,ghrelin使DM大鼠GD-E神经元兴奋的比率明显降低(35.1%vs73.0%,P<0.05),放电频率平均增加率也显著下降(23.7%±4.3%vs27.2%±5.8%,P<0.05)。
在29个GD-I神经元中,Arc微量注射ghrelin可使72.4%的GD-I神经元抑制(21/29),放电频率由(1.26±0.42) Hz下降至(0.82±0.29) Hz,平均减少53.7%±8.7%(P<0.01),与NS组(4.7%±1.1%)相比差别有统计学意义(P<0.01);给予ghrelin受体阻断剂[D-Lys3]-GHRP-6和ghrelin混合液, ghrelin抑制反应不再出现,见图1B。但与正常大鼠比较,ghrelin使DM大鼠GD-I 神经元抑制比率(72.4%vs60.0%,P>0.05)和放电频率减少率均无显著改变(53.7%±8.7%vs53.3%±8.9%,P>0.05)。
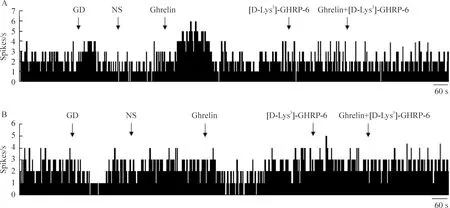
Figure 1. Effects of ghrelin on firing activity of gastric distension (GD)-sensitive neurons in arcuate nucleus of hypothalamus in diabetes rats.A:GD-excitatory neurons;B:GD-inhibitory neurons.
图1Ghrelin对糖尿病大鼠Arc胃牵张敏感神经元放电活动的影响
3弓状核注射ghrelin对糖尿病大鼠胃运动的影响
在体胃运动研究结果显示,与正常大鼠比较,糖尿病大鼠胃运动明显减弱,表现为胃运动幅度[(8.14±1.58)g/minvs(2.21±0.89)g/min,P<0.05]和频率[(5.18±0.61) Hzvs(1.81±0.23) Hz,P<0.05]显著降低,见图2、3。
正常大鼠下丘脑Arc微量注射不同剂量ghrelin(0.05 nmol和0.5 nmol),胃运动幅度在注射后3 min已有增加,13 min时变化最为明显,与NS组[(8.01±1.77) g]比较有显著差异[(14.60±2.20)g,P<0.05;(22.28±4.10)g,P<0.01],且呈显著量效依赖关系;Arc分别注射0.05和0.5 nmol ghrelin,与NS组[(1.81±0.23)Hz]比较,13 min时胃运动频率也显著加快[(7.45±0.87)Hz,P<0.05;(10.98±1.03)Hz,P<0.01], 且呈显著量效依赖关系。给予ghrelin受体阻断剂[D-Lys3]-GHRP-6和ghrelin混合液, 胃运动加强作用不再出现(P>0.05),见图3。
在DM大鼠,下丘脑Arc微量注射0.05 nmol ghrelin,胃运动幅度和频率有增加趋势,但与NS组相比无显著差异(P>0.05); 而注射0.5 nmol ghrelin,大鼠胃运动显著增强,表现为胃运动幅度明显增加(P<0.05),收缩频率明显加快(P<0.05)。而给予 [D-Lys-3]-GHRP-6和ghrelin混合液, 胃运动幅度和频率增加作用消失(P>0.05),见图3。
4糖尿病大鼠下丘脑ArcGHS-R1a表达
荧光免疫组化研究显示,在正常和DM大鼠下丘脑Arc中均有GHS-R1a免疫阳性细胞表达,但DM大鼠Arc GHS-R1a表达明显降低[(10.0±2.1)/mm2vs(3.0±0.70)/mm2,P<0.05]。
Real-time PCR研究结果显示,糖尿病大鼠下丘脑Arc GHS-R1a mRNA表达较正常对照组大鼠明显减少,表现为达循环阈值的循环次数明显增加(9.22±2.45vs14.11±4.01,P<0.05),见图4。
讨 论
随着经济社会的发展,人们的饮食结构、生活方式等发生了很大改变,糖尿病发病率显著上升,尤其II型糖尿病(T2DM)占了较高比例(占糖尿病发病率的90%~95%)[7]。T2DM是因人体胰岛素分泌相对不足或靶细胞对胰岛素敏感性降低继而引发糖、蛋白质、脂肪和水电解质等代谢紊乱所导致的疾病,并伴有多种并发症,如胃肠运动障碍[8-9]、神经变性等[10]。
糖尿病胃运动功能障碍是糖尿病常见的一种慢性并发症,10年以上患者胃神经肌肉功能异常发生率高达30%~50%[8],其主要特点是胃动力下降、排空迟缓,从而导致胃潴留。糖尿病胃动力障碍的发病机制目前仍不十分清楚,目前认为可能与神经病变、平滑肌变性、高血糖等因素有关[10-12]。
Ghrelin最初在大鼠胃中被发现,是GHS-R的内源性配体[2]。现有报道,ghrelin仅为GHS-R1a的天然配体[12]。Ghrelin可由中枢神经系统和外周组织释放。免疫组化研究显示,ghrelin样免疫活性神经元在中枢系统主要分布于摄食相关脑区,尤其是在下丘脑[4-5,13-15],如弓状核、背内侧核(DMH)、腹内侧(VMH)、外侧下丘脑(LH)和室旁核(PVN),在垂体、脑干、小脑及纹状体中也有分布[16]。Ghrelin主要参与胃运动的调控,而且与能量代谢密切相关[17]。近年有文献报道,ghrelin与GHS-R在人及鼠胰腺中也有表达[18],可能与胰腺内分泌功能密切相关。本研究发现,ghrelin可促进下丘脑Arc胃牵张敏感神经元放电活动和胃运动,该作用可被ghrelin受体特异性阻断剂[D-Lys3]-GHRP-6消褪,提示Arc ghrelin可能参与胃肠传入冲动信号的调控,并通过下行调控胃肠运动,该作用可能是通过激活其受体而实现的。同时本研究发现,与正常大鼠比较,糖尿病大鼠Arc内GD-E和GD-I神经元的放电频率,以及GD-E和GD-I神经元在总GD神经元中所占比例无显著差异,但糖尿病大鼠ghrelin促Arc胃牵张反应神经元放电作用较正常大鼠明显减弱,表现为ghrelin使GD-E神经元兴奋的比率明显降低,放电频率平均增加率也显著减少;且ghrelin促进胃运动作用明显低于正常大鼠,提示,糖尿病胃运动障碍可能与下丘脑Arc内ghrelin能神经元功能活动降低有关。
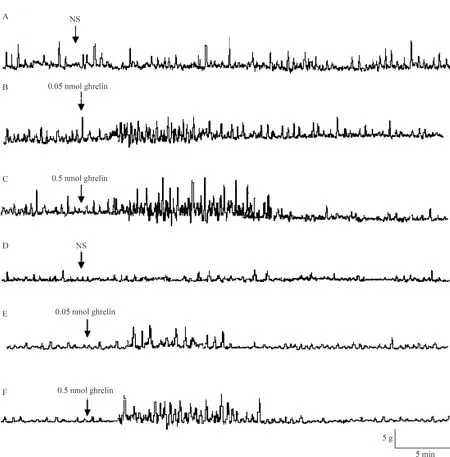
Figure 2. Effects of ghrelin injected in arcuate nucleus of hypothalamus on gastric motility.A~C:normal rats;D~F: diabetic rats.
图2下丘脑Arc微量注射ghrelin对胃运动的影响
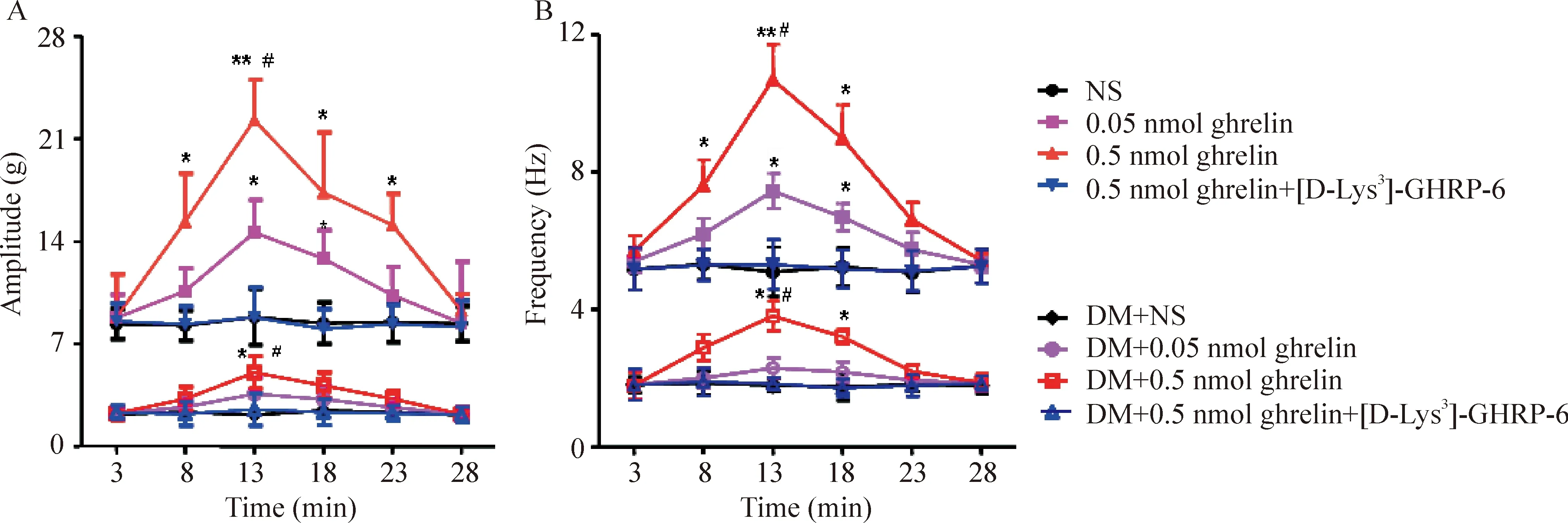
Figure 3. Effects of ghrelin injected in arcuate nucleus of hypothalamus on the amplitude (A) and frequency (B) of gastric motility.
图3下丘脑Arc微量注射ghrelin对胃运动幅度和频率变化的影响
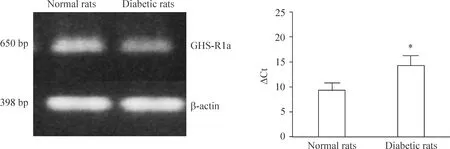
Figure 4. The expression of GHS-R1a mRNA in arcuate nucleus of hypothalamus.
图4下丘脑ArcGHS-R1amRNA表达
有文献报道,ghrelin与胰岛素间存在明显负相关,胰岛素在ghrelin的合成中有抑制作用[19-20]。在健康志愿者中可观察到,当胰岛素<600 ppmol时,胰岛素的上升对ghrelin没有影响,但当>600 ppmol时,无论是否伴有高血糖,均可观察到胰岛素上升可使循环ghrelin的浓度下降。本研究发现,糖尿病大鼠下丘脑Arc ghrelin受体及其mRNA表达较正常大鼠均明显减少,提示糖尿病大鼠胃肠运动障碍可能也与ghrelin受体表达减少有关。但ghrelin在糖尿病大鼠Arc作用的减弱机制还有待于进一步深入探讨。
[1] Abrahamsson H. Gastrointestinal motility disorders in patients with diabetes mellitus[J]. J Intern Med, 1995,237(4):403-409.
[2] Kojima M, Hosoda H, Date Y. Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J]. Nature, 1999,402(6762):656-660.
[3] Sato T, Nakamura Y, Shiimura Y, et al. Structure, regulation and function of ghrelin[J]. J Biochem, 2012,151(2):119-128.
[4] 赵玉红,吴丽霞,关 心,等. 营养性肥胖大鼠的脂代谢紊乱与下丘脑中增食欲素A的表达分析[J].中国病理生理杂志,2011,27(5):1000-1002.
[5] Guan JL, Wang QP, Kageyama H, et al. Synaptic interactions between ghrelin- and neuropeptide Y-containing neurons in the rat arcuate nucleus[J]. Peptides, 2003,24(12):1921-1928.
[6] Kirchner H, Heppner KM, Tschöp MH. The role of ghrelin in the control of energy balance[J]. Handb Exp Pharmacol, 2012,209:161-184.
[7] Jendle J, Martin SA, Milicevic Z. Insulin and GLP-1 analog combinations in type 2 diabetes mellitus: a critical review[J]. Expert Opin Investig Drugs, 2012,21(10):1463-1474.
[8] Hu W, Feng P. Myosin light chain kinase is involved in the mechanism of gastrointestinal dysfunction in diabetic rats[J]. Dig Dis Sci, 2012,57(5):1197-1202.
[9] Ma J, Rayner CK, Jones KL, et al. Insulin secretion in healthy subjects and patients with Type 2 diabetes:role of the gastrointestinal tract[J]. Best Pract Res Clin Endocrinol Metab, 2009,23(4):413-424.
[10]Barber AJ, Gardner TW, Abcouwer SF. The significance of vascular and neural apoptosis to the pathology of diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2011,52(2):1156-1163.
[11]Hejazi RA, McCallum RW, Sarosiek I. Prokinetics in diabetic gastroparesis[J]. Curr Gastroenterol Rep, 2012,14(4):297-305.
[12]龙启成,桂 春,朱立光,等. Neuregulin-1在糖尿病大鼠心肌组织中的表达变化[J].中国病理生理杂志, 2012,28(4):1-5.
[13]Broglio F, Papotti M, Muccioli G, et al. Brain-gut communication: cortistatin, somatostatin and ghrelin. Trends Endocrinol Metab, 2007,18(6):246-251.
[14]Davenport AP, Bonner TI, Foord SM,et al. International Union of Pharmacology. LVI. Ghrelin receptor nomenclature, distribution, and function[J]. Pharmacol Rev, 2005,57(4):541-546.
[15]De Ambrogi M, Volpe S, Tamanini C. Ghrelin: central and peripheral effects of a novel peptydil hormone[J]. Med Sci Monit, 2003,9(9):RA217-RA224.
[16]Granado M, García-Cáceres C, Tuda M, et al. Insulin and growth hormone-releasing peptide-6 (GHRP-6) have differential beneficial effects on cell turnover in the pituitary, hypothalamus and cerebellum of streptozotocin (STZ)-induced diabetic rats[J]. Mol Cell Endocrinol, 2011,337(1-2):101-113.
[17]Gasco V, Beccuti G, Marotta F, et al. Endocrine and metabolic actions of ghrelin[J]. Endocr Dev, 2010,17:86-95.
[19]Ukkola O. Ghrelin in Type 2 diabetes mellitus and metabolic syndrome[J]. Mol Cell Endocrinol, 2011,340(1):26-28.
[20]Somogyi V, Gyorffy A, Scalise TJ, et al. Endocrine factors in the hypothalamic regulation of food intake in females: a review of the physiological roles and interactions of ghrelin, leptin, thyroid hormones, oestrogen and insulin. Nutr Res Rev, 2011,22:1-23.
Effectsofghrelinonfiringactivityofgastricdistension-sensitiveneuronsinhypothalamicarcuatusnucleusandgastricmotilityindiabeticrats
XU Luo, GUO Fei-fei, SUN Xiang-rong, GAO Sheng-li, GONG Yan-ling, QIU Bei-bei
(DepartmentofPathophysiology,QingdaoUniversityMedicalCollege,Qingdao266021,China.E-mail:xu.luo@163.com)
AIM: To study the roles of ghrelin in the regulation of gastric distension (GD)-sensitive neurons in the hypothalamic arcuate nucleus (Arc) and gastric motility in diabetes mellitus (DM) rats.METHODSDM rat model was made by intraperitoneal injection of streptozotocin. The effects of ghrelin and [D-Lys3]-GHRP-6 on GD-sensitive neurons in the Arc of DM rats were observed by recording the extracellular potentials of single neurons, and the gastric motility was also monitoredinvivo. The expression of ghrelin receptor,growth hormone secretagogue receptor (GHS-R), in Arc was studied by real-time PCR and immunofluorescene method.RESULTS(1) Ninety-eight GD-sensitivity neurons were recorded in the Arc of normal rats, in which 64.3% were classified as GD-excitatory (GD-E) neurons and 35.7% were GD-inhibitory (GD-I) neurons. Microinjection of ghrelin excited 73.0% of the 63 GD-E neurons and the discharge frequency significantly increased as compared with the neurons treated with saline. Ghrelin inhibited 60.0% of the 35 GD-I neurons and the discharge frequency was significantly reduced (P<0.01). The effect of ghrelin was blocked by the antagonist of ghrelin [D-Lys3]-GHRP-6. (2) Sixty-six GD-sensitive neurons were recorded in the Arc of diabetes rats, in which 64.3% were GD-E neurons, and 35.7% were GD-I neurons. Microinjection of ghrelin excited 35.1% of the GD-E neurons and the discharge frequency significantly increased as compared with the neurons treated with saline. Ghrelin inhibited 21 of the 29 GD-I neurons (72.4%) and the discharge frequency was significantly reduced. Compared with normal control group, the ratio of GD-E and GD-I neurons in diabetic rat Arc GD-sensitive neurons was not significantly changed. However, the ratio of GD-E neurons treated with ghrelin was significantly decreased, and the average increase rate of discharge frequency was significantly decreased. Ghrelin did not change GD-I neurons rejection ratio and discharge frequency average reduction rate. (3) Microinjection of ghrelin into the Arc significantly promoted gastric motility in normal and DM rats, and a significant dose-dependent manner was observed. However, the promotion effect of ghrelin on gastric motility in normal rats was stronger than that in DM rats, and the effect was completely blocked by [D-Lys3]-GHRP-6. (4) The mRNA expression of GHS-R1a in the hypothalamic Arc of diabetic rats significantly reduced as compared with the normal control rats. The protein level of GHS-R1a in the hypothalamic Arc was also significantly reduced in DM rats.CONCLUSIONGhrelin regulates the activity of GD-sensitive neurons in hippocampus Arc of diabetic rats by the action on ghrelin receptor.
Arcuatus nucleus; Diabetes mellitus; Ghrelin; Gastric distension-sensitive neurons; Gastric motility; Rats
R338.2
A
10.3969/j.issn.1000-4718.2013.01.005
1000- 4718(2013)01- 0028- 08
2012- 07- 23
2012- 10- 25
国家自然科学基金资助项目(No.30470642;No.30670780;No.31071014;No.81100260;No. 81270460);山东省科技攻关项目(No.2008GG10002006); 山东省卫生厅项目(No.2007HZ026);青岛市科技局项目[No.11-2-3-3-(2)-nsh]
△通讯作者 Tel: 0532-82991713; E-mail: xu.luo@163.com

