短链酰基辅酶A脱氢酶在大鼠心脏发育中的表达及其与心肌肥厚的关系*
周四桂, 王 平, 路 遥, 袁 茜, 臧林泉, 杨智承, 徐立朋
( 1广东药学院临床药学系,广东 广州 510006;2暨南大学药学院新药研究所,广东 广州 510632;3深圳市药品检验所, 广东 深圳 518029; 4中山大学中山医学院临床医学八年制2007级,广东 广州 510080)
短链酰基辅酶A脱氢酶在大鼠心脏发育中的表达及其与心肌肥厚的关系*
周四桂1, 王 平3, 路 遥4, 袁 茜4, 臧林泉1, 杨智承1, 徐立朋2△
(1广东药学院临床药学系,广东 广州 510006;2暨南大学药学院新药研究所,广东 广州 510632;3深圳市药品检验所, 广东 深圳 518029;4中山大学中山医学院临床医学八年制2007级,广东 广州 510080)
目的研究大鼠心脏发育过程中短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase, SCAD)的表达变化规律,并探讨其与高血压大鼠心肌肥厚的关系。方法观察不同时期Wistar大鼠和不同周龄自发性高血压大鼠心肌组织的SCAD蛋白表达及酶活性变化,检测大鼠的血清和心肌游离脂肪酸含量。结果与胚胎期19 d Wistar大鼠组比较,出生后1 d、2周、6周及16周龄Wistar大鼠组心肌的SCAD蛋白表达及酶活性增加,血清和心肌游离脂肪酸含量明显减少,二者之间呈负相关,其中,从2周龄Wistar大鼠组开始差异有统计学意义。与周龄匹配的WKY大鼠组比较,2周龄自发性高血压大鼠组收缩压尚未升高,6周龄及16周龄自发性高血压大鼠组收缩压显著增高;各时点自发性高血压大鼠组的左室重量指数均明显增高,提示自发性高血压大鼠在血压升高之前,已经发生了明显的心肌肥厚。与周龄匹配的WKY大鼠组比较,2周、6周及16周龄自发性高血压大鼠组心肌的SCAD蛋白表达及酶活性明显下降,血清和心肌游离脂肪酸含量明显增加,呈显著负相关。结论(1)SCAD蛋白表达随大鼠心脏的生长发育逐渐上调,可能与心脏对脂肪酸的利用增加密切相关。(2)SCAD的蛋白表达及其酶活性显著下降, 可能是导致自发性高血压大鼠肥厚心肌能量代谢“胚胎型再演”的分子基础。
短链酰基辅酶A脱氢酶; 心脏发育; 脂肪酸氧化; 心肌肥厚
哺乳动物胚胎期心脏主要以葡萄糖和乳酸作为能源,出生后则为以脂肪酸氧化为主;但在病理性心肌肥厚时脂肪酸氧化降低,糖酵解增加,心肌能量代谢发生“胚胎型转换”[1-3]。虽然葡萄糖氧化耗氧量少,但其产生的能量远低于脂肪酸氧化,终将导致心肌能源的匮乏。探讨这一转换的发生机制, 对阻遏心力衰竭病理生理的恶性循环具有重要意义。生理情况下,进入线粒体的酰基辅酶A在相应的脱氢酶作用下脱氢,开始脂肪酸β氧化循环,从而产生大量能量,供给心肌需要[4-5]。短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase, SCAD)是酰基辅酶A 脱氢酶家族中的一员,特异性地分解短链酰基辅酶A底物,是脂肪酸β氧化的第一个限速步骤, 是脂肪酸氧化的关键酶[6]。我们采用差异凝胶电泳(difference gel electrophoresis, DIGE)技术比较了16周龄自发性高血压大鼠(spontaneously hypertensive rats, SHR)和血压正常大鼠的心肌蛋白质组,首次发现SCAD在SHR肥厚心肌中的表达显著降低[7]。本研究从大鼠心脏不同发育阶段观察心脏SCAD的表达及其酶活性变化,并进一步采用不同周龄的SHR进行验证,从而探讨SCAD在心肌肥厚中的可能作用。
材 料 和 方 法
1材料
1.1主要试剂 游离脂肪酸测定试剂盒购自南京建成生物研究所;丁酰辅酶A购自Promega;电子转移黄素蛋白购自Sigma;α-tubulin 抗体(T6074) 购自Sigma;SCAD抗体(3539-100) 购自Biovision。
1.2动物 健康雄性10周龄Wistar大鼠25只,雌性10周龄Wistar大鼠50只,用于大鼠交配。健康雄性2周、6周及16周龄Wistar大鼠各8只,以上动物均购于广东省医学实验动物中心。健康雄性2周、6周及16周龄WKY大鼠和SHR各8只,购于上海斯莱克实验动物有限公司,用于心肌肥厚的实验研究。大鼠按常规方法交配获取孕鼠, 清晨见脱落阴栓视为胚胎0 d,出生当天视为出生1 d。胚胎期19 d时,在乙醚麻醉下切开孕鼠腹壁剖宫取出胎鼠,共取32只,断头取全血后,于解剖显微镜下分离出胚胎心脏,将同一时点4只胎鼠的样本合并。16只出生后1 d的新生鼠断头取全血后,取出心脏分离出心室,将同一时点2只新生鼠的样本合并,以上合并的样本均用于检测SCAD的蛋白表达、酶活性及游离脂肪酸的含量。2周、6周及16周龄大鼠的心脏取出后,分离出左心室,用于后续实验研究。
2方法
2.1大鼠收缩压及左室重量指数的测定 采用NIBP的无创血压心率测定仪,连续测量3次, 每次间隔约1 min, 以其均值作为收缩压。腹腔注射3%戊巴比妥钠(45 mg/kg)麻醉大鼠,迅速打开胸腔,用预冷的生理盐水充分灌注,取出心脏,滤纸吸干,电子天平称取心脏重量。沿房室环剪去大血管、心房及右室游离壁,将余下的室间隔、左心室游离壁作为左心室重量。左心室重量与体重的比值作为左室重量指数。用于病理检测的心脏经生理盐水灌注后,继续灌以4%多聚甲醛(pH 7.4),并置于4%多聚甲醛中固定。用于SCAD蛋白及酶活性检测的心脏立即置于液氮中保存。
2.2血清和心肌游离脂肪酸的含量测定 生理盐水灌注大鼠后,开腹暴露门静脉,立即用10 mL注射器从门静脉处穿刺取血,每只大鼠取血约5 mL。把注射器针头拔去后推针将血转移至干净玻璃离心管中。3 500 r/min离心10 min,小心收集血清并分装至EP管中,-80 ℃超低温冰箱保存血清。严格按照试剂盒说明书进行游离脂肪酸浓度的测定, 根据吸光率计算血清和心肌匀浆中游离脂肪酸的含量(单位: nmol/L)。
2.3SCAD活性的检测 心肌组织称重后加入匀浆液[50 mmol/L Tris-HCl, 2 mmol/L EDTA, pH 8.0, 0.25% 芦布若尔(lubrol)去污剂],冰上放置,用机械匀浆器间歇匀浆组织块,静置于冰上裂解15 min,取上清用BCA蛋白定量试剂盒定量蛋白。参照文献中的方法[8-9],酶活性检测采用厌氧性电子转移黄素蛋白荧光还原分析法。组织上清液和电子转移黄素蛋白共同孵育在密闭的石英比色皿中,加入25 μmol/L丁酰辅酶A开始反应。应用荧光分光光度计观察电子转移黄素蛋白的荧光减少60 s,将每分钟内使电子转移黄素蛋白完全减少1 nmol所需的酶量表示为1 mU,酶活性以U/(g protein)表示。
2.4Western blotting检测心肌SCAD蛋白的表达 配制12% SDS-PAGE分离胶和5% 积层胶, 每孔加入40 μg 蛋白样品, 置电泳缓冲液中, 60 V 电泳约30 min,待样品进入分离胶后, 120 V 电泳至所需时间。将蛋白转印至PVDF 膜, 用5% 脱脂奶粉于室温封闭2 h, 分别加Ⅰ抗 [SCAD抗体(1∶1 000);α-tubulin 抗体(1∶2 000)]。4 ℃孵育过夜,次日TBST洗膜3次,每次5 min, 再加相应Ⅱ抗室温孵育1 h, 发光剂孵育6 min, 曝光、显影、定影, 结果用Labwork凝胶图像分析系统对条带进行分析。
3统计学处理
采用SPSS 13.0 统计软件分析处理,数据以均数±标准差(mean±SD)表示。多组结果比较采用单因素方差分析及Dunnettt检验进行两两比较,以P<0.05为差异有统计学意义。
结 果
1不同时期Wistar大鼠心脏组织SCAD的蛋白表达及酶活性变化
由图1、2可见,SCAD在Wistar大鼠各时点心肌组织中均有表达,其中胚胎期19 d处于低表达状态。随日龄增加,SCAD蛋白表达及其酶活性均有逐渐增加的趋势。与胚胎期19 d大鼠相比,从2周龄Wistar大鼠开始差异有统计学意义。
2不同时期Wistar大鼠血清和心肌游离脂肪酸含量的变化
由图3可见,与胚胎19 d相比,出生后1 d、2周、6周及16周龄大鼠血清和心肌游离脂肪酸含量降低,从2周龄开始差异有统计学意义。这表明Wistar大鼠出生后心肌SCAD蛋白表达及酶活性的增加,可能导致了心肌脂肪酸β氧化能力增强,从而引起血清和心肌游离脂肪酸含量的下降。

Figure 1. Protein expression of SCAD in myocardium of Wistar rats during the heart development. E19: embryonic day 19; P1: postnatal day 1; 2 weeks: 2 weeks old; 6 weeks: 6 weeks old; 16 weeks: 16 weeks old. Mean±SD.n=8.*P<0.05vsE19.
图1Wistar大鼠不同发育时期心肌SCAD蛋白表达的变化

Figure 2. The activity of SCAD in myocardium of Wistar rats during the heart development. E19: embryonic day 19; P1: postnatal day 1; 2 weeks: 2 weeks old; 6 weeks: 6 weeks old; 16 weeks: 16 weeks old. Mean±SD.n=8.*P< 0.05vsE19.
图2Wistar大鼠不同发育时期心肌SCAD酶活性的变化

Figure 3. Content of free fatty acids in serum and myocardium of Wistar rats during the heart development. E19: embryonic day 19; P1: postnatal day 1; 2 weeks: 2 weeks old; 6 weeks: 6 weeks old; 16 weeks: 16 wees old. Mean±SD.n=8.*P< 0.05vsE19.
图3Wistar大鼠不同发育时期血清和心肌游离脂肪酸含量的变化
3SHR血压及左室重量指数的变化
由表1可见,与周龄匹配的WKY大鼠组相比较,各时点SHR的体重呈渐进性增长,且均低于周龄匹配的WKY大鼠,差异无显著,这可能是遗传因素影响了未成年大鼠的生长发育。与周龄匹配的WKY大鼠组相比较,2周龄SHR的收缩压尚未升高,6周龄SHR的收缩压已明显高于对照组,16周龄SHR的收缩压进一步增高,与对照组相比,差异显著。与周龄匹配的WKY大鼠组相比较,各时点SHR的左心室重量均增加,左室重量指数[left ventricular weight (LVW)/body weight (BW)]均明显增高,差异显著,提示SHR在血压升高之前,已经发生了明显的心肌肥厚。
表1各组大鼠收缩压及左室重量指数的比较
Table 1. Comparison of the systolic blood pressure and left ventricular mass index of rats (mean±SD.n=8)
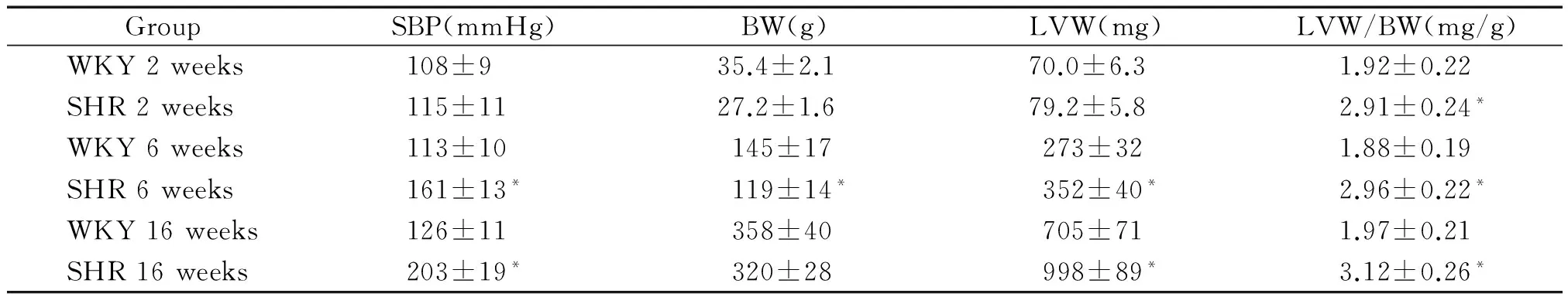
GroupSBP(mmHg)BW(g)LVW(mg)LVW/BW(mg/g)WKY2weeks108±935.4±2.170.0±6.31.92±0.22SHR2weeks115±1127.2±1.679.2±5.82.91±0.24*WKY6weeks113±10145±17273±321.88±0.19SHR6weeks161±13*119±14*352±40*2.96±0.22*WKY16weeks126±11358±40705±711.97±0.21SHR16weeks203±19*320±28998±89*3.12±0.26*
WKY: Wistar-Kyoto rats; SHR: spontaneously hypertensive rats; SBP: systolic blood pressure; BW: body weight; LVW: left ventricular weight.*P< 0.05vsage-matched WKY rats.
4SHR左心室SCAD的蛋白表达及酶活性变化
由图4、5可见,与周龄匹配的WKY大鼠组相比较,各时点SHR组心肌的SCAD蛋白表达均明显下调,SCAD酶活性也显著下降,差异有统计学意义,表明SCAD的蛋白表达下调,可能导致了酶活性的下降。此外,2周龄的SHR在血压升高之前,SCAD的蛋白表达已经出现了明显的下调,表明SCAD在SHR中的表达变化并不是长期高血压引起的适应性反应。
5SHR血清和心肌游离脂肪酸含量的变化
由图6可见,与周龄匹配的WKY大鼠组相比较,各时点SHR组血清和心肌的游离脂肪酸含量均明显增加,表明SHR心肌的SCAD蛋白表达及酶活性下降,可能导致了心肌脂肪酸β氧化能力下降,从而引起血清和心肌游离脂肪酸含量的增加。
6SCAD蛋白表达水平与血清、心肌游离脂肪酸含量、左室重量指数的相关性分析
经Pearson 相关分析,随日龄增加,Wistar大鼠心肌组织SCAD蛋白表达逐渐增高,而血清和心肌游离脂肪酸含量则呈逐渐减少的趋势,二者之间呈负相关[与血清游离脂肪酸含量之间的相关系数r=-0.924(P<0.05);与心肌游离脂肪酸含量之间的相关系数r=-0.931(P<0.05)]。不同周龄SHR的心肌组织SCAD蛋白表达明显下调,而血清、心肌游离脂肪酸含量和左室重量指数则明显增高,与血清游离脂肪酸含量之间的相关系数r=-0.963(P<0.01),与心肌游离脂肪酸含量之间的相关系数r=-0.975(P<0.01),与左室重量指数之间的相关系数r=-0.965 (P<0.01),均呈显著负相关。

Figure 4. Protein expression of SCAD in myocardium of rats. WKY: Wistar-Kyoto rats; SHR: spontaneously hypertensive rats. Mean±SD.n=8.*P< 0.05vsage-matched WKY rats.
图4大鼠心肌组织SCAD蛋白表达的变化
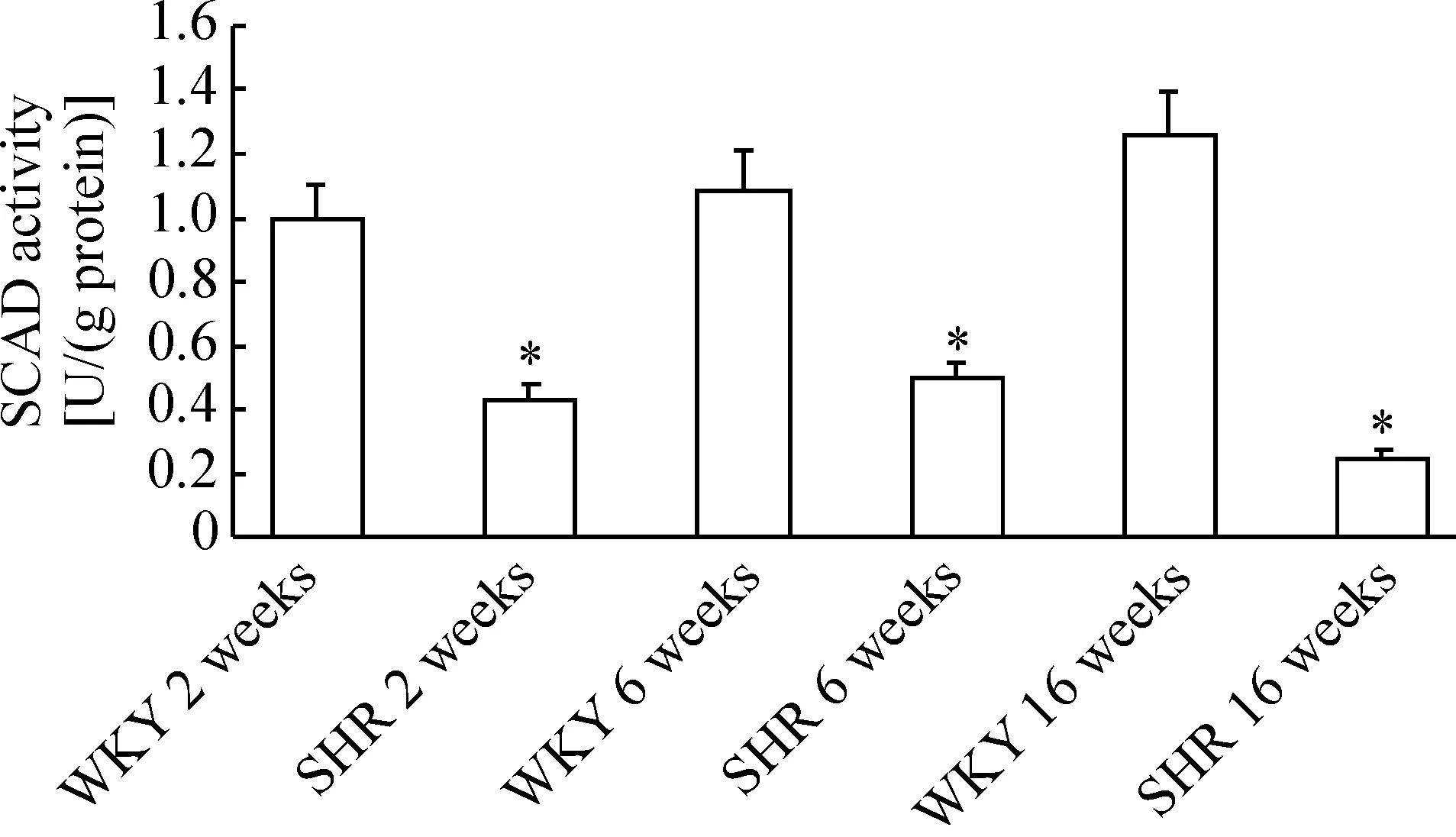
Figure 5. The activity of SCAD in myocardium of rats. WKY: Wistar-Kyoto rats; SHR: spontaneously hypertensive rats. Mean±SD.n=8.*P< 0.05vsage-matched WKY rats.
图5大鼠心肌组织SCAD酶活性的变化

Figure 6. Content of free fatty acids in serum and myocardium of rats. WKY: Wistar-Kyoto rats; SHR: spontaneously hypertensive rats. Mean±SD.n=8.*P<0.05vsage-matched WKY rats.
图6大鼠血清和心肌游离脂肪酸含量的变化
讨 论
哺乳动物心脏从蠕动收缩的管状结构发育到自主收缩的成熟心脏是一个极其复杂的过程,基因表达的时空性改变在心脏发育过程中起着重要作用。大鼠胚胎是胚胎发育研究领域被广泛采用的实验动物,目前国内外研究胚胎心脏的发育时期绝大多数集中在胚胎期11 d以后[10]。在胚胎12 d, 心脏已形成原始的心房与心室,此后心脏开始分割, 房室间隔、瓣膜开始形成;胚胎15 d时,心脏分割已基本完成,具备四腔结构,心脏面临一系列的重构与完善;胚胎19 d时,心脏已基本发育成熟[11],故本实验选取胚胎期19 d的心脏进行观察。此外,本研究还选取了新生期大鼠(出生后1 d)、幼年期大鼠(出生后1~4周)、青年期大鼠(出生后5~7周)以及成年期大鼠(出生后8~38周)的心脏进行对比,检测SCAD的蛋白表达及其酶活性变化,以探讨SCAD与心脏发育的关系。我们的研究结果显示,SCAD在Wistar大鼠各时点心脏组织中均有表达,其中胚胎期19 d处于低表达状态。随日龄增加,SCAD蛋白表达及其酶活性均有逐渐增加的趋势,提示SCAD的表达具有年龄依赖性,与大鼠心脏发育密切相关。随着时间的推移, Wistar大鼠血清和心肌游离脂肪酸含量则呈逐渐减少的趋势, 二者之间呈负相关, 表明Wistar大鼠出生后心肌SCAD蛋白表达及酶活性的增加可能导致了心肌脂肪酸β氧化能力增强,从而引起血清和心肌游离脂肪酸含量的下降。
研究证实,胚胎时心肌处于一个相对缺氧的环境,其能量底物来源于耗氧量较少的葡萄糖和乳酸代谢,出生后由于哺乳动物的饮食含有高脂肪的奶酪,使主要能量底物迅速转为脂肪酸,相应伴有编码脂肪酸氧化酶的基因表达急剧增加[1-2]。SCAD 是高度保守的酰基辅酶A 脱氢酶家族成员之一,参与催化脂肪酸β氧化的第一步反应。本研究观察到SCAD蛋白表达随年龄变化逐渐增加,且血清和心肌游离脂肪酸含量逐渐减少,可能与大鼠心肌对能量代谢底物的利用转变有关。因此,SCAD的表达变化不仅与心脏生长发育密切相关, 对于维持出生后成熟心脏的能量代谢亦起到重要作用,其机制有待进一步研究。
Swynghedauw[12]把机械刺激或压力负荷下诱导激活的胚胎基因分为4 类: 正常成熟心室肌不表达的基因的再表达;在胚胎阶段不表达或基本不表达的基因的再表达;在心肌重塑过程中被激活的凋亡相关基因, 它们发出吞噬信号, 以清除错位或死亡细胞;最新研究发现的被激活的心脏原有或募集的干细胞等。胚胎基因激活可能使得心肌细胞体积增大所需的蛋白质合成增加, 并满足这些肥大细胞的能量需要。我们采用DIGE技术比较了16周龄SHR和血压正常大鼠的心肌蛋白质组,首次发现了SCAD在SHR肥厚心肌中的表达显著降低[7],本研究进一步采用2周、6周及16周龄的SHR对SCAD的功能进行验证。2周龄SHR的收缩压尚未升高,6周龄及16周龄SHR的收缩压显著增高;各时点SHR的左室重量指数均明显增高,提示SHR在高血压形成之前,已经发生了明显的心肌肥厚,与文献中的报道一致[13],这可能是由SHR的遗传因素所决定。本研究结果显示,2周、6周及16周龄SHR发生左心室肥厚的同时,心肌组织的SCAD均呈低表达状态,与SHR的左室重量指数呈显著负相关,表明SCAD在SHR中的表达变化,并不是长期高血压引起的适应性反应,可能是遗传变化诱导激活了胚胎阶段不表达或基本不表达的基因表达模式。与SCAD蛋白表达变化一致的是,SCAD酶活性也显著下降,血清和心肌游离脂肪酸含量均明显增加,二者之间呈负相关,表明SHR的心肌SCAD蛋白表达及酶活性下降,可能导致了心肌脂肪酸β氧化能力下降,肥厚心肌脂肪酸利用减少,从而引起血清和心肌游离脂肪酸含量的增加。
最初,肥厚心肌线粒体的脂肪酸氧化能力下调是为了减少氧耗,然而这一代谢模式的转变最终不适应机体的需要,会导致病理性心肌重构和心力衰竭的发生,如先天性脂肪酸氧化酶缺陷的婴儿[14-15]。本研究结果表明,SCAD的表达下调与能量代谢底物的利用改变相一致,其表达下调可能是肥厚心肌能量代谢“胚胎型再演”的分子基础。因此,进一步深入研究SCAD的胚胎基因再编程将有助于阐明心肌肥厚的分子机制,有可能为心肌肥厚、心力衰竭等疾病治疗提供一条有效的途径, 有助于找到可能的药物干预靶点, 也将为基因治疗奠定理论基础。
[1] Kolwicz SC Jr, Tian R. Glucose metabolism and cardiac hypertrophy[J]. Cardiovasc Res, 2011,90(2):194-201.
[2] 孙雅逊,胡申江,张志杰,等.阿托伐他汀改善自发性高血压大鼠的心肌脂质代谢和抑制心肌肥厚[J].中华高血压杂志,2006,14(8):632-635.
[3] 殷 然,董吁钢,李红良, 等. AMPK通过增强心肌脂肪酸氧化抑制大鼠心肌肥厚[J]. 中国病理生理杂志,2007,23(7):1258-1262.
[4] 冯 兵,徐 静,刘 伟,等. 肥大心肌细胞缺氧复氧损伤特点及干预能量代谢的作用[J].中国病理生理杂志, 2007,23(3):500-504.
[5] 刘晓红,吕元红.线粒体脂肪酸氧化缺陷与能量代谢研究[J].中国优生与遗传杂志,2006,14(8):10,22.
[6] Pena L, Angle B, Burton B,et al. Follow-up of patients with short-chain acyl-CoA dehydrogenase and isobutyryl-CoA dehydrogenase deficiencies identified through newborn screening: one center’s experience[J]. Genet Med, 2012,14(3):342-347.
[7] Zhou SG, Zhou SF, Huang HQ, et al. Proteomic analysis of hypertrophied myocardial protein patterns in renovascularly hypertensive and spontaneously hypertensive rats[J]. J Proteome Res, 2006, 5(11): 2901-2908.
[8] Goetzman ES. The regulation of acyl-CoA dehydrogenases in adipose tissue by rosiglitazone[J]. Obesity, 2009, 17(1):196-198.
[9] Frerman FE, Goodman SI. Fluorometric assay of acyl-CoA dehydrogenases in normal and mutant human fibroblasts[J]. Biochem Med, 1985, 33(1):38-44.
[10]汪 剑,卓莉莉,姜之文, 等. CSX/Nkx2.5 基因在大鼠胚胎心脏发育过程中的表达[J]. 南京医科大学学报:自然科学版,2008,28(5): 605-608.
[11]孙凤荣,龚 杰,钱玲梅, 等. GATA-4 基因在大鼠胚胎心脏中的表达[J]. 南京医科大学学报:自然科学版,2007,27(6): 555-557.
[12]Swynghedauw B. Phenotypic plasticity of adult myocardium: molecular mechanisms[J]. J Exp Biol, 2006, 209(Pt 12): 2320-2327.
[13]Moreau P,Tea BS, Dam TV, et al.Altered balance between cell replication and apoptosis in hearts and kidneys of newborn SHR[J].Hypertension, 1997,30(3 Pt 2):720-724.
[14]Eminoglu TF, Tumer L, Okur I, et al. Very long-chain acyl CoA dehydrogenase deficiency which was accepted as infanticide[J]. Forensic Sci Int, 2011,210(1-3):e1-e3.
[15]朱锦明,杨 孜. 遗传性线粒体脂肪酸β-氧化途径代谢缺陷研究进展[J].北京大学学报:医学版,2006,38(2):214-217.
Expressionofshort-chainacyl-CoAdehydrogenaseduringheartdevelopmentinratsandrelationshipwithcardiachypertrophy
ZHOU Si-gui1, WANG Ping3, LU Yao4, YUAN Xi4, ZANG Lin-quan1, YANG Zhi-cheng1, XU Li-peng2
(1DepartmentofClinicalPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2InstituteofNewDrugResearch,CollegeofPharmacy,JinanUniversity,Guangzhou510632,China;3ShenzhenInstituteforDrugControl,Shenzhen518029,China;4Grade2007,DepartmentofEight-YearClinicalMedicine,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:xulipeng2000@sohu.com)
AIM: To investigate the expression of short-chain acyl-CoA dehydrogenase during the heart deve-lopment in rats and to analyze the relationship between short-chain acyl-CoA dehydrogenase and cardiac hypertrophy in spontaneously hypertensive rats (SHR).METHODSThe expression and activity of short-chain acyl-CoA dehydrogenase in the hearts of Wistar rats with different ages were measured. Free fatty acids in serum and cardiac muscles were also determined.RESULTSCompared with the fetal rats of 19 d, the expression and activity of short-chain acyl-CoA dehydrogenase in the postnatal rats of 1 d, 2 weeks, 6 weeks and 16 weeks were increased, and free fatty acids in the serum and myocardium were obviously decreased. The difference began in evidence from the age of 2 weeks. The expression of short-chain acyl-CoA dehydrogenase was significantly up-regulated with negative correlation to free fatty acids in the serum and myocardium during heart development. Systolic blood pressure was similar in 2-week-old SHR and WKY rats, which significantly increased in SHR of 6 weeks and 16 weeks old compared with the age-matched WKY rats. The ratio of left ventricular weight to body weight was markedly elevated in SHR of 2 weeks, 6 weeks and 16 weeks old compared with the age-matched WKY rats, indicating that the appearance of cardiac hypertrophy occurred before the development of hypertension in SHR. Compared with the age-matched WKY rats, the expression and activity of short-chain acyl-CoA dehydrogenase were decreased and free fatty acids in the serum and myocardium were obviously higher in SHR. The expression of short-chain acyl-CoA dehydrogenase was significantly down-regulated with a negative correlation to free fatty acids in the serum and myocardium of SHR.CONCLUSIONThe expression of short-chain acyl-CoA dehydrogenase is increased during the heart development, which may be associated with the increase in cardiac fatty acid utilization. The down-regulated expression of short-chain acyl-CoA dehydrogenase in the hypertrophic heart may be responsible for the recapitulation of fetal energy metabolism.
Short-chain acyl-CoA dehydrogenase; Heart development; Fatty acid oxidation; Cardiac hypertrophy
R363
A
10.3969/j.issn.1000- 4718.2013.01.002
1000- 4718(2013)01- 0009- 06
2012-10-29
2012-12-10
国家自然科学基金青年基金资助项目(No.81000072; No.81001683);教育部留学回国人员启动基金资助项目(No.23610008);教育部博士学科点专项科研基金资助项目(No.20104401120003);广东药学院重点培养青年教师基金资助项目;广东省“十二五”医学重点学科(依托广东药学院附属第一医院、药科学院)。
△通讯作者 Tel: 020-38375027; E-mail: xulipeng2000@sohu.com

