喉癌组织中的microRNA差异表达谱及miR-125a-5p抑制喉癌细胞增殖的初步研究*
张思毅, 卢仲明, 宋新汉, 张鸿彬, 陈良嗣, 罗小宁, 陈少华, 吴一龙
( 1南方医科大学,广东 广州 510515; 2广东省人民医院,广东省医学科学院耳鼻咽喉头颈外科, 3广东省肺癌研究所,广东 广州 510080)
喉癌组织中的microRNA差异表达谱及miR-125a-5p抑制喉癌细胞增殖的初步研究*
张思毅1,2△, 卢仲明1,2, 宋新汉2, 张鸿彬2, 陈良嗣2, 罗小宁2, 陈少华2, 吴一龙3△
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省医学科学院耳鼻咽喉头颈外科,3广东省肺癌研究所,广东 广州 510080)
目的筛选并分析喉癌组织与周围正常喉黏膜的微小RNA(microRNAs,miRNAs) 之间的表达谱差异,为进一步研究miRNA与喉癌发生、发展的关系提供线索。方法收集喉癌组织和癌旁正常喉黏膜标本共42对,随机选取10对标本进行miRNA微阵列基因芯片分析, 另选取32对标本进行实时荧光定量PCR (qRT-PCR)验证,获得喉癌组织中的miRNA差异表达谱。应用MTT法和克隆形成实验检测miR-125a-5p对喉癌Hep2细胞增殖的影响。结果喉癌组织中的let-7f-5p、miR-10a-5p、miR-125a-5p、miR-144-3p、miR-195-5p、miR-203等6个miRNA在基因芯片以及qRT-PCR中表达均显著下调。与对照组相比,转染miR-125a-mimics组的喉癌Hep2细胞增殖能力受到抑制,而转染miR-125a-inhibitor组Hep2细胞增殖能力增强。结论基因芯片与qRT-PCR结果一致;喉癌与正常喉黏膜之间存在明显的miRNA差异表达,这些miRNA的差异性表达可能与喉癌的发病、侵袭等相关。miR-125a可以抑制喉癌Hep2细胞的增殖,可能作为喉癌生物治疗的新靶点。
喉肿瘤; 微小RNA; 微阵列芯片; 细胞增殖
头颈肿瘤是危及人类生命的主要癌症之一,在所有癌症中发病率居第6位。喉癌是最常见的头颈肿瘤之一,在呼吸道肿瘤中发病率居第2位,绝大多数为鳞状细胞癌。有国内外调查表明,喉癌的发病率不断升高,每年约增加25%[1-2],2008年世界上男性喉癌发病率估计为5.1/100 000,男性病人死亡率约为2.2/100 000。根据最新的研究,虽然近30年来新的外科手术方法、化疗药物及更先进的放射治疗手段已应用在喉癌的治疗中,与其它头颈癌一样,喉癌患者的总生存率并未得到提高,甚至有所下降[3]。流行病学调查发现喉癌的可能病因包括吸烟、酗酒、空气污染、职业因素等[4-5]等。尽管有研究表明,喉癌的发生发展与某些癌基因(如bcl-2、c-myc等)和抑癌基因(如p53、Rb、p16、p21等)相关,但喉癌的分子水平发病机制目前仍未明确,因此目前还难以从分子机制干预喉癌的发病并提高其生存率。
微小RNAs (microRNAs, miRNAs)是一类长度大约19~25 nt小分子非编码RNA。它主要通过与靶基因3’非翻译区(3’ untranslated region ,3’UTR)的完全或不完全配对,降解靶基因mRNA 或抑制其翻译,在转录后对靶基因的表达水平进行调控,从而参与调控个体发育、细胞凋亡、增殖及分化等生命活动[6-7]。近年研究提示, miRNAs 可能作为癌基因或抑癌基因在多种肿瘤的发生、发展、侵袭、转移和血管生成的基因调控中扮演了重要角色[8-9],并可能与喉癌等头颈肿瘤的发生、发展相关[10],提示miRNA可能作为喉癌的生物标记物或治疗靶标在喉癌的早期诊断、治疗、预后等方面具有潜在的临床价值。
然而,迄今为止,对喉癌中miRNA的差异表达情况尚未完全阐明。本研究采用涵盖了miRbase数据库中全部人类microRNA的第6代miRCURYTMLNA微阵列芯片,对喉癌中的miRNA差异表达进行初步筛选,通过实时定量PCR对其进行验证,并初步地研究了miR-125a-5p(原名miR-125a)对喉癌Hep2细胞增殖的影响。旨在为进一步研究miRNA与喉癌发生、发展的关系提供线索,以便更好地了解喉癌分子水平的发病机制。
材 料 和 方 法
1组织标本采集与临床资料的收集
收集2007年10月~2009年3月广东省人民医院手术切除的喉癌组织及癌旁正常组织共42对:术中分别切取经病理证实的喉癌组织及距离手术阴性切缘至少2 cm的正常喉黏膜各约0.5 cm3,标本经适量生理盐水漂洗后迅速存入RNA later液(Qiagen公司)中保存,并于-80℃ 冰箱中保存。42例喉癌患者的临床病理资料见表1,所有患者术后病理诊断均为鳞状细胞癌,术前均未接受放、化疗。将其随机分为2组:10对喉癌标本进行microRNA芯片检测,另32对标本进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)验证。
表1喉癌病人临床病理资料
Table 1. Clinicopathological characteristics of the laryngeal carcinoma patients (n=42)

ItemDataAge(year.Mean±SD)59.8±11.7Sex[n(%)] Male39(92.9) Female3(7.1)Type[n(%)] Supraglottic12(28.6) Glottic28(66.7) Subglottic2(4.8)Clinicalstage[n(%)] I19(45.2) II8(19.0) III2(4.8) IV13(31.0)Tstage[n(%)] T119(45.2) T210(23.8) T35(11.9) T48(19.1)Nstage[n(%)] N033(78.6) N1~39(21.4)Differentiation[n(%)] Poorlydifferentiated3(7.1) Moderatelydifferentiated23(54.8) Highlydifferentiated16(38.1)
2总RNA抽提及验证
应用Invitrogen公司的Trizol和Qiagen公司的miRNeasy mini kit试剂盒抽提总RNA,按照说明书操作,覆盖了各种RNA,包括miRNAs。使用Nanodrop公司的分光光度计ND-1000测定RNA的质量和定量,RNA的完整性由凝胶电泳判定。
3MicroRNA基因芯片检测分析
随机选取10对喉癌标本的总RNA进行以下microRNA芯片检测。
3.1对RNA进行荧光标记和芯片杂交 抽提RNA后,使用丹麦Exiqon公司的miRCURYTMHy3TM/Hy5TMPower labeling kit,按说明书进行miRNA标记。在荧光标记后,Hy3TM标记的样品按手册在miRCURYTMLNA 16.0 (Exiqon)芯片进行杂交。
3.2清洗扫描及信号数字化处理 MicroRNA芯片杂交后,用洗脱缓冲液(Exiqon)洗数次后400 r/min离心5 min干燥。用Axon GenePix 4000B microarray scanner (Axon)进行扫描。
扫描得到的图像输入GenePix Pro 6.0(Axon)软件进行坐标调整和数据提取。重复的miRNAs数据取均数,选出在所有样品中强度均≥50 的miRNAs计算标准化因子。表达数据使用中位数标准化,显著差异表达的miRNAs通过火山图(Volcano Plot)过滤后确认。使用MEV 4.6软件(TIGR) 进行聚类分析。
4实时荧光定量PCR(qRT-PCR)验证
另取32对喉癌组织及癌旁正常黏膜组织标本,提取总RNA。采用SYBR Green染料法,以U6为内参照,对微阵列芯片结果中的6个miRNA: let-7f-5p、miRNA-10a-5p、miRNA-125a-5p、miRNA-144-3p、miRNA-195-5p和miRNA-203在各样品中的表达量进行qRT-PCR验证。
4.1逆转录 32对组织抽提总RNA后,取2 ng~2 μg总RNA用MMLV-RT逆转录酶按照说明合成cDNA:在总RNA中加入所有茎环结构的RT引物(广州锐博生物公司合成),用无RNA酶水补足至24 μL,混匀,70 ℃温育10 min后冰浴2 min。依次加入RNA酶抑制剂2 μL、5×M-MLV Buffer 8 μL、RTase M-MLV(RNase H-)2 μL,dNTP Mixture 2 μL ,用无RNA酶水补足至40 μL, 30 ℃反应10 min,再42 ℃孵育1 h,最后70 ℃保温15 min,获得逆转录产物作为PCR模板。
4.2定量PCR 反应在Bio-Rad的荧光定量PCR 仪上进行扩增, 每组设3个复孔。反应体系为20 μL总体系:2× Mix SYBR Green I荧光反应液10 μL,上、下游引物(10 μmol/L)各0.25 μL,样品模板1 μL,用无RNA酶水补足20 μL体系。反应条件为: 95 ℃ 预变性20 s,95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,共40个循环,绘制扩增曲线;40个循环后对60 ℃到95 ℃升温整个过程进行全程荧光信号收集,绘制熔解曲线。反应结束得到各反应管循环阈值(threshold cycle, Ct)。对获得的Ct值采用2-ΔΔCt法对基因表达进行相对定量。
5细胞培养
5.1细胞株、培养基及相关试剂、仪器 喉癌Hep2细胞(购自ATCC收藏中心);RPMI-1640基础培养基(Gibco);RPMI-1640完全培养基(Gibco);胎牛血清(Gibco);0.25%胰蛋白酶(Gibco);37 ℃细胞培养箱(Thermo)。 3-(4,5)-双甲基-2-噻唑-(2,5)-二甲苯基溴化四氮唑(MTT;Sigma),5 g/L;二甲亚砜(DMSO;Sigma),酶标仪(Bio-Rad),96孔板和6孔板(康宁),苏木素(上海宏基),脱色摇床(Qilinbeier)。
5.2细胞瞬时转染 转染前24 h消化和计数细胞,在6孔板的每孔中接种4×105个细胞,待细胞达到70%~80%汇合进行转染;将Hep2细胞分别与miR-125a-mimic、miR-125a-inhibitor和阴性对照混合,置于250 μL无血清的基础培养基Opti-MEM中,加入4 μL FuGENE®6 Transfection Reagent,混匀,室温放置15 min;吸弃细胞培养物中的完全培养基,用基础培养基Opti-MEM漂洗细胞2次,加入无血清基础培养基Opti-MEM 1.5 mL;将DNA-FuGENE®6 Transfection Reagent复合物加入细胞中,前后轻晃6孔板使混合液分散均匀。6 h后吸弃转染复合物,换入含10%胎牛血清的新鲜培养基。
5.3MTT实验 用胰蛋白酶消化汇合的单层细胞,将细胞收集到含血清的培养基中。离心细胞悬液,重悬细胞,计数。将细胞稀释至(0.5~1)×107/L,每个孔加入200 μL细胞悬液,每种细胞分4份分别种于4个96孔板,每份细胞3复孔,细胞培养箱中继续培养。第1、3、5、7 d时,分别取出1个96孔板进行检测。每孔加入20 μL MTT(5 g/L),37 ℃湿润环境中温育4 h。弃去孔中的培养基和MTT,加入150 μL DMSO,水平摇床低速混合10 min。酶标仪490 nm处记录吸光度(A)。将1、3、5、7 d测得的A值汇总,绘制各组细胞的生长曲线。
5.4克隆形成实验 收集对数生长期细胞,调整细胞悬液浓度5×105cells/L,分于6孔板,每孔2 mL,即1 000 cells/well。培养7~10 d,观察克隆出现日期及生长情况,大于50个细胞的集落算1个克隆。PBS洗3次,加固定液甲醇1 mL/well摇床上放置10 min。加入1 mL/well苏木素放置摇床上10 min染色,倒掉苏木素。计数每个孔的克隆数并拍照,计算克隆形成率。克隆形成率(%)=克隆数/接种细胞数×100%。
6统计学处理
MicroRNA基因芯片实验结果采用芯片显著性分析软件(significance analysis of microarrays, SAM)进行分析, 设定错误发现率(false discovery rate, FDR)为0.05,筛选出喉癌组织和癌旁组织之间差异表达的microRNA。用SPSS 13.0软件分析,两组间比较使用独立样本t检验。数据以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1总RNA提取质量分析
经分光光度计检测,所有样本提取的总RNA的A260/A280均在1.9~2.1之间;琼脂糖凝胶电泳:28S和18S的RNA呈现明显、锐利的条带,而且28S带荧光强于18S,二者之比约为2∶1。结果表明样品总RNA的质量可靠、未降解,可用于后续实验。
2miRNA基因芯片结果
我们通过miRNA芯片筛选得到了2 662个差异表达的miRNA,将其中的非人类miRNA以及超过一半样本无法检测到的miRNA去除后,比较了780个miRNA,采用SAM软件分析, 设定FDR为0.05,发现相对正常黏膜, 在肿瘤组织中共有11个miRNA表达显著上调; 114个miRNA表达显著下调,见图1、2。
3qRT-PCR验证结果
对let-7f-5p、miRNA-10a-5p、miRNA-125a-5p、miRNA-144-3p、miRNA-195-5p、miRNA-203等6个miRNA进行qRT-PCR验证,这6个miRNA在32对喉癌与周围正常喉黏膜组织之间的表达差异均有统计学意义(P<0.05)。miRNA定量PCR溶解曲线均为单一峰,说明PCR扩增特异性好。我们再将芯片结果与qRT-PCR结果进行比较,结果显示这6个miRNA表达均下调,miRNA芯片与qRT-PCR的结果相符,见图3。
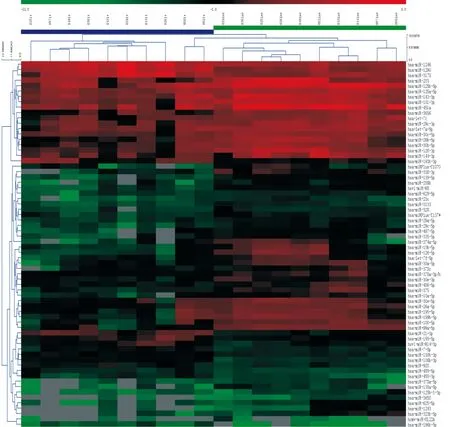
Figure 1. Heatmap of miRNA microarray in laryngeal squamous-cell carcinoma. Hierarchical clustering of differentially expressed miRNAs are shown in paired tumor-normal samples. Tissue samples are represented in columns, and differentially expressed miRNAs are delineated in rows. Red:up-regulation; green: down-regulation.
图1喉鳞状细胞癌miRNA微阵列芯片热点图
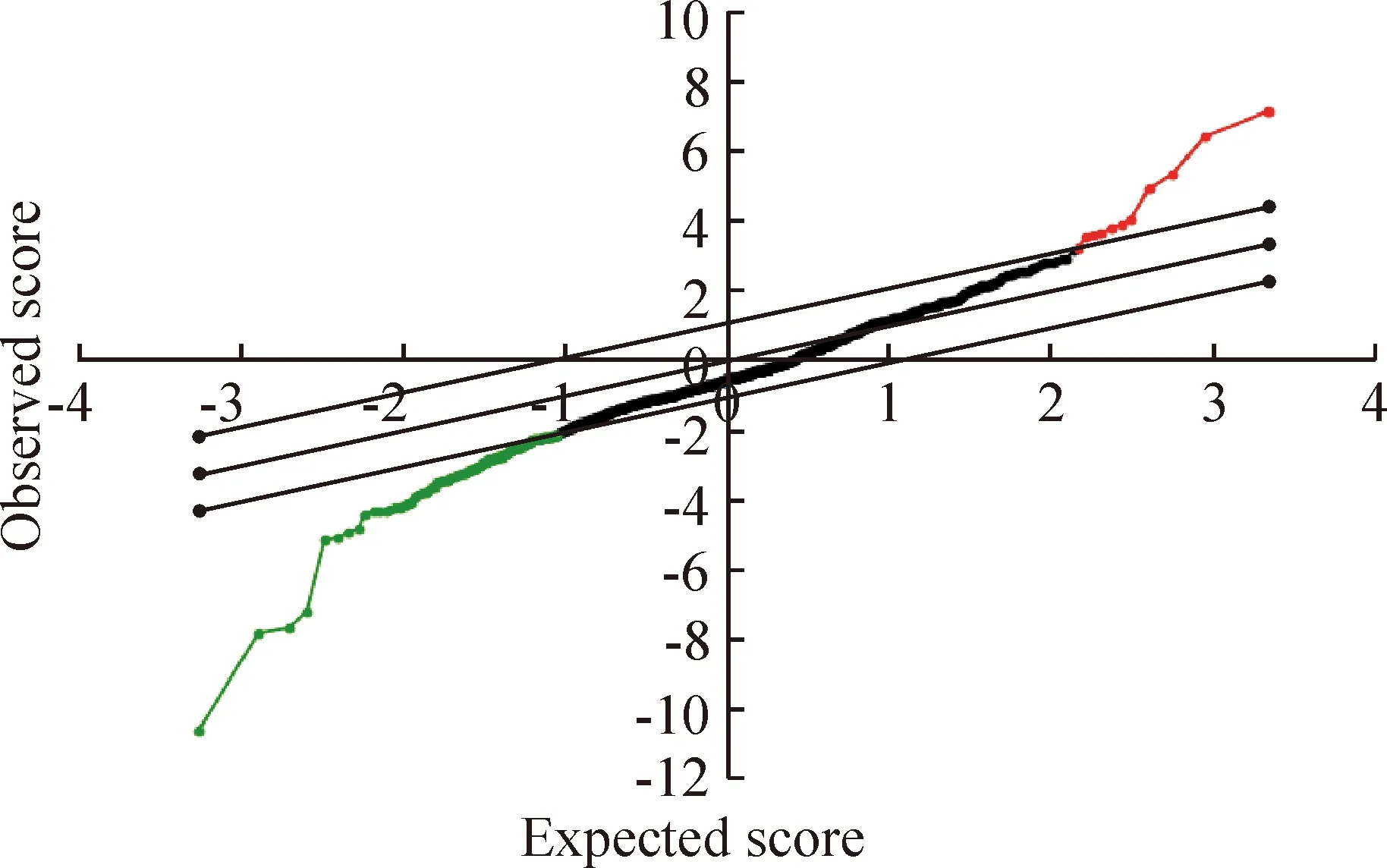
Figure 2. Significant miRNA genes identified using SAM analysis. From this analysis, there were 11 genes highly expressed and 114 genes lowly expressed in laryngeal cancer.
图2通过SAM软件分析获得的显著差异的miRNA基因

Figure 3. Comparison of the fold change for qRT-PCR and microarray data for selected miRNAs. Both miRNA microarray and qRT-PCR showed that the expression of let-7f-5p,miR-10a-5p,miR-125a-5p,miR-144-3p,miR-195-5p and miR-203 were down-regulated in laryngeal cancer tissue.
图3选定的6个miRNAs的qRT-PCR与微阵列芯片结果比较
4MTT实验结果
MTT实验结果显示,喉癌Hep2细胞转染miR-125a-mimics、 miR-125a-inhibitor及阴性对照(NC)后,与NC组相比,转染miR-125a-5p-mimics组活细胞数量显著降低(第1 d:P<0.05;第3、5、7 d:P<0.01),Hep2细胞增殖能力受到抑制;而转染miR-125a-inhibitor活细胞数量显著增加,细胞增殖能力明显增强(第1 d:P<0.05;第3、5、7 d:P<0.01),见图4。
5克隆形成实验结果
细胞克隆形成实验结果显示:转染miR-125a-mimics组Hep2细胞克隆形成率[(7.6± 0.9)%]显著低于NC组的克隆形成率[(17.5±0.9)%](P<0.01);而转染miR-125a-inhibitor组的克隆形成率[(21.4±0.8)%]显著高于NC组的克隆形成率[(10.0± 0.7)%](P<0.01)。这说明miR-125a-5p 表达对喉癌Hep2细胞的增殖能力有显著抑制作用,见图5。

Figure 4. MTT assays. A:up-regulation of miR-125a suppressed cell growth of human epidermoid carcinoma cell line Hep2; B:inhibition of miR-125a promotes cell growth of human epidermoid carcinoma cell line Hep2. Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control (NC).
图4MTT实验检测喉癌Hep2细胞分别转染miR-125a-mimics和miR-125a-inhibitor后增殖能力的变化
讨 论
在本研究中我们总共应用了42对新鲜冰冻喉癌组织及癌旁正常组织标本,其中10对标本采用丹麦Exiqon公司的第6代miRCURYTMLNA 16.0芯片进行分析,获得了喉癌及其癌旁正常黏膜组织中miRNA的全基因表达谱,使用SAM软件找到与喉癌相关的差异具有统计学意义的特征性miRNA。并进一步对另外32对标本应用茎环引物的荧光定量PCR技术进行验证,发现了let-7f-5p、miRNA-10a-5p、miRNA-125a-5p、miRNA-144-3p、miRNA-195-5p、miRNA-203等6个miRNA在基因芯片以及qRT-PCR中均显著下调。qRT-PCR与芯片结果一致,说明了本实验基因芯片结果的可靠性。本研究还通过MTT和克隆形成实验发现了miRNA-125a-5p可抑制喉癌Hep2细胞增殖,其可能成为喉癌生物治疗的新靶点。
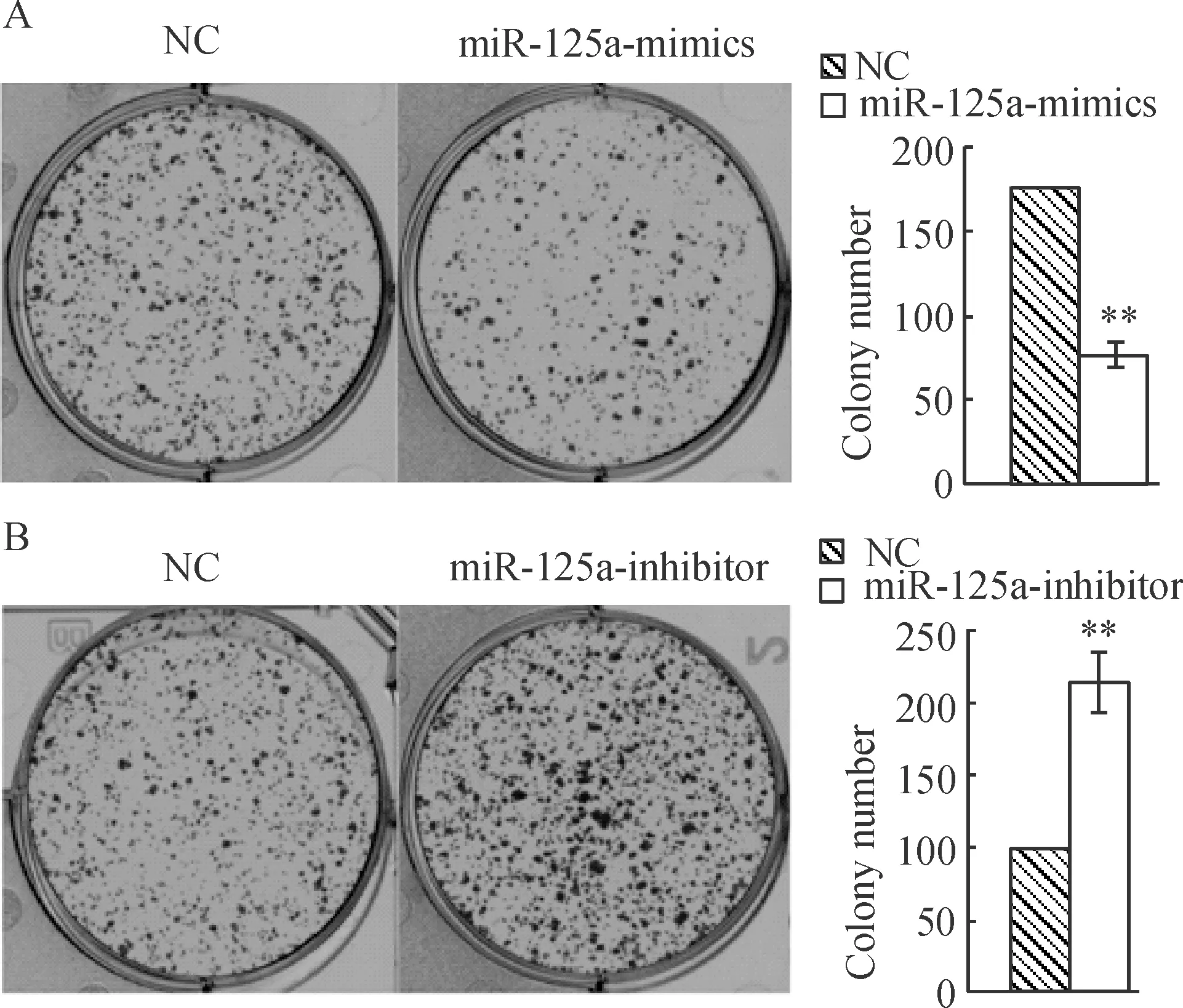
Figure 5. Colony-forming assay (crystal violet staining).A:Hep2 cells were transiently transfected with miR-125-mimics or scrambled sequence oligonucleotide as negative control (NC). Colony-forming assay showed a decrease in cell colony numbers relative to NC.B:Hep2 cells transfected with miR-125-inhibitor showed an increase in cell colony numbers relative to NC.Mean±SD.n=3.**P<0.01vsNC.
图5克隆形成实验检测miR-125a-5p表达对喉癌细胞Hep2增殖能力的影响
微阵列芯片技术是研究miRNA表达谱的重要手段。目前已发现的人类miRNAs有近2 000种(http://www.mirbase.org),对数量如此庞大的miRNAs进行分析研究,需要高效率、高通量的检测技术。miRNA微阵列芯片技术与传统RNA分析方法比较,具有明显优势: (1)高通量,可以同时检测上千个miRNA; (2)灵敏度和效率高; (3)样本需要量小:仅需1 μg总RNA即可完成所有检测。我们的研究应用了具有高灵敏度和特异性、最新版本的含有1 890个miRNA探针、可检测目前miRbase数据库中全部microRNA的miRCURYTMLNA 16.0 microRNA微阵列芯片进行检测,尽可能地保证了结果的可靠性和准确性。
qRT-PCR 被广泛认为是包括miRNA在内的核酸定量检测的金标准[11]。由于目前miRNA微阵列芯片结果仍存在一定的假阳性,经其筛选所得的差异表达的miRNA一般仍需要进一步验证。目前最常用于验证在微阵列基因芯片等高通量实验技术中发现的特异性miRNA。 Chen等[12]发明的茎环结构的实时定量PCR(stem-loop RT-PCR)因具有简便、高敏感、高特异等特点已成为目前miRNA定量检测法的推荐的qRT-PCR方法。实时定量PCR的结果一般应用2-ΔΔCt法进行相对定量计算miRNA的表达水平[13]。
目前miRNA在喉癌表达谱的研究仍存在诸多不足之处:多为头颈鳞癌的研究,单纯喉癌研究很少。虽然头颈部各种肿瘤的发病部位相近,然而,喉部作为呼吸系统的一部分,与口腔、咽部等所属的消化系统有所不同[14- 15]。喉癌与口腔癌、口咽癌、下咽癌等头颈鳞癌有着不同的临床病理特征及预后,例如喉癌病人的性别构成中男性发病比例明显较其它头颈肿瘤高[15]。而且,有喉癌与其它头颈鳞癌的基因组杂交比较研究发现,两者的染色体型存在明显差异[16]。所以,不区分部位地对头颈鳞癌一起进行研究可能会影响实验结果的可靠性并带来偏倚。此外,现有多数研究的标本量较小;不同研究结果间存在差异;一些研究使用石蜡包埋组织(在固定和包埋过程中可降解或者发生严重的交联,故结果可能不如新鲜冰冻组织准确);不少研究仅进行基因芯片检测,未进一步进行实时荧光定量PCR验证等均可能对研究结果带来一定影响。
在我们的喉癌miRNA差异表达谱研究结果中,有miRNA-10a-5p[17]、miRNA-125a-5p[10]、miRNA-203[18]、miRNA-144-3p[19]等 microRNA与以往的头颈鳞癌的文献报道一致。其中miRNA-125a-5p[10]、miRNA-203[18]和miRNA-144-3p 3个miRNA在文献中仅进行基因芯片检测的miRNA,我们对其进一步进行了qRT-PCR验证,而且在细胞水平初步研究了miRNA-125a-5p对喉癌Hep2细胞的增殖的影响。
同时我们也发现了一些尚未在头颈鳞癌或喉癌研究中报道的或结果不一致的microRNA,如let-7f-5p、miR-195-5p。Let-7是最早在秀丽隐杆线虫(C. elegans)中发现的miRNA之一,包括多个家族成员,如let-7a、b、c、d、e、f。有研究认为let-7i在头颈鳞癌中高表达[10],而let-7a、c、e低表达[17]。在我们的研究中喉癌组织的Let-7f-5p呈低表达,与Tran等[20]的研究(Let-7f-5p为高表达)相反,这可能是因为Tran的研究是对舌、扁桃体、下咽、喉等多种头颈肿瘤细胞株进行芯片检测,而且没有对Let-7f进行验证;而我们的研究则选用新鲜冰冻喉癌组织进行研究,而且进行了qRT-PCR验证。这也进一步证明了对喉癌等单病种而非多部位的不同头颈肿瘤合并研究的优势。miR-195是microRNA-15/16/195/424/497家族的重要成员,在肝癌、胃癌、乳腺癌、膀胱癌、慢性淋巴细胞性白血病等多种肿瘤中均存在异常的表达下调[21],提示miR-195可能是一个重要的肿瘤抑制因子。我们的研究首次发现,在喉癌中miR-195可能同样存在异常的低表达,但仍需要细胞水平的研究以进一步证实。
本研究首次通过基因芯片和qRT-PCR技术证实了miRNA-125a-5p在喉癌组织中表达下调,并在细胞水平初步研究了miRNA-125a-5p对喉癌Hep2细胞的增殖的影响, 转染miR-125a-mimics组细胞增殖能力受到抑制,而miR-125a-inhibitor促进其增殖能力。张帅等[22]研究表明,miRNA-125等miRNAs可能通过调控一些癌基因和抑癌基因(bcl-2、p53等)参与了去甲斑蝥素促进慢性髓细胞性白血病K562细胞凋亡的过程。还有研究显示,miR-125a在肝癌组织和细胞株中均表达下调,并与侵袭性的病理学特征相关,上调miR-125a可通过抑制基质金属蛋白酶11和血管内皮生长因子显著抑制肝癌细胞的恶性表型[23],提示了其成为肿瘤的有效治疗手段和预后标志物的潜力。
[1] Jaseviciene L, Gurevicius R, Obelenis V, et al. Trends in laryngeal cancer incidence in Lithuania: a future perspective[J]. Int J Occup Med Environ Health,2004,17(4):473-477.
[2] 卢善婷,魏矿荣, 余炳辉,等. 中山市1970年~1999年喉癌发病趋势分析[J]. 现代肿瘤医学,2004,12(2):158-160.
[3] Hoffman HT, Porter K, Karnell LH, et al. Laryngeal cancer in the United States: changes in demographics, patterns of care, and survival[J]. Laryngoscope,2006,116(9 Pt 2 Suppl 111):1-13.
[4] Hashibe M, Boffetta P, Zaridze D, et al. Contribution of tobacco and alcohol to the high rates of squamous cell carcinoma of the supraglottis and glottis in Central Europe[J]. Am J Epidemiol,2007,165(7):814-820.
[5] Shangina O, Brennan P, Szeszenia-Dabrowska N, et al. Occupational exposure and laryngeal and hypopharyngeal cancer risk in central and eastern Europe[J]. Am J Epidemiol,2006,164(4):367-375.
[6] Croce CM, Calin GA. miRNAs, cancer, and stem cell division[J]. Cell,2005,122(1):6-7.
[7] Ambros V. The functions of animal microRNAs[J]. Nature,2004,431(7006):350-355.
[8] Esquela-Kerscher A, Slack FJ. Oncomirs: microRNAs with a role in cancer[J]. Nat Rev Cancer,2006,6(4):259-269.
[9] Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer,2006,6(11):857-866.
[10]Ramdas L, Giri U, Ashorn CL, et al. miRNA expression profiles in head and neck squamous cell carcinoma and adjacent normal tissue[J]. Head Neck,2009,31(5):642-654.
[11]Schmittgen TD, Lee EJ, Jiang J, et al. Real-time PCR quantification of precursor and mature microRNA[J]. Methods,2008,44(1):31-38.
[12]Chen C, Ridzon DA, Broomer AJ, et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res,2005,33(20):e179.
[13]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods,2001,25(4):402-408.
[14]Almadori G, Bussu F, Paludettii G. Predictive factors of neck metastases in laryngeal squamous cell carcinoma. Towards an integrated clinico-molecular classification[J]. Acta Otorhinolaryngol Ital,2006,26(6):326-334.
[15]Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006[J]. CA Cancer J Clin,2006,56(2):106-130.
[16]Huang Q, Yu GP, Mccormick SA, et al. Genetic differences detected by comparative genomic hybridization in head and neck squamous cell carcinomas from different tumor sites: construction of oncogenetic trees for tumor progression[J]. Genes Chromosomes Cancer,2002,34(2):224-233.
[17]Hui AB, Lenarduzzi M, Krushel T, et al. Comprehensive microRNA profiling for head and neck squamous cell carcinomas[J]. Clin Cancer Res,2010,16(4):1129-1139.
[18]钟 琦,房居高,黄志刚,等. 喉鳞状细胞癌组织miRNA表达的初步研究[J]. 中华肿瘤防治杂志,2010,17(14):1073-1076.
[19]王 苹,付 涛,王绪锐,等. 应用微阵列芯片分析喉鳞状细胞癌miRNA与正常黏膜表达差异的初步研究[J]. 临床耳鼻咽喉头颈外科杂志,2010,24(12):535-538.
[20]Tran N, Mclean T, Zhang X, et al. MicroRNA expression profiles in head and neck cancer cell lines[J]. Biochem Biophys Res Commun,2007,358(1):12-17.
[21]He JF, Luo YM, Wan XH, et al. Biogenesis of miRNA-195 and its role in biogenesis, the cell cycle, and apoptosis[J]. J Biochem Mol Toxicol,2011,25(6):404-408.
[22]张 帅,李有杰,张 超,等. miRNA在去甲斑蝥素致K562细胞凋亡中的作用研究[J]. 中国病理生理杂志,2011,27(3):499-503.
[23]Bi Q, Tang S, Xia L, et al. Ectopic expression of miR-125a inhibits the proliferation and metastasis of hepatocellular carcinoma by targeting MMP11 and VEGF[J]. PLoS One,2012,7(6):e40169.
DifferentialmicroRNAexpressionprofileinlaryngealcancerandeffectofmiR-125a-5ponproliferationoflaryngealcancercellline
ZHANG Si-yi1,2, LU Zhong-ming1,2, SONG Xin-han2, ZHANG Hong-bin2, CHEN Liang-si2, LUO Xiao-ning2, CHEN Shao-hua2, WU Yi-long3
(1SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofOtorhinolaryngology,3GuangdongLungCancerInstitute,GuangdongGeneralHospital&GuangdongAcademyofMedicalSciences,Guangzhou510080,China.E-mail:syylwu@live.cn;szhang555@hotmail.com)
AIM: To investigate the differential microRNA expression profiles between laryngeal cancer and adjacent normal laryngeal mucosa.METHODSForty two pairs of laryngeal cancer tissue and adjacent normal laryngeal mucosa tissue were collected. Ten pairs of samples were used for determining microRNA expression by the method of miRNA microarray chip. Data analysis was performed to find out the significant differential microRNA expression profile in laryngeal cancer, and the difference was verified by quantitative real-time PCR (qRT-PCR) analysis on another 32 pairs of samples. Methyl thiazolyl tetrazolium (MTT) assay and colony-forming assay were used to analyze the proliferation of Hep2 cells induced by miR-125a-5p.RESULTSBoth miRNA microarray and qRT-PCR showed that the expression of let-7f-5p, miR-10a-5p, miR-125a-5p, miR-144-3p, miR-195-5p and miR-203 was down-regulated in laryngeal cancer tissues. miR-125a-5p suppressed the proliferation of Hep2 cells.CONCLUSIONThe results of microarray are accordant with those of qRT-PCR. Significant difference of miRNA expression profiles between laryngeal cancer and adjacent normal laryngeal mucosa indicates that miRNAs may play a role in carcinogenesis and progression of laryngeal cancer. miR-125a-5p inhibits the proliferation of Hep2 cell, indicating a novel therapeutic target against laryngeal cancer.
Laryngeal neoplasms; MicroRNA; Microarray chip; Cell proliferation
R363
A
10.3969/j.issn.1000- 4718.2013.01.014
1000- 4718(2013)01- 0086- 07
2012-09-24
2012-11-19
广东省科技计划(No.2011B031800148);2011年第二批省级财政产业技术研究与开发专项资金(No.Z012011254)
△ 通讯作者 吴一龙 Tel: 020-83827812;E-mail: syylwu@live.cn; 张思毅 Tel: 020-83827812;E-mail: szhang555@hotmail.com

