胰岛素控制血糖对糖尿病大鼠肾组织Smad7表达及纤维化病变的影响*
王圆圆, 李 霜, 刘丽荣, 苏 博, 石 磊, 石明隽, 肖 瑛, 张国忠, 郭 兵
(贵阳医学院病理生理学教研室,贵州 贵阳 550004)
胰岛素控制血糖对糖尿病大鼠肾组织Smad7表达及纤维化病变的影响*
王圆圆, 李 霜, 刘丽荣, 苏 博, 石 磊, 石明隽, 肖 瑛, 张国忠, 郭 兵△
(贵阳医学院病理生理学教研室,贵州 贵阳 550004)
目的观察胰岛素控制糖尿病大鼠血糖后是否能上调肾组织Smad7的表达,减轻或延缓糖尿病肾病(DN)肾纤维化病变的发生发展。方法链脲菌素复制大鼠糖尿病模型,随机分为糖尿病组(DM组) 和胰岛素治疗组(INS组) (n=8);INS组于成模13周起用胰岛素将血糖控制在4~7 mmol/L;同时设正常对照组(NC组)(n=8)。17周处死大鼠,检测相应生化指标,观察胰腺和肾组织病理学改变,免疫组化和Western blotting检测各组大鼠肾组织组织转化生长因子β1(transforming growth factor β1, TGF-β1)、Smad泛素化调节因子2(Smad ubiquitin regulatory factor 2, Smurf2)、Smad7、 E-钙黏蛋白(E-cadherin)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、层连蛋白(fibronectin, FN)和胶原蛋白Ⅰ(collagenⅠ)的蛋白表达。结果与NC组比较,DM组大鼠体重显著减轻,24 h尿蛋白、血糖和甘油三酯显著升高(P<0.05),病理检查显示胰岛被破坏,肾组织TGF-β1、Smurf2、α-SMA、FN和collagenⅠ蛋白的表达均显著增加(P<0.05),并伴有肾小管Smad7和E-cadherin的表达减少(P<0.05);而经胰岛素控制血糖后,INS组大鼠较DM组体重逐渐增加,24 h尿蛋白和血糖均显著降低 (P<0.05),肾纤维化病变明显改善,TGF-β1、Smurf2、α-SMA、FN和collagenⅠ蛋白的表达均显著减少(P< 0.05),Smad7和E-cadherin的表达显著上调(P<0.05)。结论控制血糖能恢复糖尿病大鼠肾组织Smad7蛋白表达水平,减少细胞外基质的沉积,延缓DN的纤维化进展,其机制可能与肾组织中TGF-β1和Smurf2表达降低、Smad7蛋白的泛素化降解减少有关。
糖尿病肾病; 转化生长因子β; Smad7; 胰岛素
糖尿病肾病(diabetic nephropathy, DN) 已成为导致终末期肾衰竭及糖尿病(diabetes mellitus, DM)病死率增加的重要原因。积极防治DN的纤维化病变,对患者的转归具有重要意义。DN的发病机制未完全阐明,研究发现,转化生长因子 β1(transforming growth factor β1, TGF-β1) / Smads介导的细胞信号通路在DN发病中发挥着关键的致纤维化效应[1-2]。Smad7作为抑制性Smad蛋白,可以抑制TGF-β1/Smads介导的生物学效应,然而在多种肾纤维化疾病过程中,Smad7的蛋白表达显著下调[1,3]。近年研究表明控制血糖可部分逆转糖尿病肾纤维化病变[4],但有关血糖控制与糖尿病大鼠肾损伤的关系尚需进一步研究。本文旨在观察胰岛素控制糖尿病大鼠血糖后是否能减轻或延缓DN肾纤维化病变的发生发展,并以Smad7为靶点,探讨其可能机制。
材 料 和 方 法
1材料
1.1实验动物 健康清洁级雄性SD大鼠24只,体重(180±20) g,由北京华阜康生物科技股份有限公司提供,批号为SCXK(京)2009-0004。
1.2主要试剂 链脲菌素(streptozotocin, STZ;Sigma);甘精胰岛素(Novo Nordisk);TGF-β1多克隆抗体、β-actin单克隆抗体和DAB显色剂(博士德公司);Smad7、E-钙黏蛋白(E-cadherin)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、层连蛋白(fibronectin, FN)和胶原蛋白Ⅰ(collagenⅠ)多克隆抗体(博奥森生物技术有限公司);Smurf2抗体(Abcam);两步法免疫组化检测试剂(中杉金桥生物技术有限公司);Western印迹用PVDF膜和3 mm Whatman滤纸 (Millipore);超敏ECL化学发光试剂盒(碧云天生物研究所)。
1.3主要器材 稳步倍加型血糖仪(强生公司),超低温冰箱(Sanyo),高速低温离心机(Beckman),Bayer 1650全自动生化分析仪(Beckman),电泳系统及电转移装置(Amersham),凝胶成像系统(Bio-Rad)。
2方法
2.1糖尿病模型的制备和分组 16只大鼠适应性饲养1周后,乙醚麻醉后尾静脉按55 mg/kg注射0.01 mol/L无菌柠檬酸-柠檬酸钠缓冲液(pH 4.5)的STZ。48 h后测空腹血糖,血糖值≥16.7 mmol/L为糖尿病大鼠模型成功。随机分成糖尿病组(DM组)和胰岛素治疗组(INS组), 每组8只动物,INS组从第13周起开始皮下注射甘精胰岛素,实行个体化剂量,以血糖控制在4~7 mmol/L、尿糖阴性为准;DM组同时注射溶媒。并设相同鼠龄正常对照组(NC组)(n=8),操作同上。各组大鼠均给予普通饲料,自由饮水。
2.2大鼠的血、尿、胰腺和肾组织收集 实验17周时处死动物。处死前收集24 h尿液,记录尿量。禁食6~8 h,称重,麻醉后股动脉穿刺采集血液,4 ℃离心,分离血清,尿液和血清于-20 ℃保存供检测尿蛋白及生化指标用。开腹取胰腺和肾脏,胰腺及一侧肾脏固定于4%多聚甲醛供制作石蜡切片用,另一肾脏于-80 ℃保存供Western印迹检测。
2.3生化指标检测 氧化酶法测血清葡萄糖(blood glucose,BG); CHOD-PAP法测血总胆固醇(choleste-rol,CHO);GOD-PAP法测血甘油三酯(triglyceride,TG);考马斯亮蓝法测尿蛋白(urine protein,UP),均按试剂说明书操作。UP与24 h尿量乘积为24 h UP。
2.4胰腺和肾组织形态学观察 胰腺和肾脏组织行石蜡切片,HE染色后光镜下观察胰腺和肾组织形态结构的改变,Masson染色观察肾组织的纤维化病变。
2.5免疫组化染色 采用免疫组化SP法检测TGF-β1(1∶50)、Smad7(1∶200)、E-cadherin(1∶75)、α-SMA (1∶100)和collagenⅠ(1∶100)在各组大鼠肾组织的分布和表达,PBS作为阴性对照,DAB显色,苏木素复染。TGF-β1、FN和collagenⅠ阳性表达计数方法参考本实验室以前的研究[5],取10个高倍(400倍)视野,取均值。
2.6Western blotting检测 取-80 ℃保存的各组大鼠肾皮质,每组100 mg,分别加入组织蛋白提取液后匀浆、离心、取上清,用BCA试剂盒(碧云天)测定各组蛋白质浓度,按所测得浓度计算每泳道所需体积,加入加样缓冲液煮沸10 min。经10%SDS-PAGE凝胶电泳分离,再转移至PVDF膜上,脱脂奶粉室温封闭1 h,加入Smad7、Smurf2、E-cadherin、α-SMA或β-actinⅠ抗,工作浓度分别为1∶200、1∶600、1∶100、1∶150和1∶300,4 ℃孵育过夜。次日用TBST洗膜后,加入相应的辣根过氧化物酶标记的Ⅱ抗(浓度均为1∶5 000)室温孵育1 h,再加入ECL化学发光试剂,暗室曝光,Bio-Rad凝胶成像系统扫描胶片,Quantity One软件分析各条带的面积和灰度值,两者乘积为积分灰度值,每个样本重复操作3 次。同一张胶上Smad7、Smurf2、E-cadherin、α-SMA与相应的β-actin条带所测积分灰度值的比值,即相应蛋白的相对表达量。
3统计学处理
用SPSS 13.0 统计软件处理,数据以均数±标准差(Mean±SD)表示,多组比较采用单因素方差分析(方差齐时,采用SNK-q检验;不齐时,采用Games-Howell检验),以P<0.05为差异有统计学意义。
结 果
1大鼠一般情况和相关生化指标的检测
糖尿病大鼠模型复制成功后,DM组大鼠逐渐出现多饮、多尿、多食等现象,较相同鼠龄NC组,DM组大鼠体重显著减轻(P<0.05),而INS组给予胰岛素控制血糖后,大鼠多饮、多尿、多食现象有所改善,体重逐渐增加,在治疗4周(总16周)后有统计学意义(P<0.05); DM组24 h UP、BG和TG显著高于NC组(P<0.05),而与DM组大鼠相比,INS组BG和24 h UP均显著降低(P<0.05),如见图1。
2糖尿病大鼠胰腺组织和肾组织病理学改变
胰腺HE染色可见NC组大鼠胰岛完整,轮廓规则整齐,胰岛内细胞排列整齐,胞浆饱满,细胞界限清楚,而DM组胰岛内形态欠规则,细胞排列紊乱,常有细胞缺失、塌陷及炎症细胞浸润,见图2。肾组织HE染色显示NC组肾脏结构清晰完整,DM组大鼠部分肾小管扩张,肾小管上皮细胞(renal tubular epithelial cell, RTEC)空泡变性,细胞萎缩和脱落,小管间质细胞增多伴有炎症细胞的浸润,毛细血管基底膜增厚,INS组病变明显减轻。肾组织Masson染色显示NC组肾小球完整,清晰,RTEC饱满,而DM组肾脏结构排列不清,可见肾小球和肾小管纤维化明显,INS组病变减轻,见图2。

Figure 1. Levels of metabolic and renal parameters. A: body weight of rats in each group at each equal time;B: levels of 24 h urine protein(24 h UP), blood glucose(BG), cholesterol(CHO), triglyceride(TG) in each group.Mean±SD.n=8.*P<0.05vsNC group;▲P<0.05vsDM group.
图1各组大鼠代谢和肾脏参数
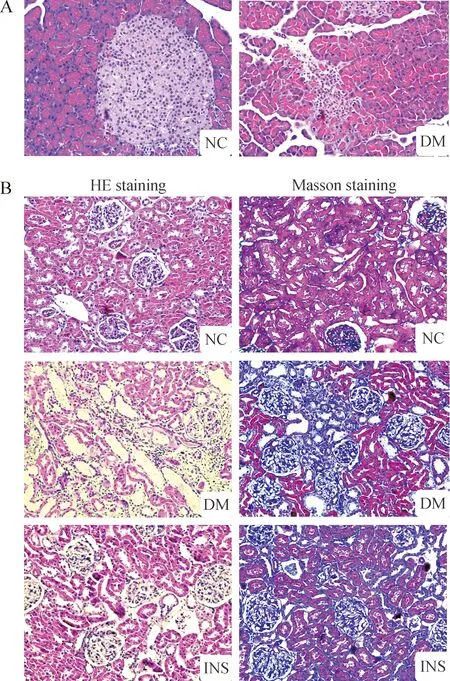
Figure 2. Histological changes of rat pancreatic (A; HE staining,×200) and renal (B; HE staining and Masson staining, ×200) tissues.
图2各组大鼠胰腺和肾组织形态学变化
3TGF-β1、FN、collagenI、E-cadherin和α-SMA蛋白在各组大鼠肾组织中的表达
免疫组化结果提示,NC组大鼠肾组织TGF-β1极少表达, FN和collagenⅠ的阳性染色仅少量存在于细胞间质;DM组大鼠肾组织TGF-β1、FN和collagenⅠ的表达明显增加,均显著高于NC组(P<0.05);而INS组大鼠肾组织TGF-β1、FN和collagenⅠ的表达较DM组明显减少(P<0.05),见图3。

Figure 3. The expression of TGF-β1, FN and collagenⅠ in renal tissues(immunohistochemical staining,×400). The arrows indicate positive expression.Mean±SD.n=8.*P<0.05vsNC group,▲P<0.05vsDM group.
图3TGF-β1、FN和collagenⅠ在各组大鼠肾组织中的表达
免疫组化显示,E-cadherin在大鼠肾组织主要表达于RTEC。Western blotting检测表明,与NC组相比,DM组大鼠肾皮质中E-cadherin蛋白的表达明显下调(P<0.05),而INS组大鼠E-cadherin蛋白表达较DM组明显增多(P<0.05),见图4。
α-SMA在正常大鼠的肾皮质表达极少,仅在血管周围见到阳性表达,而在DM组大鼠RTEC可见到大量阳性染色。Western blotting检测表明:与NC组相比,DM组大鼠肾皮质中α-SMA蛋白的表达显著增多(P<0.05),而INS组大鼠α-SMA表达较DM组显著减少(P<0.05),见图5。
4Smad7和Smurf2蛋白在各组大鼠肾组织中的表达
与NC组相比,DM组大鼠肾皮质中Smad7蛋白的表达明显下调(P<0.05),仅为正常时的48%;INS组大鼠Smad7蛋白表达较DM组明显增多(P<0.05),见图6。
Smurf2在DM组大鼠肾组织表达增加,显著高于NC组(P<0.05),而INS组大鼠肾组织Smurf2表达较DM组明显减少(P<0.05),见图7。
讨 论
本研究用STZ尾静脉注射复制大鼠DM模型,DM大鼠血糖显著升高且尿糖阳性,胰腺组织切片可见胰岛缩小,β细胞数量减少,同时出现明显的蛋白尿,血肌酐显著升高,肾组织中FN和collagenⅠ蛋白表达增多,提示糖尿病大鼠出现肾纤维化的病理改变,并发有DN。
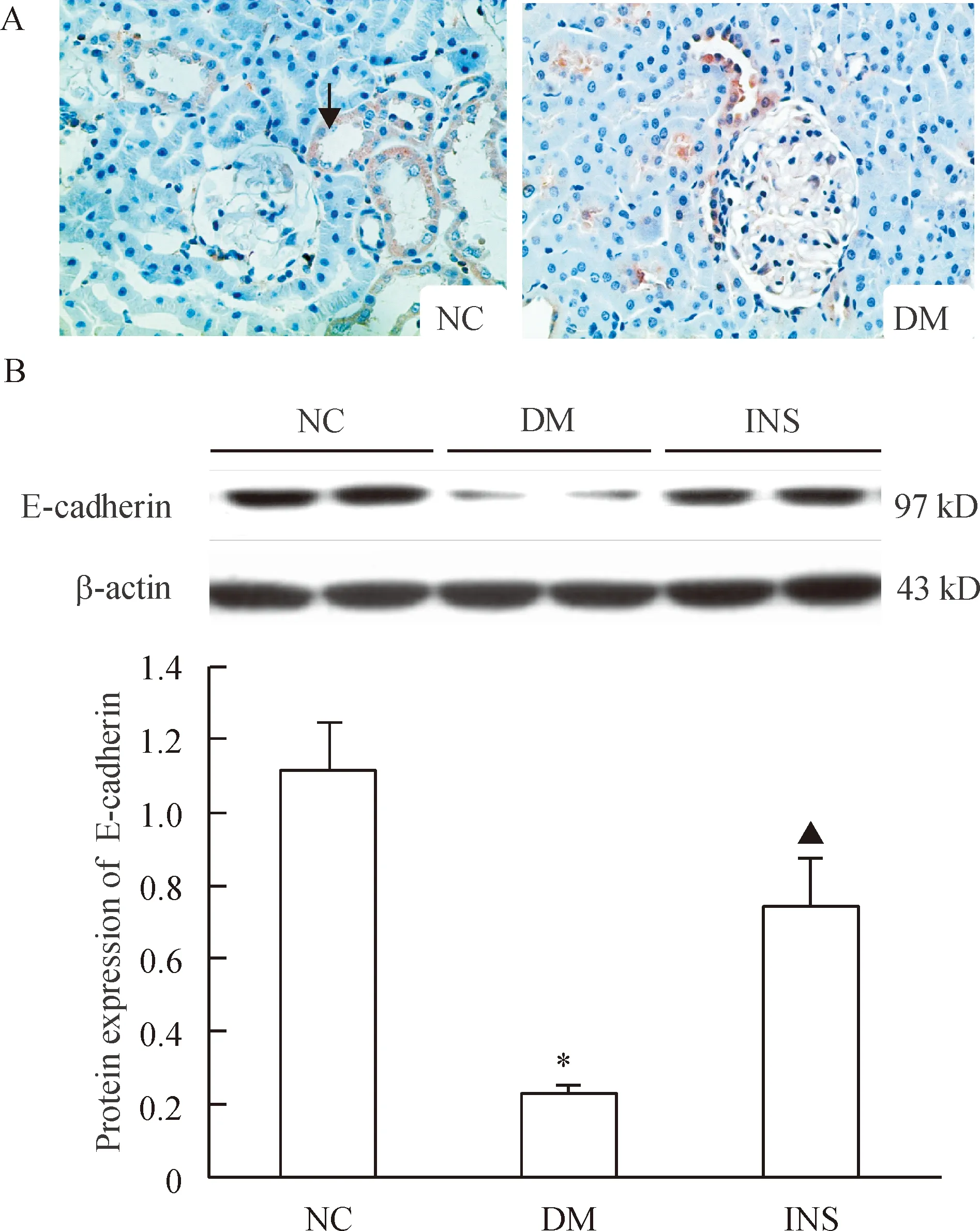
Figure 4. The level of E-cadherin expression in rat renal tissues. A: Immunohistochemical staining(×400). The arrow indicates positive expression. B: Western blotting.Mean±SD.n=8.*P<0.05vsNC group;▲P<0.05vsDM group.
图4E-cadherin在肾组织中的分布及在各组大鼠肾组织中的表达
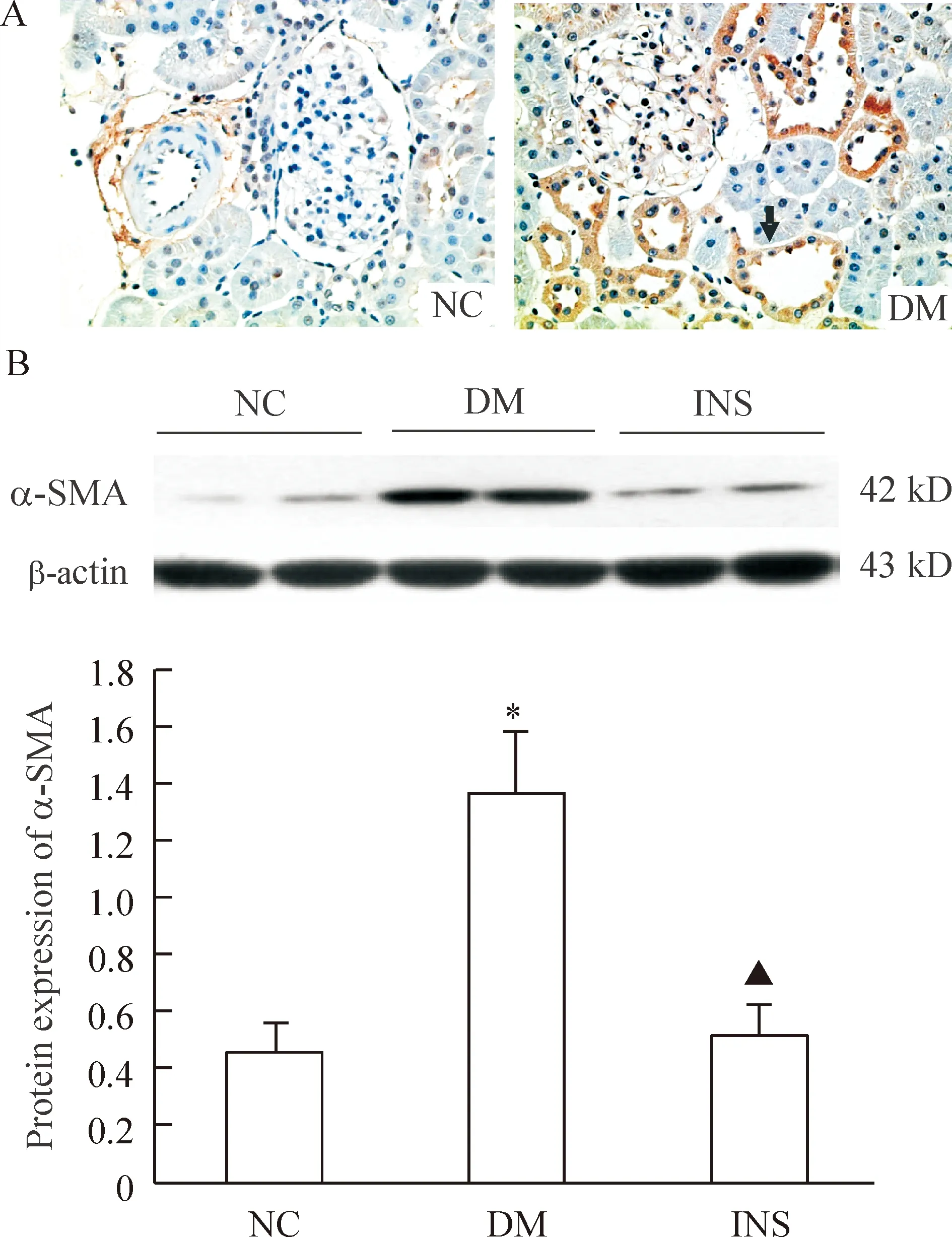
Figure 5. The level of α-SMA expression in rat renal tissues. A: immunohistochemical staining (×400). The arrow indicates positive expression. B: Western blotting.Mean±SD.n=8.*P<0.05vsNC group;▲P<0.05vsDM group.
图5α-SMA在肾组织中的分布及在各组大鼠肾组织中的表达

Figure 6. The level of Smad7 expression in rat renal tissues. A: immunohistochemical staining (×400). The arrow indicates positive expression. B: Western blotting.Mean±SD.n=8.*P<0.05vsNC group;▲P<0.05vsDM group.
图6Smad7在肾组织中的分布及在各组大鼠肾组织中的表达

Figure 7. The level of Smurf2 expression in rat renal tissues detected by Western blotting.Mean±SD.n=8.*P<0.05vsNC group;▲P<0.05vsDM group.
图7Smurf2在各组大鼠肾组织中的表达
大量研究表明,TGF-β1在严重的肾纤维化病程中表达均上调,发挥多种致纤维化效应,成为肾纤维化疾病发生过程中的重要细胞因子[1-3]。在DM状态下,高糖介导多种细胞表达TGF-β1, TGF-β1通过跨膜的Ⅱ型(TβRⅡ)和Ⅰ型(TβRⅠ)受体激活其下游的Smad2/3,Smad2/3随后与Smad4形成复合物转移入细胞核中参与TGF-β1目的基因的转录活化而发挥其致纤维化效应。我们的研究结果显示,糖尿病大鼠16周时,其肾组织中TGF-β1表达显著增加,RTEC表达的上皮细胞标志物E-cadherin显著减少,而间质细胞标志物α-SMA出现高表达,提示RTEC向间质细胞转分化(epithelial to mesenchymal transition, EMT)的发生,且FN和collagenⅠ在肾间质也显著增加,表明细胞外基质(extracellular matrix, ECM) 的沉积增多[2,6-7]。由RTEC经EMT过程发展而来的成纤维细胞活化后,可诱导ECM的产生,进一步加重肾脏的纤维化[8]。因此,对抗TGF-β1的致纤维化效应已成为防治肾纤维化的研究热点。
Smad7蛋白作为抑制性Smad,可通过多个环节对抗TGF-β1/Smad信号通路的效应:Smad7可与TβRI形成一个稳定复合物,从而抑制其招募及磷酸化R-Smad及R-Smad-Smad4复合物的形成[9],并且与TβRI 结合的Smad7能作为配体招募WW-HECT型E3泛素连接酶介导对TβRI的降解[10],同时有多种蛋白通过与Smad7结合而调节TβRI的活性和稳定性[11];而在细胞核内,Smad7能通过MH2结构域绑定到特定的DNA结构域,与去乙酰酶抑制剂及其它一些转录共抑制因子共同抑制TGF-β1/Smad目的基因的转录[12]。近年来研究发现Smad7在肾纤维化疾病进程中表现出抑制纤维化病变的作用[1,3]。Liu等[2]将特异性作用于肾脏包含Smad7基因的质粒转染db/db小鼠后,发现由TGF-β1/Smad2/3介导的肾纤维化病变明显减轻[2];在DN进程中,发现将Smad7基因敲除能增强TGF-β1/Smad2/3介导的肾脏损害,包括:尿蛋白出现、肾小球和肾小管间质collagenⅠ、collagenⅣ、FN的沉积,而过表达Smad7基因能减轻上述病理改变[13]。这些研究提示:Smad7作为TGF-β1/Smad信号通路的负调节因子,其蛋白表达的水平决定了TGF-β1的生物效应。本实验中,我们发现Smad7蛋白在DN时表达明显减少,仅为正常时的48%,从而使TGF-β1过激活Smad2/3,诱导了EMT的发生和ECM的沉积,促进DM时肾组织的纤维化。Fukasawa等[14]的研究结果显示,在单侧输尿管梗阻(unilateral ureteral obstruction, UUO)模型的肾组织中Smad7蛋白的表达进行性减少,但其mRNA的表达上调,进一步研究发现Smad蛋白的减少是由于E3泛素连接酶介导的泛素化降解增强所致,而加入蛋白酶体抑制剂会抑制Smad7的降解,Liu等[1]也有相同的发现。但是,也有作者得出不同的研究结果,他们发现UUO模型可以导致Smad7 mRNA的表达减少[15-16]。本实验的免疫印迹结果发现:E3泛素连接酶Smurf2在DN时的表达显著增多,提示DN时表达上调的Smurf2可能增强了对Smad7蛋白的降解作用,导致Smad7蛋白表达明显减少,进而使TGF-β1/Smad信号通路失去控制,促进了DN的发生发展。但是,Smad7蛋白在DN的表达减少是由于E3泛素连接酶介导的泛素蛋白酶途径对其蛋白的降解作用,还是同时有mRNA表达下调两者共同作用的结果,目前并不清楚,将有待于我们进一步研究。
我们于DM成模12周后,开始胰岛素干预,通过对大鼠个体化治疗将其血糖降至正常范围,观察控制血糖是否能减缓DN的发生发展。随着胰岛素治疗时间的延长,与DM组大鼠相比,INS组大鼠多饮、多尿、多食现象有所改善,体重逐渐增加、24 h UP显著降低,TG和CHO表现出减少的趋势,提示大鼠的代谢功能明显改善,并且肾组织HE和Masson染色显示,肾脏纤维化病变明显减轻。同时,大鼠肾组织中Smad7蛋白的表达显著上调,TGF-β1和Smurf2表达显著减少,而RTEC表达的E-cadherin增加,α-SMA表达减少,FN 、collagenⅠ在肾间质的沉积减少。表明控制血糖可以延缓甚至逆转DN的发展,其机制可能是由于TGF-β1和Smurf2表达下调,抑制性调节蛋白Smad7表达水平恢复等共同作用的结果。
综上所述,糖尿病大鼠肾组织TGF-β1和Smurf2表达增加,上调的Smurf2可能通过增强对Smad7蛋白的泛素化降解而促进DN的发生发展;控制血糖可通过降低肾组织中TGF-β1及Smurf2的表达而恢复Smad7蛋白表达水平,减少ECM的沉积,延缓DN的纤维化进展。但是,Smad7蛋白在DN的表达减少是由于在蛋白水平的降解增加,还是同时有其基因水平的表达下调的综合作用,有待进一步研究证实。
[1] Liu FY, Li XZ, Peng YM, et al. Arkadia regulates TGF-beta signaling during renal tubular epithelial to mesenchymal cell transition[J]. Kidney Int, 2008, 73(5): 588-594.
[2] Liu R, Wang Y, Xiao Y, et al. SnoN as a key regulator of the high glucose-induced epithelial-mesenchymal transition in cells of the proximal tubule[J]. Kidney Blood Press Res, 2012, 35(6): 517-528.
[3] Ka SM, Yeh YC, Huang XR,et al. Kidney-targetingSmad7 gene transfer inhibits renal TGF-β/SMAD homologue (SMAD) and nuclear factor κB (NF-κB) signalling pathways, and improves diabetic nephropathy in mice[J]. Diabetologia, 2012, 55(2): 509-519.
[4] Chatziantoniou C, Dussaule JC. Insights into the mechanisms of renal fibrosis: is it possible to achieve regression?[J]. Am J Physiol Renal Physiol, 2005, 289(2): F227-F234.
[5] 王圆圆,刘瑞霞,郭 兵,等.大鼠肾组织PETN表达下调在糖尿病肾病发展中的作用[J].生理学报, 2011, 63(4): 325-332.
[6] 刘瑞霞,郭 兵,王圆圆,等.SnoN对高糖诱导大鼠原代肾小管上皮细胞纤维连接蛋白合成的影响[J].中国病理生理杂志, 2011,27(10):1931-1937.
[7] 刘瑞霞,郭 兵,崔 龙,等.SnoN蛋白在糖尿病大鼠肾组织中的表达及其意义[J].中国病理生理杂志,2008,23(3):1188-1192.
[8] López-Hernández FJ, López-Novoa JM. Role of TGF-β in chronic kidney disease: an integration of tubular, glomerular and vascular effects[J].Cell Tissue Res, 2012, 347(1): 141-154.
[9] Nakao A, Afrakhte M, Moren A, et al. Identification of Smad7, a TGFβ-inducible antagonist of TGF--β signalling[J]. Nature, 1997, 389(6651): 631-635.
[10]Wrighton KH, Lin X, Feng XH. Critical regulation of TGFβ signaling by Hsp90[J].Proc Natl Acad Sci U S A, 2008, 105(27): 9244-9249.
[11]Kowanetz M, Lonn P, Vanlandewijck M, et at. TGFβ induces SIK to negatively regulate type I receptor kinase signaling[J]. J Cell Biol,2008,182(4): 655-662.
[12]Kume S, Haneda M, Kanasaki K,et al. SIRT1 inhibits transforming growth factor β-induced apoptosis in glomerular mesangial cells via Smad7 deacetylation[J]. J Biol Chem, 2007,282(1): 151-158.
[13]Chen HY, Huang XR, Wang W, et al. The protective role of Smad7 in diabetic kidney disease: mechanism and therapeutic potential[J].Diabetes, 2011, 60(2): 590-601.
[14]Fukasawa H, Yamamoto T, Togawa A, et al. Down-regulation of Smad7 expression by ubiquitin-dependent degradation contributes to renal fibrosis in obstructive nephropathy in mice[J].Proc Natl Acad Sci U S A, 2004, 101(23): 8687-8692.
[15]Yang F, Huang XR, Chung AC, et al. Essential role for Smad3 in angiotensin II-induced tubular epithelial-mesenchymal transition[J]. J Pathol, 2010, 221(4): 390-401.
[16]宁旺斌, 陶立坚, 刘春燕, 等.依那普利对大鼠肾间质纤维化中TGF-β1,p-Smad2/3及Smad7的作用.[J]中南大学学报:医学版,2009, 34(1): 27-34.
EffectofbloodglucosecontrolonexpressionofSmad7andrenalfibrosisindiabeticrats
WANG Yuan-yuan, LI Shuang, LIU Li-rong, SU Bo, SHI Lei, SHI Ming-jun, XIAO Ying, ZHANG Guo-zhong, GUO Bing
(DepartmentofPathophysiology,GuiyangMedicalCollege,Guiyang550004,China.E-mail:guobingbs@126.com)
AIM: To verify the hypothesis that treatment with insulin to control the blood glucose (BG) may relieve or slow down the development of diabetic nephropathy (DN) in diabetic rats by increasing the expression of Smad7.METHODSThe diabetic rat model was established by tail-vein injection of streptozotocin. Sixteen rats were divided into 2 groups. Eight of these animals in diabetes mellitus (DM) group had no treatment. The remaining eight of them in insulin treatment (INS) group were injected with insulin. After 13 weeks, the rats in INS group were given individual treatment with insulin to let the blood glucose level keep within 4 to 7 mmol/L. Meanwhile, 8 rats were used for normal control (NC group). After 16 weeks, the rats were sacrificed to detect the relevant biochemical parameters, and to observe the histophathological changes of the kidney and pancreas. In addition, immunohistochemical staining and Western blotting were employed to detect the protein expression of transforming growth factor β1(TGF-β1), Smad ubiquitin regulatory factor 2 (Smurf2), Smad7, E-cadherin, α-sooth muscle actin (α-SMA), fibronectin (FN) and collagen I.RESULTSCompared with NC group, the body weight was significantly reduced in DM group, whereas the body weight in INS group increased gradually. Compared with NC group, the levels of 24 h urine protein (24 h UP), BG and triglyceride (TG) were remarkably increased in DM group. Pathological detection on pancreas indicated that the islet was destroyed. The levels of TGF-β1, Smurf2, α-SMA, FN and collagenⅠ in the kidneys were increased in DM group, and the expression of Smad7 and E-cadherin, which were mainly located in renal tubular epithelial cells, was significantly reduced. Compared with DM group, the levels of 24 h UP and BG were significantly reduced in INS group, and the alleviated renal fibrosis was observed under light microscope. In addition, the protein levels of TGF-β1, Smurf2, α-SMA, FN and collagenⅠ in INS group were decreased compared with DM group, and the expression of Smad7 and E-cadherin was increased significantly.CONCLUSIONTarget glucose control with insulin treatment restores the protein expression of Smad7 in the kidney of diabetic rats, reduces the accumulation of extracellular matrix and slows down DN progress. The decrease in TGF-β1and Smurf2 expression, and the attenuation of Smad7 ubiquitination in renal tissues are the crucial parts in this process.
Diabetic nephropathies; Transforming growth factor beta; Smad7; Insulin
R363.2+1
A
10.3969/j.issn.1000-4718.2013.01.007
1000- 4718(2013)01- 0043- 07
2012-09-02
2012-10-14
国家自然科学基金资助项目(No.81160094);贵州省优秀科技教育人才省长专项基金资助项目(No.黔省专合字 [2010]40号)
△通讯作者 Tel: 0851-6908348; E-mail: guobingbs@126.com

