HGF基因转染对裸鼠人淋巴瘤移植瘤的促进作用*
赵 行, 郑筱娇, 高 洲, 沈蓉蓉, 岑 东,△, 裴仁治, 罗建平, 吕建新
(1温州医学院浙江省医学遗传学重点实验室,浙江 温州 325027; 2温州医学院附属乐清医院,乐清市人民医院,浙江 乐清 325600; 3宁波市鄞州区疾病预防控制中心,浙江 宁波 315100; 4宁波市鄞州人民医院,浙江 宁波 315040)
HGF基因转染对裸鼠人淋巴瘤移植瘤的促进作用*
赵 行1,2, 郑筱娇1, 高 洲1, 沈蓉蓉1, 岑 东1,3△, 裴仁治3, 罗建平4, 吕建新1
(1温州医学院浙江省医学遗传学重点实验室,浙江 温州 325027;2温州医学院附属乐清医院,乐清市人民医院,浙江 乐清 325600;3宁波市鄞州区疾病预防控制中心,浙江 宁波 315100;4宁波市鄞州人民医院,浙江 宁波 315040)
目的探讨肝细胞生长因子(HGF)基因转染对裸鼠人淋巴瘤移植瘤的促进作用及其机制。方法采用HGF基因重组质粒pVITRO2-HGF转染的Raji细胞建立裸鼠皮下人淋巴瘤移植瘤模型,动态监测裸鼠体重和肿瘤大小;8周后获取瘤组织,分别采用脱氧核糖核酸末端转移酶介导的缺口末端标记技术(TUNEL) 和免疫组化检测移植瘤组织的细胞凋亡和微血管密度(MVD),并进行相关分析。结果造模成功率为96.7%。HGF转染组的瘤体积明显大于HGF转染+VP-16组(P<0.01)、未转染组与空载体组(P<0.01),HGF转染+VP-16组也大于对照组(P<0.01),未转染组与空载体组间无显著差异(P>0.05)。pVITRO2-HGF转染组凋亡指数显著低于对照组(P<0.01),经VP-16诱导后凋亡增加(P<0.01),但仍低于对照组(P<0.01)。pVITRO2-HGF转染组的MVD显著高于对照组(P<0.01),但经VP-16诱导后血管增生降低(P<0.01),但仍高于对照组 (P<0.05),对照组间无显著差异(P>0.05) 。结论HGF基因转染可显著促进裸鼠人淋巴瘤移植瘤的生长,明显抑制凋亡的发生,这一效应可能与其促进肿瘤血管新生和抑制肿瘤细胞凋亡有关。
肝细胞生长因子; 基因转染; 淋巴瘤; 裸鼠; 异种移植物
肝细胞生长因子(hepatocyte growth factor,HGF)或称分散因子(scatter factor,SF),是一种多功能生长因子,通过酪氨酸激酶途径,具有促进肝细胞、上皮细胞、造血细胞等多种类型细胞的生长、迁移和形态发生的作用[1-3]。它还参与多种细胞的增殖、迁徙,对各类肿瘤的侵袭转移有着重要的诱导作用,表明其在癌症中扮演着重要角色。在体外的探索性实验中,发现HGF转染人淋巴瘤Raji细胞明显促进增殖、迁徙、侵袭以及抗凋亡作用[4-5]。依托泊苷(etoposide,VP-16)是鬼臼毒素的半合成衍生物, 具有广谱的抗肿瘤活性,近年来常用于血液系统恶性肿瘤和实体瘤的治疗。在此基础上,我们拟建立人淋巴瘤Raji细胞裸鼠移植瘤模型,拟在动物水平上观察研究HGF基因对淋巴瘤生长的促进作用及其对VP-16诱导的肿瘤细胞凋亡的抑制作用。
材 料 和 方 法
1材料
人淋巴瘤细胞系Raji细胞购自中科院上海细胞所;3周龄雄性BALB/c-nu/nu裸鼠购自中科院上海实验动物中心,置SPF条件饲养;转染HGF基因重组质粒pVITRO2-HGF和质粒pVITRO2的淋巴瘤细胞已由本室构建;蛋白酶K、DAB Kit和MaxVision试剂盒(兔)购自福建迈新公司;RPMI-1640购自Gibco,新生胎牛血清购自杭州四季青生物工程公司;Vybrant凋亡检测试剂盒购自Invitrogen;原位细胞凋亡检测试剂盒购自Roche;兔抗人CD34单克隆抗体购自Epitomics;VP-16购自江苏恒瑞公司;潮霉素B(50 g/L)购自Amersco。
2方法
2.1细胞的常规静置培养 于50 mL培养瓶中用5 mL含10% BCS的RPMI-1640培养Raji细胞,37 ℃、5% CO2常规静置培养。待细胞培养液颜色转黄或细胞呈巨大团状时,用吸管轻轻吹打,直至变成单个细胞,转移置15 mL一次性离心管中,1 000 r/min离心5 min,弃上清液,加入2 mL新鲜培养液,混匀,取1 mL混匀液置新培养瓶中,加入4 mL培养液,37 ℃、5% CO2常规静置培养。取对数生长期细胞(镜下细胞干净而透亮)进行相关实验。
2.2人淋巴瘤裸鼠皮下移植瘤模型的建立 构建3组模型:以未转染Raji细胞组和pVITRO2-mcs转染组为对照组,以HGF转染组为实验组,对照组每组5只,实验组每组10只。分别将处对数生长期各组细胞以1 500 r/min,离心5 min,收集,无血清RPMI-1640培养液洗涤2次,重悬于无血清RPMI-1640中,调整细胞浓度为5×1010/L,按组皮下接种于10只BALB/c-nu/nu裸鼠左下肢近腹股沟处,每只0.1 mL(5×106个细胞),构建裸鼠移植瘤模型。以注射等体积Raji细胞和转染pVITRO2-mcs Raji细胞为对照。处理后常规饲养,动态监测各组裸鼠的生存情况和瘤体生长情况。
2.3VP-16促凋亡处理 建模成功后将实验组分为2组,每组5只:HGF转染组和HGF转染+VP-16组。经尾静脉注射100 μL VP-16,1.2 mg ·kg-1·d-1(约每只30 μg/d,7 d),以等体积的PBS(对照组和HGF转染组)作为对照。处理后常规饲养1周。动态监测各组裸鼠的生存情况和瘤体生长情况。
2.4裸鼠体重、肿瘤体积和抑瘤率 接种各组细胞后每7 d后用游标卡尺测量肿瘤大小,并用电子称称裸鼠体重,连续观测8周后拉颈法处死全部裸鼠,剥离皮下肿瘤,测量肿瘤长、短径。肿瘤体积(volume,V)按公式计算:V(mm3)=3.14/6×a×b2,其中a为肿瘤的长径,b为短径,单位为毫米(mm)。
2.5细胞凋亡指数(apoptotic index,AI)的检测 肿瘤组织切片常规脱蜡,梯度乙醇脱水, 20 mg/L蛋白酶K室温消化,采用TUNEL检测细胞凋亡,中性树脂封固,镜下观察。以细胞核内出现棕褐色反应物为阳性,每例切片至少计数5个200倍视野,以平均每1 000个细胞核中含凋亡细胞数作为AI,同时设阴性对照和阳性对照。
2.6肿瘤微血管密度(microvessel density,MVD)的检测 肿瘤组织切片常规脱蜡,梯度乙醇脱水,3%H2O2灭活内源性过氧化物酶,采用CD34(微血管标志物)免疫组化染色,中性树脂封固,镜下观察。每张切片先在低倍镜下确定5个血管密度最高区域,再在高倍镜(200倍)下进行微血管计数。记录5个区域视野的微血管数,取其均值作为该标本的MVD,同时设阴性对照和阳性对照。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 12.0统计软件行方差齐性检验和t检验。以P<0.05为差异有统计学意义
结 果
1HGF对人淋巴瘤裸鼠模型肿瘤生长的促进作用
皮下注射2周后观察淋巴瘤裸鼠模型,造模成功率为96.7%。8周后发现,HGF转染组的瘤体积明显大于HGF转染+VP-16组(P<0.01)、未转染组与空载体组(P<0.01),HGF转染+VP-16组也大于对照组(P<0.01),未转染组与空载体组间无显著差异(P>0.05),提示HGF可促进肿瘤生长,而VP-16则使肿瘤生长受抑制,见图1、2和表1。
2细胞凋亡指数的检测
采用TUNEL法检测凋亡指数结果发现:接种8周后pVITRO2-HGF组凋亡指数显著低于对照组(P<0.01),经VP-16诱导后凋亡增加(P<0.01),但仍低于对照组(P<0.01),提示HGF基因转染可明显抑制凋亡的发生,从而促进肿瘤细胞的增殖,见图3和表2。
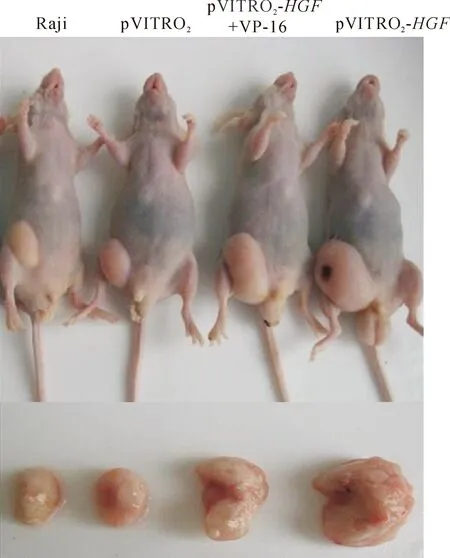
Figure 1. Effect ofHGFgene transfection on the growth of lymphoma in nude mice.
图1HGF基因转染对裸鼠模型淋巴瘤生长的作用

Figure 2. Growth curves of the transplanted tumors.Mean±SD.n=5.**P<0.01vsRaji or pVITRO2;△△P<0.01vspVITRO2-HGF.
图2移植瘤的生长曲线
表1HGF基因转染对裸鼠模型淋巴瘤生长的作用
Table 1. Effect ofHGFtransfection on the growth of lymphoma in nude mice (mean±SD.n=5)

GroupMouseweight(g)Tumorvolume(mm3)Raji26.58±1.761598±178pVITRO225.71±1.001588±72pVITRO2-HGF27.20±1.453357±489**pVITRO2-HGF+VP-1626.58±2.212252±52**△△
**P<0.01vsRaji or pVITRO2;△△P<0.01vspVITRO2-HGF.

Figure 3. Effect ofHGFgene transfection on apoptosis of lymphoma in nude mice(TUNEL, ×200). A: negative control; B: positive control; C: non-transfection group; D: pVITRO2-mcs transfection group; E: pVITRO2-mcs-HGFtransfection group; F: pVITRO2-mcs-HGFtransfection+VP-16 group.
图3HGF基因转染对淋巴瘤细胞凋亡的影响
3肿瘤微血管密度的检测
采用SP法染色检测微血管密度,结果显示:接种8周后实验组和对照组均存在不同程度的血管增生。pVITRO2-HGF组显著高于对照组(P<0.01),但经VP-16诱导后血管增生降低(P<0.01),但仍高于对照组(P<0.05);对照组间无显著差异(P>0.05),提示HGF促进移植瘤的血管新生,见图4和表2。

Figure 4. Effect ofHGFgene transfection on microvessel density of lymphoma in nude mice (SP, ×200). A: negative control; B: positive control; C: non-transfection group; D: pVITRO2-mcs transfection group; E: tumor pVITRO2-mcs-HGFtransfection group; F: pVITRO2-mcs-HGFtransfection+VP-16 group.
图4HGF基因转染对淋巴瘤微血管密度的影响
表2HGF基因转染对淋巴瘤细胞凋亡和血管形成的影响
Table 2. Effects ofHGFgene transfection on cell apoptosis and angiogenesis of lymphoma in nude mice(mean±SD.n=5)

GroupApoptoticindexMicrovesseldensityRaji81.75±22.249.00±0.82pVITRO279.75±30.838.75±2.63pVITRO2-HGF 10.40±3.36**28.25±4.35**pVITRO2-HGF+VP-16 46.05±10.94**△△18.75±3.30**△△
**P<0.01vsRaji or pVITRO2;△△P<0.01vspVITRO2-HGF.
讨 论
研究表明,HGF与肿瘤的发生、发展及预后有密切关系。HGF可促进细胞的有丝分裂、形态发生和迁徙,同时与血管抑制素具47%的同源性,具有促血管新生效应,还具有抑制细胞凋亡的生物学效应[6-8],因此,HGF对于肿瘤的发生发展有着重要的作用。
目前对细胞因子促瘤作用的研究策略主要有两类:探讨直接使用蛋白的作用[7]和研究通过载体介导基因转染后表达的间接作用[9-11]。后者目前为最常采用的,在此基础上根据导入目标基因的方式主要可分为两类:直接导入[9-10]和转染后导入[9-11]。前者方法简单,不需转染细胞,可直接进行瘤内或腹腔内注射且可反复加强,但持续表达时间短。后者的常规策略是转染相应的肿瘤细胞,然后进行体内或体外实验,虽操作较复杂,但因转入细胞后可稳定、高效表达,获得的实验结果也更为理想。
通过前期工作,我们成功构建了HGF基因的真核表达重组质粒,并建立稳定表达转染细胞株。经细胞学实验证实,HGF显著促Raji细胞的增殖、迁徙和侵袭及抑制凋亡[12-13]。在此基础上,我们欲证实HGF的体内生物学效应,因此建立淋巴瘤裸鼠移植瘤模型是关键。然而,目前未见合适的淋巴瘤裸鼠移植瘤造模方法的相关报道,也并无可供直接借鉴的资料。查阅相关文献,在常规造模方法的基础上,我们设计2种方法:鉴于淋巴瘤为恶性血液系统肿瘤,通过尾静脉注射方式造模;采用实体瘤常规造方式,采用皮下或皮内注射方式造模。经预实验发现,采用直接皮下注射,形成的瘤位置固定、成瘤时间短、造模成功率高,较尾静脉注射方式好。因此,我们选择皮下注射造模方式,并优化淋巴瘤细胞的活性、输注量、输注部位、输注方式、裸鼠品种、饲养条件等实验因素,造模成功率达96.7%,为后续实验顺利进行提供了保障。
观察裸鼠模型中瘤组织生长发现,HGF基因转染明显促进瘤组织的生长,并拮抗VP-16对肿瘤组织的抑制。TUNEL法证实,HGF可明显改善凋亡诱导剂对DNA的损伤(P<0.05),较未经诱导剂处理,凋亡指数显著降低,提示HGF基因转染可明显抑制肿瘤细胞凋亡的发生,从而促进肿瘤细胞的增殖。与此同时,观察瘤组织内微血管密度,HGF明显促进血管新生。因此,我们认为,HGF可经抑制Raji细胞和血管内皮细胞凋亡,促进淋巴瘤生长,其机制需进一步研究。
[1] Kanehira M, Xin H, Hoshino K, et al. Targeted delivery of NK4 to multiple lung tumors by bone marrow-derived mesenchymal stem cells[J]. Cancer Gene Ther, 2007, 14(11):894-903.
[2] Nakamura T, Mizuno S. The discovery of hepatocyte growth factor (HGF) and its significance for cell biology, life sciences and clinical medicine[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2010, 86(6):588-610.
[3] Wen J, Matsumoto K, Taniura N, et al. Inhibition of colon cancer growth and metastasis by NK4 gene repetitive delivery in mice[J]. Biochem Biophys Res Commun, 2007, 358(1):117-123.
[4] 沈蓉蓉, 郑筱娇, 岑 东, 等. 肝细胞生长因子基因转染对人淋巴瘤细胞凋亡的影响[J]. 中国细胞生物学学报, 2012, 34(4):325-331.
[5] 岑 东, 赵 行, 沈蓉蓉, 等.肝细胞生长因子基因转染对淋巴瘤细胞的生物学效应[J]. 浙江大学学报:医学版, 2010, 39(4):378-385.
[6] Cecchi F, Rabe DC, Bottaro DP. Targeting the HGF/Met signalling pathway in cancer[J]. Eur J Cancer, 2010, 46(7):1260-1270.
[7] Tjin EP, Groen RW, Vogelzang I, et al. Functional analysis of HGF/MET-signaling and aberrant HGF activator expression in diffuse large B cell lymphoma[J]. Blood, 2006, 107(2):760-768.
[8] Date K, Matsumoto K, Shimura H, et al. HGF/NK4 is a specific antagonist for pleiotrophic actions of hepatocyte growth factor[J]. FEBS Lett, 1997, 420(1):1-6.
[9] Du W, Hattori Y, Yamada T, et al. NK4, an antagonist of hepatocyte growth factor (HGF), inhibits growth of multiple myeloma cells: molecular targeting of angiogenic growth factor[J]. Blood, 2007, 109(7):3042-3049.
[10]Jie JZ, Wang JW, Qu JG, et al. Effect of adenoviral-mediated gene transduction of NK4 on proliferation, movement, and invasion of human colonic LS174T cancer cellsinvitro[J]. World J Gastroenterol, 2006, 12(25): 3983-3988.
[11]Okasora T, Jo JI, Tabata Y. Augmented anti-tumor therapy through natural target ability of macrophages genetically engineered by NK4 plasmid DNA[J]. Gene Ther, 2008, 15(7):524-530.
[12]滑世轩, 岑 东, 赵 行, 等. NK4基因的克隆及其在Raji细胞中的表达[J]. 中国病理生理杂志, 2009, 25(5): 970-975.
[13]罗建平, 滑世轩, 赵 行,等. NK4蛋白在大肠杆菌中的表达及其活性研究[J]. 中国生物工程杂志, 2009, 29(10): 33-37.
EffectofHGFgenetransfectiononhumanlymphomaxenograftsinnudemice
ZHAO Hang1, 2, ZHENG Xiao-jiao1, GAO Zhou1, SHEN Rong-rong1, CEN Dong1, 3, PEI Ren-zhi3, LUO Jian-ping4, LÜ Jian-xin1
(1ZhejiangProvincialKeyLaboratoryofMedicalGenetics,WenzhouMedicalCollege,Wenzhou325027,China;2AffiliatedYueqingHospitalofWenzhouMedicalCollege,YueqingMunicipalHospital,Yueqing325600,China;3YinzhouDistrictCentreforDiseaseControlandPrevention,Ningbo315100,China;4YinzhouPeople’sHospital,Ningbo315040,China.E-mail:cendong2002@163.com)
AIM: To explore the promotion effect of hepatocyte growth factor (HGF) gene transfection on human lymphoma xenografts in nude mice.METHODSThe model of human lymphoma xenograft in nude mice was established by transplantation of Raji cells, which were transfected with recombinant plasmid pVITRO2-HGFharboring theHGFgene. The body weight of the nude mice and the tumor size were dynamically monitored and the tumor tissues were obtained after 8 weeks. Additionally, the methods of terminal deoxynucleotidyl transferase-mediated nick end labeling (TUNEL) and immunohistochemistry were used to detect the apoptotic index (AI) and microvessel density (MVD).RESULTSThe success rate of the human lymphoma xenografts in nude mice was 96.7%. The tumor volume inHGFtransfection group was significantly greater than that inHGFtransfection+VP-16 group and control groups (non-transfection group and empty vector group). The tumor volume inHGFtransfection+VP-16 group was also bigger than that in control groups. No difference of the tumor volume between non-transfection group and empty vector group was observed. AI inHGFtransfection group was substantially lower than that in control groups. AI inHGFtransfection+VP-16 group showed a little higher than that inHGFtransfection group, yet was still lower than that in control groups. MVD inHGFtransfection group was extraordinary higher than that in control groups, but decreased after VP-16 induction (P<0.01), which was still higher than that in control groups.CONCLUSIONHGFgene transfection significantly promotes the growth of human lymphoma xenografts in nude mice and substantially inhibits the apoptosis presumably owing to promoting tumor angiogenesis and inhibiting tumor cell apoptosis.
Hepatocyte growth factor; Gene transfection; Lymphoma; Nude mice; Xenograft
R363
A
10.3969/j.issn.1000-4718.2013.01.013
1000- 4718(2013)01- 0081- 05
2012- 06- 27
2012- 11- 13
浙江省医药卫生科技项目(No.2007A175);宁波市科技计划(No. 2007C10065;No. 2010A610031)
△通讯作者 Tel: 0574-87418703; E-mail: cendong2002@163.com

