JNK信号通路对NaAsO2诱导NIH3T3细胞中hnRNP K蛋白聚集体形成的影响*
樊启黄, 姜 枫, 胡水旺, 唐昭亮, 姜 勇
(南方医科大学病理生理学教研室,广东省蛋白质组学重点实验室,广东 广州 510515)
JNK信号通路对NaAsO2诱导NIH3T3细胞中hnRNP K蛋白聚集体形成的影响*
樊启黄▲, 姜 枫▲, 胡水旺, 唐昭亮, 姜 勇△
(南方医科大学病理生理学教研室,广东省蛋白质组学重点实验室,广东 广州 510515)
目的观察核不均一核糖核蛋白(hnRNP)K的表达与定位以及亚砷酸钠(NaAsO2)刺激NIH3T3细胞的反应情况及氧化应激变化,探讨JNK信号通路在hnRNP K蛋白聚集体形成中的作用。方法构建重组载体pcDNA3-hnRNP K-HA,转染NIH3T3细胞,荧光显微镜观察内源性hnRNP K在细胞中的表达与定位,以及在NaAsO2不同刺激时间该蛋白聚集体的形成情况,并利用活性氧(ROS)检测试剂盒测定胞内ROS水平;给予JNK、MEK、PI3K/Akt、NF-κB和核转运等5种信号通路的抑制剂预处理后,观察聚集体的变化情况。结果重组质粒构建正确,荧光显微镜观察显示hnRNP K主要定位于胞核中,而重组质粒转染NIH3T3细胞后,可见胞内有蛋白聚集体形成并随NaAsO2刺激时间的延长而递增,且过表达hnRNP K可抑制NaAsO2刺激细胞生成ROS;JNK信号通路抑制剂SP600125明显抑制聚集体的形成。结论hnRNP K主要定位在NIH3T3细胞的胞核中,胞浆少量分布;NaAsO2可诱导NIH3T3细胞形成hnRNP K蛋白聚集体,此聚集体可抑制胞内ROS生成,且该聚集体的形成有赖于JNK介导的信号通路。
核不均一核糖核蛋白K; 亚砷酸钠; 聚集体; JNK信号通路
核不均一核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K, hnRNP K)是一种进化高度保守的核内RNA结合蛋白,属于核不均一核糖核蛋白(hnRNPs)家族成员之一[1]。该蛋白家族是存在于真核生物体内的一种多功能蛋白,目前已发现大约20种(A~U),它们具有类似的结构特征和胞内分布。研究表明,hnRNPs在多种生物学过程中担当重要角色,如新合成的mRNA前体经过加工剪接,才能成为成熟的mRNA,此过程受特异的hnRNPs所调控;hnRNP A2/B1可用于肺癌辅助诊断的标志[2]。hnRNP K与其它hnRNPs相比有不同的结构特征,它含有3个与DNA-RNA结合的KH结构域(K homology domain)KH1、KH2和KH3,1个KI域(K interactive region)和1个C端蛋白激酶连接域,这与hnRNP K的许多生物学功能息息相关,如调节基因的转录和翻译[3],参与细胞周期、细胞凋亡及肿瘤转移等细胞生物学功能调节[4],同时,在信号转导调控中发挥重要作用[5-6]。hnRNP K的研究多集中在肝癌、肺癌、慢性髓细胞白血病等恶性肿瘤中,而在如氧化应激、慢性炎症等相关研究中并未深入。Toshiyuki等[7]研究显示,荧光显微镜下可观察到hnRNP K与其结合蛋白RNA结合基序蛋白42(RNA-binding motif protein 42, RBM42),均可在亚砷酸盐刺激MTD-1 A细胞后形成应激颗粒(stress granules, SGs),且共定位于SGs中,相互独立存在。因此,本研究想通过构建hnRNP K真核表达载体,转染NIH3T3细胞,过表达hnRNP K蛋白,荧光显微镜观察亚砷酸钠(sodium arsenite, NaAsO2)刺激细胞的反应情况,并进一步探讨该现象是否与氧化应激以及应激信号通路相关。这些将为我们进一步认识hnRNP K在细胞内的相关生物学功能奠定基础。
材 料 和 方 法
1材料
SPF级6~8周C57/BL6小鼠(南方医科大学动物所);CO2培养箱(Heraeus);荧光显微镜(Zeiss);SpectraMax M5 型酶标仪(Molecular Devices);Petri皿和细胞培养皿(Corning);真核表达载体pcDNA3-HA、肠杆菌菌株DH5α和NIH3T3细胞系(本室保存);DNA ladder和Taq DNA聚合酶(TaKaRa);限制性内切酶、High DNA连接酶(TaKaRa);质粒提取试剂盒和凝胶回收试剂盒(Axygen),RNeasy Mini Kit、RT-PCT两步法试剂盒和LipofectamineTM2000转染试剂盒(Invitrogen);DMEM培养液和胎牛血清(HyClone);血凝素(hemagglutinin,HA)抗体(Cell Signaling Technology);hnRNP K兔源抗体(Bioworld Technology),Alexa Fluor 488偶联的抗兔IgG和Alexa Fluor 594偶联的抗鼠IgG(Molecular Probes);活性氧检测试剂盒(碧云天公司),其它试剂均为国产分析纯。引物合成由华大基因公司完成。
2方法
2.1小鼠肝脏组织总RNA的提取及逆转录 摘除C57/BL6小鼠眼球,放血处死,迅速取出1/4肝小叶组织,液氮速冻下研磨,加入约1 mL Trizol,用Trizol法提取总RNA。以制备的总RNA为模板,按照Toyobo RT-PCR两步法试剂盒操作说明进行RT-PCR反应获得小鼠的cDNA。
2.2pcDNA3-hnRNP K-HA重组质粒的构建 设计含有KpnI和EcoR I酶切位点的上、下游引物,以RT-PCR得到的hnRNP K cDNA为模板,扩增得到带有酶切位点的hnRNP K编码序列。上游引物5’-TT GGTACCATGGAGACCGAACAGCC-3’,下游引物5’-CGGAATTCGAAAAACTTTCCAGAATACTGCTT-3’,不含终止密码子。以Taq DNA聚合酶进行PCR反应。反应条件:94 ℃ 30 s,66 ℃ 30 s,72 ℃ 2 min,共35个循环。PCR产物经琼脂糖凝胶电泳回收后,用KpnI和EcoR I进行双酶切,载体pcDNA3-HA也同时采用KpnI和EcoR I进行双酶切,酶切产物经凝胶电泳回收后,用High DNA连接酶37 ℃连接2 h。连接产物转化DH5α感受态菌并接种到含有氨苄青霉素的LB琼脂糖培养板,37 ℃孵箱培养12 h。挑取单菌落接种于含氨苄青霉素的LB培养基中,37 ℃振摇过夜。小量提取质粒,分别进行菌液PCR、酶切及测序鉴定,构建质粒命名为pcDNA3-hnRNP K-HA。
2.3脂质体介导的瞬时转染及表达 NIH3T3细胞用含10% FBS的DMEM,于5% CO2、37 ℃孵箱中培养。转染前18~24 h,将1×105细胞铺于3.5 cm皿中,待细胞长至约70%融合时,用PBS洗3次,加入400 μL含有10% FBS的培养基,然后,分别将1.0 μg重组质粒pcDNA3-hnRNP K-HA和空载体质粒pcDNA3-HA(对照)用Opti-MEM无血清培养基稀释至终体积50 μL,转染试剂则按LipofectamineTM2000∶质粒为1∶3,溶于50 μL Opti-MEM,混匀后室温静置5 min,将分别含有质粒和转染试剂50 μL Opti-MEM充分混匀后的,于室温下孵育20 min。最后将100 μL含有DNA转染复合物的培养基加入上述3.5 cm皿中。细胞置于5% CO2、37 ℃孵箱中继续培养4~6 h后,PBS洗3次,加入2 mL含有10% FBS的培养基,于孵箱中继续培养至24 h。
2.4Western blotting检测 NIH3T3细胞转染24 h后收集细胞,Ⅰ抗anti-HA(1∶1 000)和anti-β-actin(1∶3 000)4 ℃孵育过夜后,与1∶6 000稀释的辣根过氧化物酶偶联的抗鼠IgG室温孵育70 min,用Pierce公司的SuperSignal West Pico化学发光底物进行显色,并在Kodak IS4000R图像工作站上采集图像。
2.5细胞免疫化学检测
2.5.1检测内源性hnRNP K定位实验 接种1×104细胞至Petri皿中,12 h后补液,置于孵箱中继续培养至24 h左右,弃去细胞培养上清,150 μL PBS洗涤3次,每次5 min;4%多聚甲醛固定细胞15 min,PBS洗3次;含0.1% Triton X-100的PBS(PBST)透化细胞膜5 min,PBS洗3次;3% BSA封闭2 h,PBST洗3次,然后用1% BSA稀释hnRNP K兔源抗体(1∶200)孵育2 h,PBST洗3次;用1% BSA稀释Alexa Fluor 488偶联的抗兔IgG(1∶6 000)室温孵育1 h,PBST洗3次;50 mg/L DAPI(1∶200)染核,用PBS稀释,室温染色15 min,PBS洗3次;于Zeiss荧光显微镜下观察和图像采集。
2.5.2NaAsO2刺激实验 接种转染空载体pcDNA3和重组载体pcDNA3-hnRNP K-HA的NIH3T3细胞,按每皿1×104细胞铺至Petri皿中,12 h后补液,置于孵箱中继续培养至24 h左右,待细胞密度长到80%时换用无血清DMEM培养8 h,实验组分别给予200 μmol/L NaAsO2刺激0 min、15 min、30 min和60 min,免疫染色步骤同上,Ⅰ抗用1% BSA稀释HA-Tag特异性抗体(1∶200)孵育,Ⅱ抗用1% BSA稀释Alexa Flour 594偶联的抗鼠IgG(1∶6 000)孵育。
2.5.3通路抑制剂预处理实验 接种转染空载体pcDNA3和重组载体pcDNA3-hnRNP K-HA的NIH3T3细胞,按每皿1×104细胞铺至Petri皿中,12 h后补液,置于孵箱中继续培养至24 h左右,待细胞密度长到80%时换用无血清DMEM培养8 h,实验组采用JNK、MEK、PI3K/Akt、NF-κB以及核转运等5种信号通路抑制剂[依次为: SP600125(200 nmol/L)、PD98059(200 nmol/L)、wortmannin(200 nmol/L)、BAY11-7082(5 μmol/L)和WGA(20 μg/L)]预处理转染后的NIH3T3细胞1 h,再给予200 μmol/L NaAsO2刺激1 h,免疫染色步骤同上。
2.6ROS的检测 按步骤2~3脂质体介导转染的方法,培养2个3.5 cm皿NIH3T3细胞,分别转染空质粒pcDNA3和重组质粒pcDNA3-hnRNP K-HA,转染24 h后,分别消化细胞,以每孔1×104接种于Costar® 96孔板内,共设立6组:转染空质粒、转染重组质粒和未转染细胞并分别依次给予NaAsO2刺激0 min、30 min和60 min;阳性对照组(试剂盒中阳性刺激物ROSup处理),另设空白对照组(不铺细胞,给予DCFH-DA探针孵育),每组做3个复孔。其中,实验组给予200 μmol/L NaAsO2刺激细胞,而阳性对照组加入1∶1 000 ROSup稀释液刺激。接着应用ROS检测试剂盒,按照1∶1 000用无血清的培养液稀释DCFH-DA,使终浓度为10 μmol/L,每孔100 μL稀释液,37 ℃细胞培养箱中孵育30 min,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。用SpectraMax M5型酶标仪,在488 nm激发波长、525 nm发射波长处检测细胞内平均荧光强度。
3统计学处理
用SPSS 13.0统计软件处理。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用最小显著性差异(least significant difference, LSD)-t检验。以P<0.05为差异有统计学意义。
结 果
1pcDNA3-hnRNPK-HA重组质粒的鉴定
构建的重组质粒菌液经PCR扩增产物行2%琼脂糖凝胶电泳可见1 400 bp左右的DNA片段,与插入的DNA序列大小相符,经KpnI和EcoR I双酶切后可见5.4 kb和1 400 bp左右的2个条带,符合预期大小,见图1。DNA测序结果显示,重组质粒pcDNA3-hnRNP K-HA构建正确。

Figure 1. Identification of pcDNA3-hnRNP K-HA fusion protein expression vector by agarose gel electrophoresis. M: 1 kb marker; 1: pcDNA3-HA digested byKpnI andEcoR I; 2: hnRNP K coding sequence digested byKpnI andEcoR I; 3: amplified hnRNP K from pcDNA3-hnRNP K-HA.
图1pcDNA3-hnRNPK-HA融合蛋白表达载体的电泳鉴定
2Westernblotting检测hnRNPK-HA融合蛋白的表达
pcDNA3-hnRNP K-HA重组质粒在NIH3T3细胞中可有效表达,且带HA标签的融合蛋白分子量约58 kD,与小鼠hnRNP K分子量相近,见图2。

Figure 2. Expression of hnRNP K-HA fusion protein in NIH3T3 cells detected by Western blotting. 1: un-transfected cells; 2: cells transfected with empty vector; 3: cells transfected with recombinant vector.
图2Westernblotting检测hnRNPK-HA在NIH3T3细胞内的表达
3hnRNPK在NIH3T3细胞中的表达与定位
细胞免疫荧光结果显示内源性hnRNP K主要定位于胞核中,胞浆中有少量分布,见图3。

Figure 3. The expression and localization of hnRNP K in NIH3T3 cells (immunofluorescent staining,×600).
图3hnRNPK在NIH3T3细胞中的表达与定位
4NaAsO2诱导NIH3T3细胞hnRNPK蛋白聚集体的形成
免疫细胞化学检测显示,外源性hnRNP K在NIH3T3细胞中有表达,过表达的蛋白在胞浆胞核中均有分布,主要分布在胞浆中。转染空载体质粒pcDNA3的NIH3T3细胞内未检测到标记的蛋白荧光信号,正常情况下,融合蛋白呈弥散性分布在胞浆和胞核中,而NaAsO2刺激后,细胞内有较为明显的红色荧光聚集体的形成,并随时间的延长而递增。15 min后无明显变化,30 min形成微小颗粒状物,60 min形成的微小聚集体更为明显,见图4。
5hnRNPK抑制NIH3T3细胞ROS的生成
阳性对照组ROSup刺激细胞后,胞内ROS水平明显上升。未转染重组载体的实验组中,NaAsO2刺激30 min和60 min与未刺激组相比差异均具有统计学意义(P<0.01),而转染重组载体后,细胞内ROS水平上升趋势减缓,NaAsO2刺激60 min同未转染实验组相比,差异有统计学意义(P<0.05),见图5。这些结果表明,NaAsO2诱导NIH3T3细胞产生ROS,而hnRNP K降低细胞内ROS生成水平。
6NaAsO2诱导NIH3T3细胞hnRNPK蛋白聚集体的形成依赖于JNK通路
由于外源性hnRNP K在200 μmol/L NaAsO2刺激1 h时,NIH3T3细胞中蛋白聚集体的形成最多且最为明显,因此,选择1 h为NaAsO2刺激时间,使用SP600125、PD98059、wortmannin、BAY11-7082和WGA等5种抑制剂预处理细胞1 h后,检测对细胞内蛋白聚集体形成的影响。给予JNK通路特异性抑制剂SP600125预处理后,细胞中的蛋白聚集体明显解聚,呈弥散分布,恢复到了静息状态下水平,而给予MEK抑制剂PD98059、PI3K/Akt抑制剂wortmannin、NF-κB抑制剂BAY11-7082以及出核转运抑制剂WGA预处理细胞,NaAsO2刺激1 h后,细胞内的蛋白聚集体无明显变化。SP600125可抑制NaAsO2诱导NIH3T3细胞hnRNP K蛋白聚集体的形成,提示该聚集体的形成依赖于JNK信号通路,见图6。
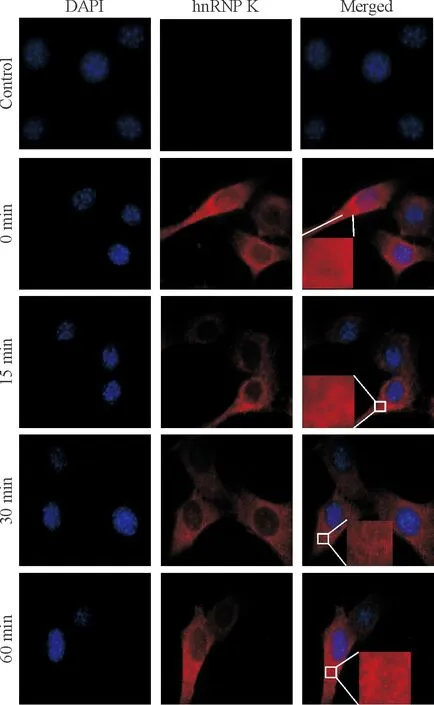
Figure 4. NaAsO2stimulated the formation of hnRNP K-HA fusion protein aggregates in NIH3T3 cells (immunofluorescent staining,×600). Control: NIH3T3 cells transfected with pcDNA3; 0 min, 15 min, 30 min and 60 min: cells were transfected with pcDNA3-hnRNP K-HA, and stimulated with 200 μmol/L NaAsO2for 0, 15, 30 and 60 min, respectively.
图4NaAsO2刺激NIH3T3细胞hnRNPK-HA融合蛋白聚集体的形成
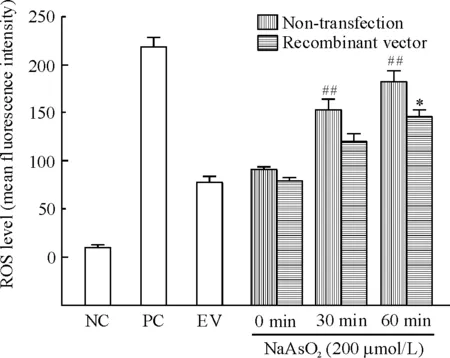
Figure 5. hnRNP K suppressed intracellular ROS generation in NIH3T3 cells.NC: negative control; PC: positive control, cells stimulated with ROSup; EV: cells transfected with empty vector; 0 min, 30 min and 60 min: cells were transfected with recombinant vector, and stimulated with 200 μmol/L NaAsO2for 0, 30 and 60 min, respectively. Mean±SD.n=3.##P<0.01vs0 min;*P<0.05vsnon-transfection.
图5hnRNPK抑制NIH3T3细胞内ROS生成
讨 论
研究表明,hnRNP K参与染色体的重塑,转录调节以及细胞内信号转导,目前已发现多种肿瘤的发生、发展和转移都与该家族蛋白有关,且已有研究证实hnRNP K在胰腺癌[8]、肺癌[9]、前列腺癌[10]等多种肿瘤细胞和组织中呈高表达,主要通过调控与细胞增殖有关基因的表达而影响肿瘤的发生发展。由此可见,包括hnRNP K在内的hnRNPs家族成员在各种肿瘤发生、发展与转移密切相关,因此,研究hnRNPs蛋白家族参与氧化应激反应的分子机制,对于我们认识其与氧化应激相关的各种疾病具有重要意义。
本研究中,细胞免疫化学实验结果显示,内源性hnRNP K蛋白主要定位于胞核中,而在转染重组质粒的NIH3T3细胞中,融合蛋白主要表达定位于胞浆中,且NaAsO2不同时间刺激后,细胞内出现红色荧光聚集体,胞浆中的融合蛋白以聚集体形式呈点状分布,且随刺激时间的延长有递增趋势。蛋白聚集体被认为是细胞的一种防御反应,通常细胞中错误折叠蛋白会被蛋白酶体降解,但在热应激、氧化应激等环境因素作用下,一些错误折叠蛋白质不被降解,反而会形成蛋白聚集体[11]。它与许多疾病,如神经退行性疾病包括肌萎缩侧索硬化、阿尔兹海默氏症和疯牛病等关系密切[12]。其中,有研究发现,真核细胞在受环境刺激如氧化应激、热休克、紫外照射时,在胞质中会形成致密颗粒状聚合体,即SGs。SGs 可以在压力情况下作为mRNA 的储存场所,当应激解除时,SGs解聚,mRNA从SGs中释放出来,可以继续参与翻译[13-14]。因此,本实验中所观察到的蛋白聚集体,是否为SGs,还需进行进一步验证。

Figure 6. Effects of five different pathway inhibitors on the formation of hnRNP K protein aggregates in NIH3T3 cells (immunofluorescent staining,×600).
图65种不同通路抑制剂预处理NIH3T3细胞对hnRNPK蛋白聚集体形成的影响
研究发现,当细胞处于应激状态时,细胞质中hnRNP A1出现大量的积累,呈现高磷酸化状态,从而影响细胞内的转录调节,这一过程可能与p38应激信号转导通路及其下游信号通路有关[15]。Yang等[16]研究表明,hnRNP A18也参与了细胞应激的调控,在hnRNP A18过表达时,可以减少紫外线照射对细胞的杀伤程度,而抑制hnRNP A18的表达时,细胞对于紫外线杀伤的敏感性增加,可见hnRNP A18对细胞应激状态也有重要的保护作用。而hnRNP K与hnRNP A1/A18隶属于同一家族蛋白,它是否也参与了某种信号通路的调控呢?本实验中,NaAsO2诱导NIH3T3细胞hnRNP K形成的蛋白聚集体,受到JNK特异性抑制剂SP600125的抑制作用。而JNK是丝裂原活化蛋白激酶家族中的一员,许多外界应激因素(如物理射线、热休克、氧化损伤)等都能激活JNK,因此JNK为介导应激过程的重要激酶分子[17],大量实验研究显示JNK信号通路在细胞分化、细胞凋亡、应激反应以及多种疾病的发生与发展中起着至关重要的作用。因此,本研究中,NaAsO2诱导NIH3T3细胞内hnRNP K蛋白聚集体的形成,且过表达hnRNP K可拮抗NaAsO2刺激细胞产生ROS水平,两者可能存在某种关系,进一步研究发现该聚集体的形成依赖于JNK信号通路。总之,这些为我们进一步探讨hnRNP K与氧化应激损伤等相关生物学功能奠定了实验基础。因此,进一步明确JNK是如何影响hnRNP K蛋白聚集体形成的机制,进而探索其相关生物学功能具有重要意义。
[1] Michael WM, Eder PS, Dreyfuss G. The K nuclear shuttling domain: a novel signal for nuclear import and nuclear export in the hnRNP K protein[J]. EMBO J, 1997, 16 (12):3587-3598.
[2] 张洁霞,刘启才,何建行. hnRNP A2/B1 mRNA在非小细胞肺癌和转移淋巴结中表达及意义[J]. 中国病理生理杂志,2010,26(6):1221-1223.
[3] Charroux B, Angelats C, Fasano L, et al. The levels of the bancal product, a drosophila homologue of vertebrate hnRNP K protein, affect cell proliferation and apoptosis in imaginal disc cells[J]. Mol Cell Biol, 1999, 19(11):7846-7856.
[4] Dreyfuss G, Matunis MJ, Piol-Roma S, et al. hnRNP proteins and the biogenesis of mRNA[J]. Annu Rev Biochem, 1993, 62:289-321.
[5] Ostareck-Lederer A, Ostareck DH, Cans C, et al. c-Src-mediated phosphorylation of hnRNP K drives translational activation of specifically silenced mRNAs[J]. Mol Cell Biol, 2002, 22(13):4535-4543.
[6] Bomsztyk K, Denisenko O, Ostrowski J. hnRNP K: one protein multiple processes[J]. Bioessays, 2004, 26(6):629-638.
[7] Toshiyuki F, Takahiro N, Marie S, et al. hnRNP K interacts with RNA binding motif protein 42 and functions in the maintenance of cellular ATP level during stress conditions[J]. Genes to Cells, 2009,14(2):113-128.
[8] Zhou R, Shanas R, Nelson MA, et al. Increased expression of the heterogeneous nuclear ribonucleoprotein K in pancreatic cancer and its association with the mutant P53[J]. Int J Cancer, 2010, 126(2):395-404.
[9] Pino I, Pio R, Toledo G, et al. Altered patterns of expression of members of the heterogeneous nuclear ribonucleoprotein (hnRNP) family in lung cancer[J]. Lung Cancer, 2003, 41(2):131-143.
[10] Barboro P, Repaci E, Rubagotti A, et al. Heterogeneous nuclear ribonucleoprotein K: altered pattern of expression association with diagnosis and prognosis of prostate cancer[J]. Br J Cancer, 2009, 100(10):1608-1616.
[11] 李清华. 蛋白聚集体形成研究进展[J]. 国际遗传学杂志,2011,34(5):266-270.
[12] Ling J, Cho C, Guo LT, et al. Protein aggregation caused by aminoglycoside action is prevented by a hydrogen peroxide scavenger[J]. Mol Cell, 2012, 48(5):713-722.
[13] Thomas MG, Loschi M, Desbats MA, et al. RNA granules: the good, the bad and the ugly[J]. Cell Signal, 2011, 23(2):324-334.
[14] 吴 硕,钟照华. 病毒感染与细胞应激颗粒[J]. 中国病毒病杂志,2012,2(6):60-64.
[15] Guil S, Long JC, Caceres JF. hnRNP A1 relocalization to the stress granules reflects a role in the stress response[J]. Mol Cell Biol, 2006, 26(15):5744-5758.
[16] Yang C, Carrier F. The UV-inducible RNA binding protein A18(A18 hnRNP) plays a protective role in the genotoxic stress response[J]. J Biol Chem, 2001, 276(50):47277-47284.
[17] 刘永学,高 月. 应激研究进展[J]. 中国病理生理学杂志,2002,18(2):218-224.
EffectsofJNKsignalingpathwayonhnRNPKproteinaggregatesinNIH3T3cellstreatedwithsodiumarsenite
FAN Qi-huang, JIANG Feng, HU Shui-wang, TANG Zhao-liang, JIANG Yong
(DepartmentofPathophysiology,KeyLaboratoryofProteomicsofGuangdongProvince,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:jiang48231@163.com)
AIM: To explore the role of JNK signaling pathway in the formation of heterogeneous nuclear ribonucleoprotein (hnRNP) K protein aggregates by observing the expression and localization of hnRNP K in NIH3T3 cells induced by sodium arsenite(NaAsO2).METHODSThe recombinant vector pcDNA3-hnRNP K-HA was constructed and transfected into NIH3T3 cells. The expression and localization of endogenous hnRNP K and distribution of the protein aggregates stimulated with NaAsO2at different time points were observed under fluorescence microscope. The level of reactive oxygen species (ROS) in the cells was detected by a ROS assay kit. After pretreated with the inhibitors of 5 signaling pathways (JNK, MEK, PI3K/Akt, NF-κB and nuclear transport), the changes of the protein aggregates were observed.RESULTSThe recombinant plasmid was correctly constructed. The hnRNP K was mainly distributed in the nucleus. The intracellular fluorescent aggregates increased with the prolonging stimulation of NaAsO2in the cells transfected with the recombinant plasmid, and the overexpression of hnRNP K inhibited ROS generation in the cells induced by NaAsO2. SP600125, an inhibitor of JNK signaling pathway, significantly inhibited the formation of protein aggregates.CONCLUSIONThe hnRNP K is primarily located in the nucleus of NIH3T3 cells, with a small amount in the cytoplasm. The formation of protein aggregates is significant after NaAsO2stimulation, which can restrain the level of intracellular ROS, and the process is involved in JNK signaling pathway.
Heterogeneous nuclear ribonucleoprotein K; Sodium arsenite; Aggregates; JNK signaling pathway
Q256
A
10.3969/j.issn.1000- 4718.2013.06.020
1000- 4718(2013)06- 1070- 06
2013- 03- 25
2013- 05- 14
国家自然科学基金重点资助项目(No.81030055);广东省自然科学基金资助项目(No. 10251051501000003);教育部长江学者和创新团队发展计划(No.IRT0731)
△通讯作者 Tel: 020-61648231; E-mail: jiang48231@163.com
▲并列第1作者

