CdS/石墨烯纳米复合材料的超声化学法制备及光催化性能
周 田 陈炳地,2 姚爱华*,,3 王德平,3
(1同济大学材料科学与工程学院,上海 200092)
(2同济大学先进材料与纳米生物医学研究院,上海 200092)
(3同济大学先进土木工程材料教育部重点实验室,上海 200092)
近年来,新型可见光响应光催化材料的开发利用成为研究热点,在环境污染控制、可持续能源开发利用方面具有重要意义。与目前最为常用的宽带隙的TiO2半导体光催化材料相比,硫化镉(CdS)具有较小的禁带宽度(2.42 eV)[1],能够吸收波长小于520 nm的紫外和可见光,另外,CdS具有较负的导带带边位置,因此被认为是一种在可见光光催化方面具有一定应用潜力的半导体光催化剂,但是光量子效率较低以及可见光下的光腐蚀却阻碍了CdS的广泛应用[2-4]。将CdS量子点负载到具有较大比表面积的载体上,能够有效提高CdS的光催化活性、稳定性及分散性,已成为CdS改性的一种有效手段。
石墨烯是一种新型的二维碳纳米材料,其能隙为零,具有超大的比表面积(2 630 m2·g-1)、良好的化学稳定性以及在室温下超高的载流子迁移率(2×105cm2·V-1·s-1)[5-7]。 研究表明,将 CdS 与石墨烯复合,利用石墨烯规整的二维平面结构作为其载体,一方面可以提高CdS的分散程度,另一方面可加快光生电荷迁移的速率,提高复合材料的催化活性和光稳定性[8-9]。另外,大量石墨烯包裹在CdS纳米颗粒表面,呈现出黑色,可以提高复合材料对可见光的吸收能力[10]。然而,目前有关CdS/石墨烯复合材料的研究还很鲜见,常用的制备方法主要有一锅法、水热-溶剂热法、微波辅助合成等[11-13],但这些方法操作复杂,得到的复合材料中CdS纳米粒子的颗粒尺寸大、粒径分布宽,对复合材料的光催化性能有不利影响[14]。
超声化学法是利用超声波所引发的特殊物理、化学条件加强和改善液-固非均匀体系的化学反应、强化传质过程,使反应体系实现微观或介微观均匀混合,使得晶体的生长和颗粒的团聚得到有效的控制,因而可以得到粒度分布窄的超细颗粒。由于该方法具有易于控制、周期短、效率高等优点,已经被用来成功制备了多种金属纳米颗粒、氧化物纳米棒以及金属硫化物纳米颗粒等。本工作采用超声化学法制备了CdS/石墨烯纳米复合材料,借助石墨烯对载流子的高迁移率及其共轭π键分子的杂化作用[15-16],减少CdS中光生载流子的复合,进而显著提高了CdS的光催化性能和抗光腐蚀性。
1 实验部分
1.1 试 剂
CdCl2;四氢呋喃(THF)、硼氢化钠(NaBH4)、升华硫、甲基橙、乙醇,以上试剂均为分析纯,购自国药集团化学试剂有限公司,未进行进一步纯化处理;石墨烯购自中科院山西煤炭化学研究所;实验用水为去离子水。
1.2 仪 器
采用X射线衍射仪 (XRD,Rigaku D/max 2550VB3+/PC,Japan)步进扫描模式分析样品的物相组成,以 Cu Kα(λ=0.154 18 nm)为辐射源,Ni滤波片,加速电压 40 kV,电流 60 mA,步长为 0.02°,每步停留时间 4s,扫描范围 10°~80°(2θ),扫描速度 10°·min-1;样品微观形貌采用场发射环境扫描电子显微镜(FE-SEM,FEI Quanta 200FEG,加速电压10 kV)和透射电子显微镜(TEM,JEM2100)进行表征,用于FE-SEM测试的样品首先经真空干燥后粘在样品台上喷金,然后在加速电压10 kV的条件下进行测试;用于TEM测试的样品首先置于乙醇中超声分散后用滴管滴加一滴到铜网上,烘干后于200 kV加速电压下进行测试;材料的光学性能通过紫外-可见分光光度计(UV-Vis,UV765)以及荧光分光光度计(PL,970CRT)进行分析。
1.3 材料制备
1.3.1 CdS/石墨烯纳米复合材料的制备
称取 36.6 mg 的 CdCl2和 6.4 mg 的升华硫,置于同一烧杯Ⅰ中,再分别称取12 mg的NaBH4、15 mg的石墨烯置于烧杯Ⅱ、Ⅲ中。在通风橱里分别向烧杯Ⅰ、Ⅱ、Ⅲ中加入90、30、50 mL的THF。用保鲜膜密封后,置于超声仪中于600 W下超声分散至三者完全溶解。接着将烧杯Ⅲ中的溶液(石墨烯+THF)倒入烧杯Ⅰ中,密封后超声分散5~10 min。最后将烧杯Ⅱ中的溶液(NaBH4+THF)缓慢滴入烧杯Ⅰ中,密封并继续超声反应1 h(超声功率为400 W)。取出静置一段时间后,将上层清液倒出,取沉淀物进行离心分离,并用乙醇离心洗涤3~5次,60℃干燥后即可获得CdS/石墨烯纳米复合材料。
1.3.2 CdS 纳米粒子的制备
称取 36.6 mg CdCl2以及 6.4 mg 的升华硫,置于同一烧杯中,并向烧杯内加入120 mL的THF,同时称取12 mg的NaBH4和40 mL的THF放置于另一烧杯,将烧杯用保鲜膜封装并放入超声仪进行分散,分散完全后,将NaBH4缓慢滴入CdCl2+S+THF的溶液中,继续超声反应,35 min后取出烧杯静置,待溶液分层,将上清液倒出,取沉淀物进行离心分离,并用乙醇进行离心洗涤3~5次,60℃干燥即可。
1.4 光催化实验过程
光催化实验在一个自制的反应器中进行,光源采用飞利浦石英双端金卤灯(100 W,发光波长380~780 nm,光强为 0.8~5.3 mW·cm-2),水平放置在距离样品容器约20 cm处,在反应体系的正上方10 cm处放置L41滤光片,以保证照射到反应体系的光为可见光。灯外安装有冷却水夹套以维持恒定的反应温度。称取50 mg的CdS/石墨烯样品加入到50 mL的甲基橙(10 mg·L-1)溶液中混合均匀,置于黑暗环境下2 h,以保证甲基橙溶液在石墨烯表面达到吸附-脱附平衡,然后开启光源,分别于5、10、20、30 min后取样一次,经离心分离后采用紫外-可见光分光光度计在483 nm处测定甲基橙的浓度,用甲基橙的剩余率η(η=C/C0)表征样品的光催化活性,式中,C和C0分别为甲基橙在t时刻的浓度和初始浓度。以蒸馏水和相同质量的CdS纳米粉末作对比样。实验过程中未进行光照时,为避免灯光等干扰,及时将混合样品用黑色塑料袋包裹起来。
CdS/石墨烯复合样品的光稳定性测试:将经30 min光催化反应后的粉体用一定量的去离子水洗涤数次,烘干后重新完成一次光催化过程,反复三次。
2 结果和讨论
2.1 CdS/石墨烯纳米复合材料的形成机理
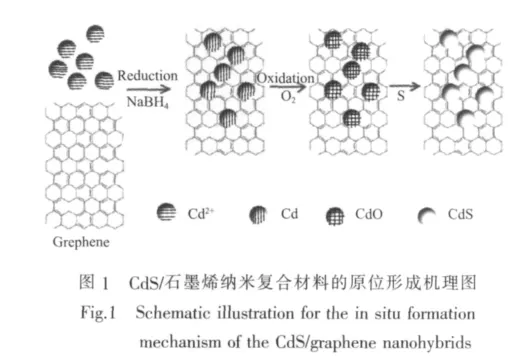
CdS/石墨烯纳米复合材料的形成过程如图1所示,由于石墨烯具有极大的比表面积和优异的吸附性能,当其与Cd盐溶液接触时,带正电的Cd离子通过静电吸引和物理吸附作用吸附于石墨烯片层上。在NaBH4的作用下,石墨片层上的Cd2+被还原成Cd原子团簇,并进一步与溶液中溶解的O2反应,原位生成CdO(Cd+O2=CdO),同时S原子被还原成S2-,与CdO反应生成CdS纳米粒子 (CdO+S2-=CdS),从而形成石墨烯/CdS纳米复合材料。在上述反应过程中,超声方法发挥了重要作用。超声波所产生的高能量使得石墨烯片层发生剥离,从而保证石墨烯与纳米粒子的良好接触,同时也避免了所产生的Cd/CdO的团聚,使其均匀、致密地分布于石墨烯片层上。此外,石墨烯表面含有大量不饱和的碳原子[14,17],使其与富电子的Cd原子牢固结合,这样的紧密结合有利于光生电荷的传递,提高载流子的分离效率。
2.2 样品的晶相结构分析
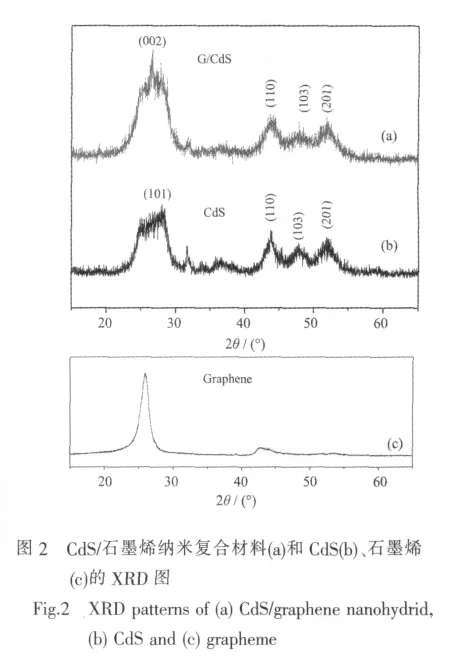
图2是CdS纳米粒子及CdS/石墨烯纳米复合材料的 XRD 图。 图 2(b)中 2θ为 28.2°、43.8°、47.9°、52.0°处出现了衍射峰,与CdS的标准图谱(PDF NO.77-2306)一致,说明所制备的CdS为六方纤锌矿结构。但各衍射峰宽化,说明所制备的CdS量子点的粒径较小。从图2(c)可以看到石墨烯在26.0°附近出现了(002)的特征衍射峰。由图2(a)可知,CdS/石墨烯纳米复合材料的衍射峰宽化明显,这说明石墨烯上所负载的CdS尺寸较小,石墨烯的存在有效阻止了CdS晶粒的长大和团聚[12]。由纤锌矿型CdS的(110)晶面衍射峰,根据谢乐公式计算出石墨烯表面所负载CdS的平均粒径约为14.9 nm。
2.3 样品的微观形貌分析
图3(a,b)给出了CdS/石墨烯纳米复合材料的FE-SEM图,从图中可以看出,在超声作用下石墨烯的层片发生了剥离,层片表面布满了大量细小的CdS颗粒,其形貌均一,分散性较好。图3(c,d)是CdS/石墨烯纳米复合材料的TEM照片,图中大面积片状物为石墨烯,能够明显地观察到其褶皱结构,纳米CdS粒子均匀弥散地分布在石墨烯片层上,平均粒径10 nm左右,这与XRD分析结果一致。
2.4 样品的光学性能分析
图4(a)是CdS纳米粒子和石墨烯/CdS纳米复合材料的紫外-可见光吸收光谱。由图可知,单纯CdS纳米粒子的吸收带边位于470 nm左右,对应于导带中的电子态与价带中的空穴态的第一光学允许跃迁[18],该吸收带与CdS体相材料的吸收带(515 nm)相比有了一定程度的蓝移,这是由量子限域效应引起的。CdS/石墨烯纳米复合材料的吸收强度显著减弱,吸收波长范围宽化,这与相关文献[10,13]的研究结果是一致的,可能是由于石墨烯表面所负载的CdS纳米粒子的密度较高,粒子之间产生了耦合作用[10]。由图可知,纳米复合材料的吸收边移至450 nm左右,即与单纯CdS纳米粒子相比,其吸收光谱发生了蓝移现象,说明负载在石墨烯表面的CdS颗粒细小,与石墨烯片层结合良好,分布均匀[19]。

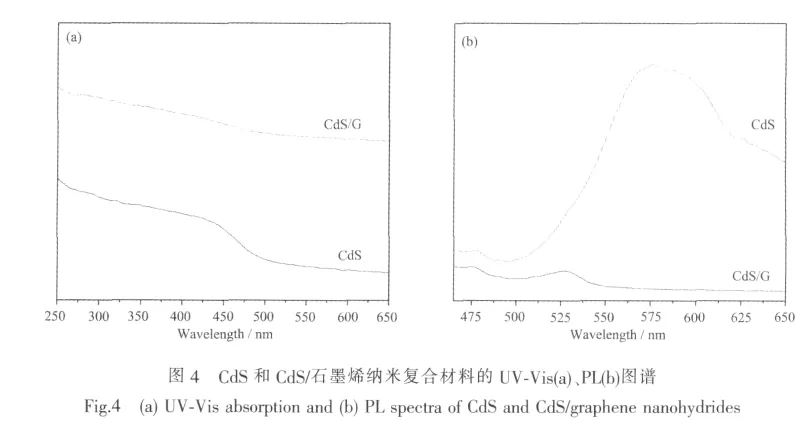
图4(b)是样品在400 nm光源激发下的荧光光谱。图中CdS的PL图谱中存在两个荧光峰,即475 nm附近低强度的荧光峰和570 nm附近高强度的荧光峰。量子点的荧光发射主要有激子发射、陷阱发射和杂质能级复合发光3种形式。电子和空穴的直接复合产生激子态发光,但由于纳米粒子表面存在大量缺陷、空位、悬键等,形成了表面缺陷态。当半导体量子点受到光激发后,光生载流子以极快的速度受限于表面缺陷态而产生表面态发光,即陷阱发射。激子发射一般位于吸收边附近而陷阱发射较宽且有较大的Stokes位移[20]。因此,图中475 nm处的吸收峰对应于CdS纳米粒子的激子发射,而570 nm附近能量较高的发射峰则归因于陷阱发射。CdS纳米粒子与石墨烯复合之后,其激子发射峰的峰位没有变化,但陷阱发射所对应的峰位移至530 nm左右,出现了明显的蓝移现象,且发光强度显著降低,这是由于石墨烯是良好的电子接受体,当CdS纳米粒子受到光激发后,光生电子迅速从CdS转移至石墨烯表面,使电子发生淬灭,从而引起陷阱发射强度减弱。
2.5 样品的光催化性能分析
为了比较所制备的CdS纳米粒子和CdS/石墨烯纳米复合材料在可见光下的光催化性能,将两种样品分别置于100 W的金卤灯下照射60 min,研究其对甲基橙的降解效果,结果如图5所示。
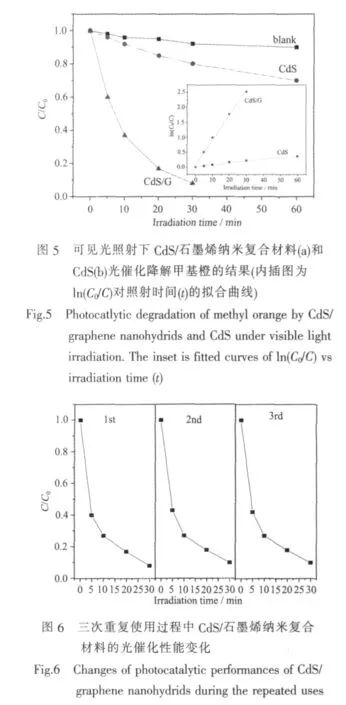
由图可知,单独CdS纳米粒子在可见光下的光催化性能较差,60 min内甲基橙的降解率仅为26.5%左右,而将其与石墨烯复合后光催化性能明显改善,30 min内甲基橙的降解率即可达到92%。实验过程中发现,将复合材料放入甲基橙溶液中,尚未进行光照,甲基橙溶液的颜色即已发生明显变化,经计算其降解率已接近80%。这是由于石墨烯具有极大的比表面积和优异的吸附性能,使得甲基橙在极短的时间内吸附在其表面,因此脱色明显。大量实验表明,光催化过程可以用Langmuir-Hinshelwood动力学方程来表征[21],即低浓度时,满足ln(C/C0)=-kt,其中,C和C0分别为甲基橙在t时刻的浓度和初始浓度。根据上述公式进行线性拟合,拟合直线的斜率即为光催化反应的表观速率常数k。
由图5中的插图可知,单纯CdS纳米粒子和CdS/石墨烯纳米复合材料降解甲基橙的表观速率常数分别为0.0059和0.083 min-1,上述结果进一步证明纳米复合材料的光催化活性明显优于CdS纳米粒子。
有计算表明,石墨烯的功函数为4.42 eV,CdS半导体的带隙为2.25 eV,且其导带位置大概在-3.8 eV。CdS导带的位置比石墨烯的功函数小得多,因此光生电荷很容易从CdS转移到石墨烯上[22],而石墨烯是优异的电子受体和传递介质,可加快光生电子向表面的迁移,有效降低了光生电子和空穴的复合,提高了载流子的分离效率。
为了研究CdS/石墨烯纳米复合材料使用过程中的光稳定性,将光催化反应后的样品回收,干燥后重复进行了3次光催化实验,结果如图6所示。由图可知,3次重复实验过程中其光催化效果接近,表明该CdS/石墨烯纳米复合材料具有良好的抗光腐蚀性能。
尽管CdS具有优异的光电转换特性和发光性能,但是其光稳定性较差,主要原因是CdS易发生空穴诱导的直接光腐蚀[23],即:
CdS+2h+→Cd2++S
当其与石墨烯复合后,由于石墨烯共轭π键分子的杂化作用,促进光生空穴从CdS的价带通过共轭π键分子的HOMO轨道向表面迁移,从而有效抑制了CdS的光腐蚀[15-16]。
3 结 论
采用超声化学法合成了CdS/石墨烯纳米复合材料,并对其光学和可见光光催化性能进行了表征。结果表明,石墨烯表面所负载的CdS纳米粒子尺寸小(10 nm左右),分散性好。与单纯CdS纳米粒子相比,复合材料的吸收峰和发射峰均发生蓝移和宽化现象。光催化结果显示,CdS纳米粒子与石墨烯复合后,光催化性能明显改善,在0.5 h内甲基橙的降解率即可达到90%以上,光催化性能的提高一方面是由于石墨烯优异的电子传导性能,有效降低了光生电子和空穴的复合,另一方面归因于石墨烯极大的比表面积和优异的吸附性能。同时,超声化学法使得CdS纳米粒子在石墨烯片层表面牢固结合,从而促进了光生电荷的传递,提高了载流子的分离效率。此外,由于石墨烯共轭π键分子的杂化作用,促进了光生空穴的迁移,从而有效抑制了CdS的光腐蚀。
[1]CHEN Qi-Yuan(陈启元),LAN Ke(兰可),YI Zhou-Lan(尹周澜),et al.Materials Review(Cailiao Daobao),2005,19(1):20-23
[2]Yan H J,Yang J H,Ma G J,et al.J.Catal.,2009,266(2):165-168
[3]Silva L A,Ryu S Y,Choi J.et al.J.Phys.Chem.C,2008,32(112):12069-12073
[4]Novoselov K S,Geim A K,Morozov S V,et al.Science,2004,306:666669
[5]Avouris P,Chen Z,Perebeinos V.Nat.Nanotechnol.,2007,2:605615
[6]Chae H K,Siberio-Pérez D Y,Kim J,et al.Nature,2004,427:523527
[7]Meyer J C,Geim A K,Katsnelson M I,et al.Nature,2007,446:60-63
[8]Shen L,Zeng M G,Yang S W,et al.J.Am.Chem.Soc.,2010,132:11481-11486
[9]Eda G,Fanchini G,Chhowalla M.Nat.Nanotechnol.,2008,3:270-274
[10]Li Q,Guo B D,Yu J G,et al.J.Am.Chem.Soc.,2011,133(28):10878-10884
[11]Nethravathi C,Nisha T,Ravishankar N,et al.Carbon,2009,47:20542059
[12]MIN Shi-Xiong(敏世雄),LÜ Gong-Xuan(吕功煊).Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2011,27(9):2178-2184
[13]Liu X J,Pan L K,Lü T,et al.Chem.Commum.,2011,47:11984-11986
[14]Yang L,Zheng Y B,Zhao F,et al.Chem.Soc.Rev.,2012,41:97-114
[15]Xu T G,Zhang L W,Cheng H Y,et al.Appl.Catal.B,2011,101:382-387
[16]Zhang H,Zhu Y F.J.Phys.Chem.C,2010,114:5822-5826
[17]Peng C X,Chen B D,Yao Q,et al.ACS Nano,2012,6(2):1074-1081
[18]Feng M,Sun R Q,Zhan H B,et al.Nanotechnol.,2010,21:075601
[19]Wu J L,Bai S,Shen X P,et al.App.Sur.Sci.,2010,257:747751
[20]ZHEN Li-Si(郑立思),FENG Miao(冯苗),ZHAN Hong-Bing(詹红兵).Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2012,28(1):208-212
[21]LIU Yan-Fang(刘艳芳),MA Xin-Guo(马新国),YI Xin(易欣),et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2012,28(3):645-660
[22]Li J,Wang D H,Huang Y X,et al.J.Phys.Chem.C,2011,115:11466-11473
[23]Chen X B,Shen S H,Guo L J,et al.Chem.Rev.,2010,110:6503-6570

