柴油分散液对马粪海胆细胞色素P450活性的影响
马忠强, 高亚丽, 刚 锰, 杨柏林, 熊德琪
(大连海事大学 环境科学与工程学院, 辽宁 大连116026)
马粪海胆(Hemicentrotus pulcherrimus)是海洋底栖环境中比较常见的无脊椎动物, 在系统分类学上属于棘皮动物门、游在亚门、海胆纲、正形目、球海胆科。细胞中的细胞色素P450主要分布在内质网和线粒体内膜上, 作为一种末端加氧酶, 参与生物体内的甾醇类激素合成等过程。近年来, 对细胞色素P450的结构、功能, 特别是对其在药物代谢中的作用的研究有了较大的进展。最新研究表明, 细胞色素P450还是药物代谢过程中的关键酶, 对细胞因子和体温调节都有重要影响, 最早的研究是在鱼类肝脏中P450展开的。目前, 鱼肝细胞色素P4501A作为有机物污染的监测指标已经大量地应用于野外现场研究和实验室研究[1-3]。太平洋牡蛎经过石油烃污染暴露后, 通过RT-PCR研究表明, P4501A1基因、谷胱甘肽硫转移酶基因的mRNA表达水平增加[4]。本文以马粪海胆为受试生物, 研究在三个不同柴油分散液浓度下, 海胆三个部位P450活性的变化规律, 研究结果可为石油烃对海洋生物的影响和污染监测提供有效的技术方法。
1 材料和方法
1.1 材料、试剂及仪器
马粪海胆采于大连太平洋水产养殖场。选取发育良好、个体大的海胆进行试验(海胆的平均体重为81.3 g, 平均壳长为6.4 cm,平均壳高为3.2 cm)。海水取自大连湾, 经沉淀过滤后用于试验, 温度为(22±2)℃, 盐度为31.35, 电导率为47.3 S/m, pH为8.13。
四氯化碳为分光纯; 无水Na2SO4、浓H2SO4、盐酸、NaCl均为分析纯; 相关试剂盒购自美国ADL公司; 0号柴油购于大连凌水加油站。
JDS-109U红外测油仪、JB-3型磁力搅拌器、Thermo高速冷冻离心机、HH-S水浴锅、酶标仪。
1.2 方法
1.2.1 受试液的制备
柴油分散液(WAFs)的制备: 将 0号柴油和海水以1∶9的比例进行混合。用磁力搅拌器连续搅拌24 h, 分液漏斗中静置4 h, 下层的水相为母液, 于4 ℃保存, 使用时候以红外测油仪进行浓度测定, 并稀释成试验需要的浓度。
1.2.2 亚急性毒性试验
设定 3个浓度组, 每个浓度组投入充足的稀释液, 每组投放15只海胆。试验期间12 h换稀释液1次, 并进行打氧和投饵。
3个浓度组分别为5、20、50 mg/L(以下分别用低浓度、中浓度、高浓度来表示), 测定时间分别设为第2、4、8、12天。恢复试验结束时间为25 d,测定的部位为肠体、体液和性腺。
在每组浓度、每个测定时间下, 分别取出3只海胆对其三个部位进行P450酶含量的测定, 在12 d后,每个浓度组还剩下3只海胆, 然后, 把这3只海胆放进干净的海水中进行恢复试验, 直到25 d后再测定三个部位酶的活性。另外, 同时在干净的海水中饲养15只健康的海胆, 用于空白对照试验。(注: 对海胆进行酶测定的时候都要得到3只海胆酶活性的数值,然后进行平均求值, 此数值为在此浓度和此测定时间P450活性的最终结果。)
1.2.3 酶活性的测定方法
(1)称取一定质量的性腺或者肠体(约0.2~1 g),用冰冷的生理盐水漂洗, 滤纸拭干, 称重, 放入5~10 mL的小烧杯中。
(2)用量筒取冰冷的生理盐水(0.86%的生理盐水的质量应该是组织质量的9倍), 用移液管将总量2/3的生理盐水移入烧杯中, 用剪子尽快剪碎组织块(气温高时要放在冰上进行)。
(3)将剪碎的组织倒入玻璃匀浆管中, 再把剩余的1/3的生理盐水冲洗残余在烧杯中的碎组织一起倒入匀浆管中匀浆, 充分匀浆后, 把此匀浆液用离心机3000 r/min离心15 min, 之后留上清液用于试验的测定。
(4)体液酶活性测定, 取海胆体液20 μL, 用蒸馏水稀释至1 mL, 配成1∶49的溶液, 然后充分放置5 min直到使玻璃管中的溶液对光呈完全透明状, 才能进行酶的检测。
2 结果与分析
2.1 马粪海胆不同部位的P450含量
马粪海胆不同组织中的P450含量测定结果见表1。可以看出, 在正常条件下, 肠体、性腺和体液中的P450含量有明显差异。
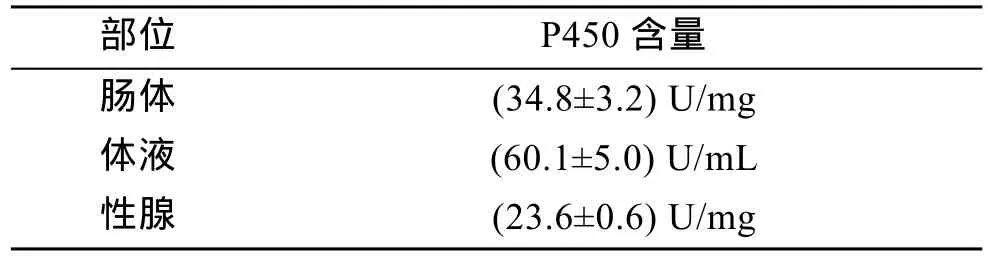
表1 马粪海胆不同部位的P450含量测定结果Tab.1 The P450 content in different tissues of Hemicentrotus pulcherrimus
2.2 柴油分散液对马粪海胆P450活性的影响
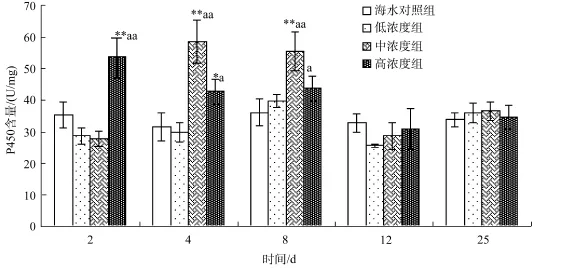
图1 不同柴油分散液质量浓度下马粪海胆肠体中P450含量随时间的变化Fig.1 The time-effect response of P450 activity in intestine of Hemicentrotus pulcherrimus with different concentrations of diesel
2.2.1 柴油分散液对马粪海胆肠体的 P450活性的影响
图1为柴油分散液对海胆肠体P450活性影响试验结果。从图中可以看到: 2 d时, 低、中浓度组和对照组相比几乎无显著差异, 但是高浓度组P450的活性则被诱导, 与前两个浓度梯度存在较为明显的差异; 4 d时, 中浓度组P450的含量开始诱导, 而高浓度组的活性开始回落; 在第 8 天时, 低浓度组 P450的含量被诱导, 后两个浓度组还是在回落; 第12 天时, 这三个浓度组的P450含量较之前都有所回落。所以, 柴油分散液对马粪海胆肠部P450的含量影响最为明显。从图中还可以看到, 三个浓度组下马粪海胆肠部的 P450含量随时间的变化情况, P450含量首先增加然后降低, 即活性先被诱导后被抑制。第2天时, 高浓度组的含量是对照组的 143%; 但是当恢复试验结束的时候, 三组浓度下的肠体P450含量基本与对照组一致。
2.2.2 柴油分散液对马粪海胆体液P450活性的影响
从图2中可以看到: 2 d时, 低浓度组和对照组之间没有明显的差异, 中浓度组P450的含量比较低,高浓度组P450明显增加, 和中浓度组之间有显著差异; 4 d时低浓度组P450含量增高, 高浓度组P450
含量达到高峰; 第8 天时, 前两个浓度组P450含量达到高峰, 而高浓度 P450含量开始回落; 第 12 天时, 前两个浓度组较第 8 天时有所回落, 但是高浓度组反而升高。所以, 柴油分散液对马粪海胆体液P450含量的影响也比较显著。三组浓度下, 随着时间的推移, 体液中的 P450含量先增加后下降, 效应显著。当恢复试验结束的时候, 三个浓度组之间体液中的P450活性差异基本消除, 与对照组一致。
2.2.3 柴油分散液对马粪海胆性腺P450活性的影响
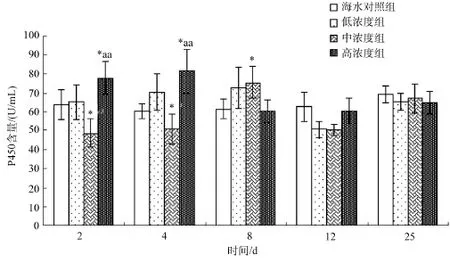
图2 不同柴油分散液质量浓度下马粪海胆体液P450含量随时间的变化Fig.2 The time-effect response of P450 activity in coelomic fluid of Hemicentrotus pulcherrimus with different concentrations of diesel
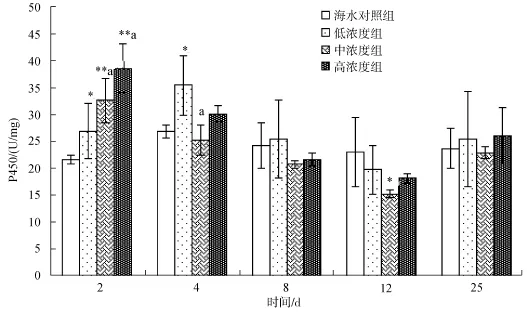
图3 不同柴油分散液质量浓度下马粪海胆性腺P450含量随时间的变化Fig.3 The time-effect response of P450 activity in gonad of Hemicentrotus pulcherrimus with different concentrations of diesel
从图3中可以看到: 对照组P450的含量比较稳定。2 d时, 三个浓度组P450的含量都有明显的增加,与浓度成正比关系; 4 d时低浓度组P450含量增高,中、高浓度组P450含量明显下降; 第8 天时低浓度组的 P450也开始有所回落; 第 12 天时, 这三个浓度组较第 8 天也是略有回落。所以, 柴油分散液对马粪海胆性腺P450含量的影响也比较显著。随着时间的推移, 性腺中的 P450含量先增加后下降, 明显产生了先诱导后抑制的效应。当恢复试验结束的时候, 三个浓度组之间性腺中的P450活性差异基本消除, 与对照组趋于一致。
2.2.4 柴油分散液暴露下海胆 P450活性的变化规律比较
从表2可以看出, 油污染会明显影响海胆体内各部位的P450活性, 总体上呈现先诱导、后抑制的规律。随着油浓度的增加, 最大诱导率也在增加, 并且高浓度组时P450出现诱导的时间比低浓度组要早。随着暴露时间的增加, P450活性逐渐被抑制, 且浓度越高, 抑制作用出现的时间越早。
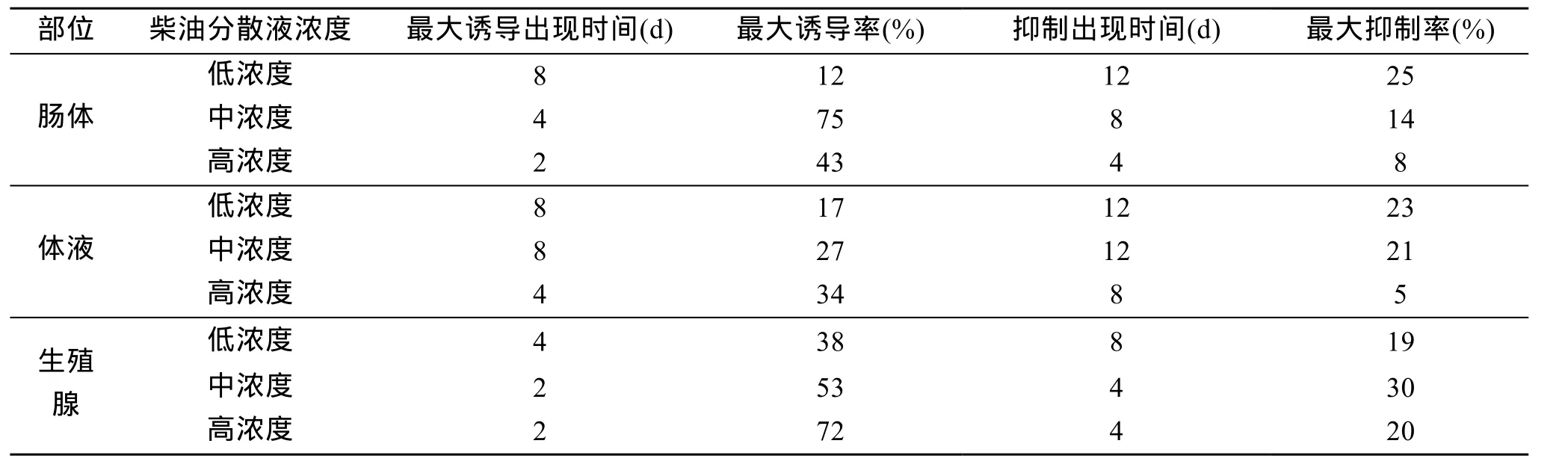
表2 不同油浓度下海胆三个部位P450活性的变化情况比较Tab.2 Effects of different concentrations of WAFs on P450 activities
3 讨论
从实验结果可以看出: 在柴油分散液的低浓度和中浓度组条件下, 海胆的肠体、体液和性腺等不同部位的P450酶一般在暴露4~8 d后会出现诱导效应, 在8~12 d后开始产生抑制作用。而在高浓度时, 各部位的P450含量在暴露2~4 d时就会迅速提高, 达到峰值, 之后开始逐渐受到抑制, 甚至低于正常水平。说明油污染会显著影响海胆的抗氧化还原系统, 在油污染程度较低时和污染初期, 由于海胆抗氧化还原系统对污染的应激反应, 细胞色素P450活性首先被诱导, 并且污染程度越大, 海胆抗氧化还原系统的应激反应出现得越早, 作用越强; 但随着污染程度和时间的增加, 由于中毒反应导致酶活性受到抑制而逐渐下降。在停止污染暴露12 d左右时间后, 各部位P450含量会逐渐恢复到原来水平, 说明海胆抗氧化还原系统具有一定的自我修复能力。
相关研究也发现在受到有毒物质作用时, 生物体内酶活性总体上会呈现先升后降的趋势[5-9]。利用该现象, 国外学者以 P450作为毒理学指标, 在多环芳烃(PAHs)、PCBs、TCDDs的生物监测方面做了较多的研究工作。如法国选择了两种海鱼的 EROD活性作为监测PAHs和PCBs的指标, 对周边海域环境进行监测[10]。挪威也把鲶鱼CYPIA的诱导作为监测周边海域石油烃、PAHs、PCBs、PCDDs、其他卤代化合物、农药等污染的指标[11]。相对来说, 国内在此方面的研究较少, 只有朱必凤[12]提出可用鲫鱼肝微粒体芳烃羟化(AHH)酶指示水体中多环芳烃污染等少量成果报道。因此本文以海胆为对象研究其体内P450酶受石油烃污染的影响规律具有重要的意义,海胆P450活性可作为海洋中石油烃污染程度监测的毒理学指标。
[1]Codi S, Humphrey C, Klumpp D, et al. Barramundi as an indicator species for environmental monitoring in North Queensland, Australia: laboratory versus field studies[J]. Environ Toxicol Chem,2004, 23(11):2737-2744.
[2]Den Besten P J, Valk S, Van Weerlee E, et al.Bioaccumulation and biomarkers in the sea star Asterias rubens (Echinodermata: Asteroidea): a North Sea field study[J]. Mar Environ Res,2001, 51(4): 365-387.
[3]Kopecka-Pilarczyk J, Correia A D. Biochemical response in gilthead seabream (Sparus aurata)to in vivo exposure to a mix of selected PAHs[J]. Ecotoxicol Environ Saf, 2009, 72(4): 1296-1302.
[4]Hansen B H, Altin D, Hessen K M,et al. Expression of ecdysteroids and cytochrome P450 enzymes during lipid turnover and reproduction in Calanus finmarchicus(Crustacea: Copepoda)[J]. Gen Comp Endocrinol,2008,158(1): 115-121.
[5]Pascual P, Pedrajas J R, Toribio F, et al. Effect of Food Deprivation on Oxidative Stress Biomarkers in Fish(Sparus aurata)[J]. Chemico-Biological Interactions,2003, 145: 191-199.
[6]Oruc E O, Sevgiler Y, Uner N, et al. Tissue-Specific Oxidative Stress Responses in Fish Exposed to 2,4-D and Azinphosmethyl[J]. Biological Sciences, 2004, 137:43-51.
[7]Box A, Sureda A, Deudero S, et al. Antioxidant response of the bivalve Pinna nobilis colonised by invasive red macroalgae Lophocladia lallemandii[J].Comparative Biochemistry and Physiology, 2009, 149:456-60.
[8]Cheung C C, Siu W H, Richardson B J, et al. Antioxidant responses to benzo[a]pyrene and Aroclor 1254 exposure in the green-Lipped mussel, Perna viridis[J]. Environ Pollut,2004, 128: 393-403.
[9]Martín-Díaz M L, Blasco J, Sales D, et al. Field validation of a battery of biomarkers to assess sediment quality in Spanish ports[J]. Environ Pollut, 2008, 151: 631-640.
[10]Galgani F. Monitoring of pollutant biochemical effects on marine organisms of the French coasts[J].Oceanologica ACTA, 1992, 15: 52-61.
[11]Anders Gokso yr. Characterization of the cytochrome P450 mono-oxygenase system in fish liver, metabolism and effects of organic xenobiotics[D]. Trodheim: Norweigian University of Science and Technology, 1987.
[12]朱必凤, 马海燕. 鲫鱼肝微粒体芳烃羟化酶指示多环芳烃对水体污染的研究[J]. 中国环境科学, 1995,15:153-156.

