不同饵料对管角螺生长、肝脏消化酶活性及软体部营养成分的影响
靳立兵, 张林林, 李荣华, 母昌考, 宋微微, 王春琳
(宁波大学 海洋学院, 浙江 宁波 315211)
管角螺(Hemifusus tubaGmelin)俗称角螺、响螺,属腹足纲(Gastropoda), 新腹足目(Neogastropoda),盔螺科(Galeodidae), 是浅海较大型经济螺类, 主要分布在中国东南沿海及日本海[1]。其生长快、螺体大、肉味鲜美、营养丰富, 是经济价值很高的食用单壳螺。近年来, 由于过度捕捞和海洋环境污染导致中国沿海管角螺资源日益枯竭, 市场价格昂贵, 供不应求, 具有很高的开发养殖前景。
管角螺为肉食性贝类, 食性凶猛, 喜食双壳类, 常以发达的足部裹住贝类, 口吻伸入贝壳内摄食; 其肝胰脏发达, 对饵料具有选择性, 在人工养殖的条件下饵料对管角螺的生长和发育具有重要的影响, 适宜的饵料能促进管角螺快速的生长[2]。目前, 国内外有关管角螺的研究报道较少,主要集中于管角螺的人工育苗[2]、生物学特性[3-5]、摄食[6]、繁殖[7-8]、营养成分分析[9]和生殖系统组织学[10]等方面的研究; 而对于管角螺消化酶活力与饵料的研究未见报道, 本研究探讨了不同饵料对管角螺生长及肝脏消化酶活力的关系, 旨在为该物种人工养殖过程中饵料的选择及自制配合饲料的优化提供参考。
1 材料和方法
1.1 试验设计
试验于2011年10月在宁波市象山县鑫亿鲜活水产有限公司进行。管角螺为2009年繁育养殖, 壳长为7.5 cm±1.1 cm, 体质量为33.5 g±9.2 g, 实验前由水泥池转移至泡沫箱(44 cm×44 cm×17 cm)暂养。暂养结束后在(44 cm×44 cm×17 cm)的泡沫箱中进行试验, 养殖水体为 30 L, 试验分为两部分: 一部分用于管角螺肝脏消化酶活力的测定; 另一部分用于生长性能和营养成分的分析; 每部分都设3组(15只/组), 每组3个平行,分别投喂鲜活缢蛏的贝肉(A组: 粗蛋白54.25%、粗脂肪 9.84%、灰分 14.32%、碳水化合物 21.59%)、菲律宾蛤仔的贝肉(B组: 粗蛋白42.57%、粗脂肪23.46%、灰分9.55%、碳水化合物24.42%)和自己研发的颗粒状配合饲料(C组: 粗蛋白47.26%、粗脂肪9.12%、灰分10.38%、碳水化合物33.24%), 各饵料的主要营养成分以干物质为基础。每天19: 00按照体质量的6%进行投喂, 次日 7: 00收集残饵, 并用溶失实验校正残饵量,持续时间为 45 d, 期间持续充气, 每天换水 1/2, 两天全量换水1次, 水温为22 ℃ ± 1 ℃ , 盐度为26±2, pH值为8.0±0.3, 光照周期为12L: 12D。
1.2 样品采集
试验开始前将管角螺饥饿 48 h, 用于分析肝脏消化酶活力的管角螺, 于实验开始时和投喂不同饵料15、30和45 d后取管角螺的肝脏于液氮中保存,用于消化酶活力的测定, 每次每组取样3个, 3个重复; 用于生长性能和软体部营养成分分析的管角螺,每天秤量记录投饵量和残饵量, 并于结束后取其软体部进行营养成分分析, 每组3个, 3个重复。
1.3 分析方法
1.3.1 生长性能的测定
试验开始前和结束后准确测量各实验组的管角螺体质量, 测定管角螺的肝脏指数(IL)、特定生长率(RSG)、摄食率(RF)、饵料转化效率(EFC)和能量转化效率(EEC)等指标。计算公式如下:
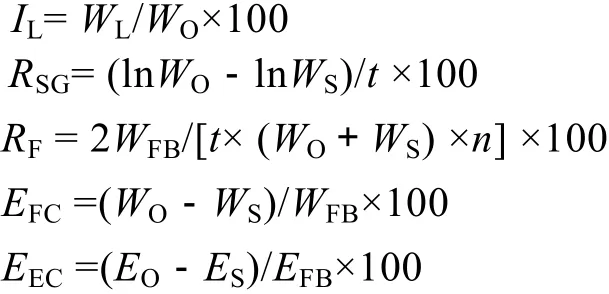
式中的WS、ES分别为试验开始时管角螺的平均鲜质量和能量值;WO、EO为试验结束时管角螺的平均鲜质量和能量值;WL为试验结束时管角螺肝脏的平均鲜质量;WFB表示管角螺摄食饵料的质量;t为摄食时间;n为试验结束时管角螺的数量;EFB表示管角螺摄食饵料的能量, 由Parr1481型氧弹仪测定。
1.3.2 肝脏消化酶活性测定(脂肪酶、淀粉酶、胰蛋白酶)
在样品中加入10倍体积(m/V)预冷的生理盐水匀浆, 匀浆后3 500 r/min离心15 min, 取上清液置于4℃保存, 用于胰蛋白酶、脂肪酶和淀粉酶活性的测定。胰蛋白酶活力定义为: 在pH8.0, 37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位。脂肪酶活力定义为: 在37℃条件下, 每毫克组织蛋白在本反应体系中与底物反应1 min, 每消耗1 μmoL底物为一个酶活力单位。淀粉酶活力定义为: 组织中每毫克蛋白在 37℃与底物作用30 min, 水解10 mg淀粉, 定义为1个淀粉酶活力单位。肝脏组织中蛋白质的含量用考马斯亮兰法测定, 胰蛋白酶、脂肪酶和淀粉酶活性测定所用的试剂盒均购自南京建成生物工程研究所。
1.3.3 肌肉营养成分分析
采用凯氏定氮法[11]测定管角螺肌肉中的粗蛋白含量; 粗脂肪采用索氏提取法[12]测定; 水分采用105℃烘干法[13]测定, 灰分采用马福炉灼烧法[14]测定。
1.4 统计分析
实验数据采用 SPSS 19.0统计软件进行方差分析和 Duncan氏多重比较, 试验结果用平均值±标准误差(Mean±SD)表示。
2 结果与分析
2.1 不同饵料对管角螺生长性能的影响
管角螺经过45 d的分组饲养后, 各组生长性能如表1所示。从表中可知, 菲律宾蛤仔组和缢蛏组在试验过程中的总摄食量和摄食率显著高于配合饲料组(P<0.05), 同时菲律宾蛤仔组略高于缢蛏组, 但差异不显著(P>0.05); 各组的特定生长率、饵料转化效率和能量转化效率呈现出的趋势是缢蛏组>菲律宾蛤仔组>配合饲料组, 且各组之间均存在显著差异(P<0.05); 不同饵料的投喂对管角螺肝脏指数的影响为缢蛏组>菲律宾蛤仔组>配合饲料组, 但各组之间的差异不显著(P>0.05)。
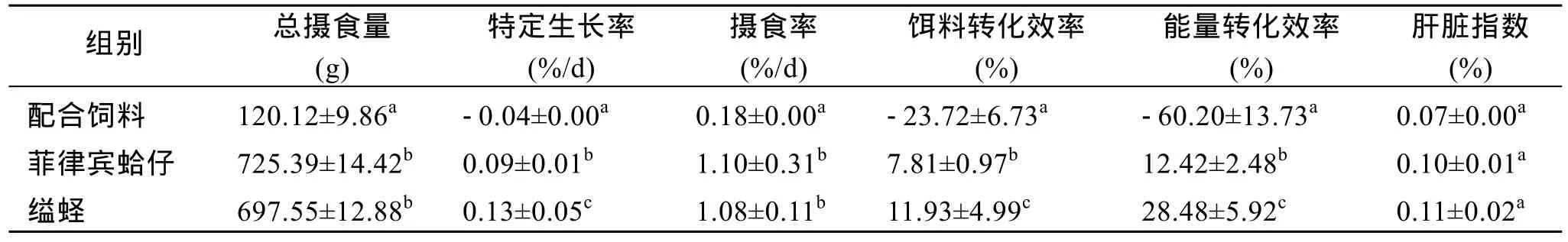
表1 不同饵料对管角螺生长性能的影响Tab.1 Effect of different diets on growth performance of Hemifusus tuba Gmelin
2.2 不同饵料对管角螺肝脏胰蛋白酶活性的影响
不同饵料对管角螺肝脏胰蛋白酶活性的影响如表2所示, 从表中可以看出饲喂不同的饵料后, 胰蛋白酶活力在 3组之间存在较大的差异, 其中菲律宾蛤仔和缢蛏的投喂对其活性的影响较大, 而配合饲料则较小。在投喂15、30和45 d后, 菲律宾蛤仔组和缢蛏组的胰蛋白酶比活力均大于配合饲料组, 其胰蛋白酶比活力的大小为: 缢蛏组>菲律宾蛤仔组>配合饲料组, 且各组之间均存在显著差异(P<0.05)。
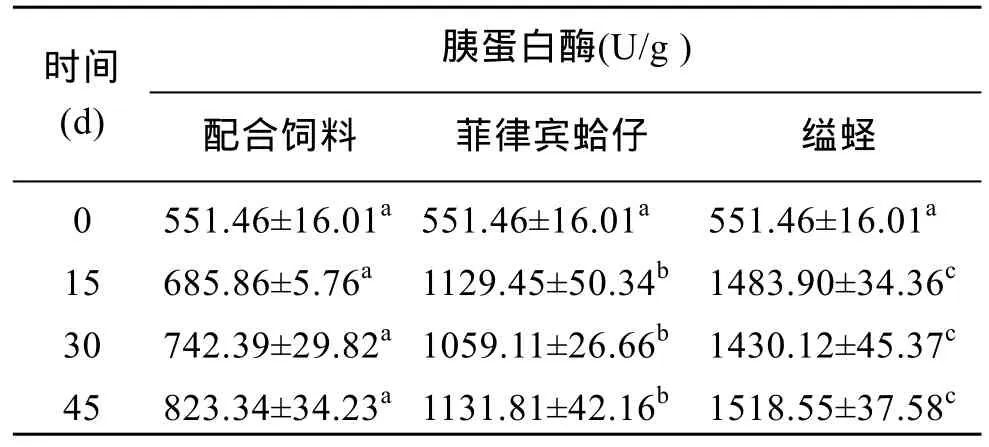
表2 管角螺不同饵料组的胰蛋白酶比活力Tab.2 Specific activities of trypsin in Hemifusus tuba Gmelin fed on different diets
2.3 不同饵料对管角螺肝脏淀粉酶活性的影响
不同饵料对管角螺肝脏淀粉酶活性的影响如表3所示, 从表中可以看出饲喂不同的饵料后, 淀粉酶活力均发生了变化。在投喂15 d和30 d后, 淀粉酶比活力在配合饲料组与菲律宾蛤仔组和配合饲料组与缢蛏组之间的差异显著(P<0.05), 而菲律宾蛤仔组与缢蛏组之间的差异不显著(P>0.05)。在投喂45 d后, 淀粉酶比活力在配合饲料组、菲律宾蛤仔组和缢蛏组之间均存在显著差异(P<0.05), 呈现为配合饲料组>缢蛏组>菲律宾蛤仔组。

表3 管角螺不同饵料的淀粉酶比活力Tab.3 Specific activities of amylased in Hemifusus tuba Gmelin fed on different diets
2.4 不同饵料对管角螺肝脏脂肪酶活性的影响
不同饵料对管角螺肝脏脂肪酶活性的影响如表 4所示, 从表中可以看出在管角螺肝脏中脂肪酶的活力较低, 饲喂不同的饵料后, 不同组间的脂肪酶活力大小与试验开始前相比, 均发生了变化, 各组之间的脂肪酶比活力均存在显著差异(P<0.05);其中配合饲料组在投喂后 0~30 d期间, 脂肪酶活力呈下降趋势, 而在30~45 d期间急剧上升; 菲律宾蛤仔组和缢蛏组在实验期间, 脂肪酶的活力都较稳定。
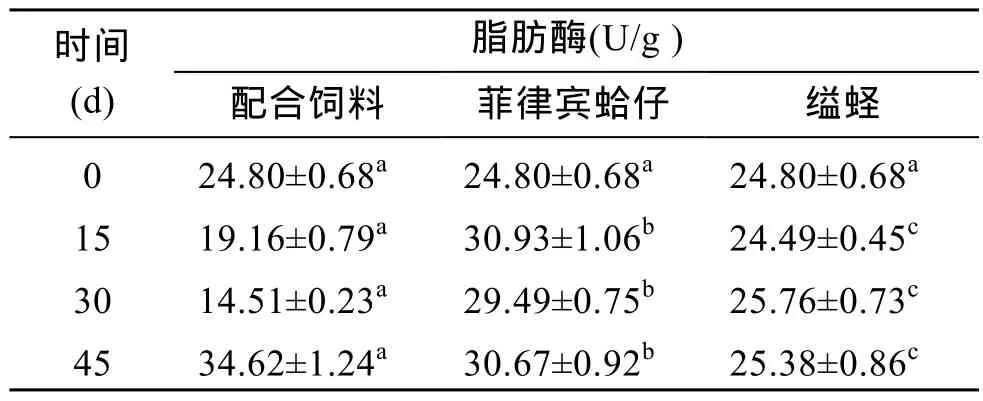
表4 管角螺不同饵料的脂肪酶比活力Tab.4 Specific activities of lipase in Hemifusus tuba Gmelin fed on different diets
2.5 不同饵料对管角螺软体部营养成分的影响

表5 管角螺软体部的主要营养成分Tab.5 The main nutritional composition in the viscera of Hemifusus tuba Gmelin
不同饵料对管角螺软体部营养成分的影响如表5所示, 各组管角螺软体部的水分和粗灰分含量差异不显著(P>0.05); 各组粗蛋白的含量差异显著(P<0.05), 缢蛏组>菲律宾蛤仔组>配合饲料组; 粗脂肪的含量在配合饲料组与菲律宾蛤仔组和缢蛏组均存在显著差异(P<0.05), 而菲律宾蛤仔组和缢蛏组中粗脂肪的含量差异不显著(P>0.05)。
3 讨论
3.1 不同饵料对管角螺生长性能的影响
由试验结果可以看出, 不同饵料对管角螺的生长特性具有重要的影响, 配合饲料组、缢蛏组和菲律宾蛤仔组的特定生长率相互之间存在着显著差异(P<0.05), 其中缢蛏的特定生长率最高, 菲律宾蛤仔次之、配合饲料的最低为负增长; 鲜活饵料组要显著高于配合饲料组(P>0.05), 其原因可能与管角螺的动物性食性有关。管角螺为肉食性贝类, 喜食鲜活的双壳类, 而菲利宾蛤仔、缢蛏等鲜活饵料的贝肉适口性好, 有较强的诱食作用, 更利于管角螺的摄食、吸收和生长; 另一方面可能是由于本试验所用自制配合饲料中缺乏生物活饵料所能提供的微量元素和外源消化酶, 其营养成分不是消化酶的最适底物,对管角螺的诱食效果较差, 因此管角螺对本实验中的配合饲料摄食量较小, 造成了物质和能量供应不足, 导致出现体质量的负增长。在鱼类中有研究表明,幼虫阶段采用配合饲料逐步代替活饵料进行驯化可以获得与鲜活饵料投喂相同的生长和存活率[15]。本实验样品一直以鲜活贝类作为活饵料投喂至 2龄,其适应鲜活饵料的消化功能已经较完善, 人工配合饵料对管角螺的食性驯化较难完成, 可能导致对配合饲料的摄食量较小。缢蛏组的饵料转化效率和能量转换效率要显著高于花蛤组和自制配合饵料组(P<0.05), 说明管角螺在摄食缢蛏时更有利于能量的获得, 而其肝脏指数也表明缢蛏的投喂有利于管角螺的生长和能量物质的累积。
3.2 不同饵料对管角螺肝脏胰消化酶活性的影响
消化酶活力是反映动物消化生理状况和对营养物质利用能力的重要指标, 其活力高低直接影响动物对营养物质的吸收和利用程度。饵料的营养成分是动物消化酶的底物, 各种营养成分的种类和含量与消化酶的活性密切相关。强俊等[16]研究表明: 投喂不同饵料对奥尼罗非鱼(Oreochromis niloticus)仔稚鱼的消化酶活性具有显著影响。Nagase[17]研究发现:莫桑比克罗非鱼(Tilapia mossambica)的胰蛋白酶活性与饵料中蛋白质含量呈正相关关系。本试验中,配合饲料组、菲律宾蛤仔组和缢蛏组各组间的胰蛋白酶比活力都存在显著差异, 其胰蛋白酶比活力大小为缢蛏组>菲律宾蛤仔组>配合饲料组, 这说明饵料组的粗蛋白含量与胰蛋白酶比活力密切相关,但并不是简单的正相关, 表现为投喂鲜活饵料组的胰蛋白酶比活力要显著高于配合饲料组, 其原因可能在于鲜活饵料的适口性好和消化吸收佳, 从而导致酶活性更高、生长更快, 这在很多学者的研究中都得到了证明[18-20]。王重刚等[21]对真鲷(Pagrosomus major)稚鱼投喂不同饵料后, 发现投喂褶皱臂尾轮虫(Brachionus plicatilis)的真鲷稚鱼的蛋白酶活性显著高于配合饲料的。另外, Personle等[22]研究指出:活饵料的某些微量活性物质可能会促进鱼类蛋白酶分泌量的增加, 配合饲料中缺乏这些诱导因子, 会导致蛋白酶活性低于活饵料组。在整个实验的过程中, 配合饲料组的胰蛋白酶活力呈现逐渐增加的趋势, 而菲律宾蛤仔组和缢蛏组在15日之前胰蛋白酶活力急剧上升, 而 15日后胰蛋白酶活力则趋于稳定。这可能是由于管角螺是肉食性的贝类, 菲律宾蛤仔、缢蛏中的营养成分是胰蛋白酶的适宜底物, 而配合饲料中的营养成分不是胰蛋白酶的最适底物, 其蛋白酶活性与饵料中的蛋白含量有一个适应性变化的过程, 这与钱国英[23]的研究结果相似, 研究认为蛋白酶活性对饲料中蛋白含量有适应性变化, 高水平的蛋白质有利于加州鲈鱼(Micropterus salmonides)的生长, 但其有效性还取决于蛋白质的吸收利用情况。
一般来说, 肉食性动物主要以脂肪作为主要的能源物质, 其利用碳水化合物的能力很低, 因而淀粉酶活力一般较低, 但在作者的研究中发现肉食性的管角螺具有较高的淀粉酶活力, 且显著高于脂肪酶活力, 这与Hirche[24]对蛛形互爱蟹(Hyas araneus)的消化酶的研究结果类似。研究发现: 对蛛形互爱蟹的淀粉酶活力高于蛋白酶活力, 他们认为蛛形互爱蟹高的淀粉酶活力不是对食物生化组成(低碳水化合物)的反应, 而可能是祖先幼体部分植食性系统发育的残余。而管角螺的淀粉酶活力相对于脂肪酶活力较高的原因是否也是由于其幼体部分的植食性特点造成的还有待进一步的研究。
从试验结果可见: 不同饵料组的淀粉酶活力和脂肪酶活力呈波动型变化, 配合饲料组的淀粉酶活力和脂肪酶活力与鲜活饵料组均存在显著差异, 说明不同饵料的营养成分与管角螺的淀粉酶活力和脂肪酶活力密切相关。在投喂0~30 d的过程中, 配合饲料组的淀粉酶活力和脂肪酶活力都呈现下降趋势,而投喂30 d后急剧上升, 这与实验开始前(0 d)淀粉酶和脂肪酶活力较高的原因是一致的, 可能是由于配合饲料组长期处于饥饿状态, 为了生存, 管角螺会利用淀粉和脂肪作为能源物质, 从而导致淀粉酶比活力和脂肪酶比活力的增高, 这与草鱼(Ctenopharyngodon idellus)[25]、军曹鱼(Rachycentron canadum)[18]和奥尼罗非鱼(Oreochromis niloticus)[16]等相似, 即所谓的补偿效应。因为脂肪和糖原是大多数水产动物的主要能源物质, 在饥饿或食物不足的情况下, 主要消耗这两类物质[26,27]。
目前还未发现有关于管角螺脂肪酶活力与饵料的关系的报道。李芹[28]在对瓦氏黄颡鱼(Pelteobaggrus vachelli)稚鱼的研究中发现, 脂肪酶活性与饵料中脂肪含量呈正相关关系。苏时萍[29]研究表明: 投喂鲜活饵料组的史氏鲟鱼的脂肪酶活性显著高于饲料组。但也有试验证明, 脂肪酶与饵料中的脂肪含量呈负相关[21]。本研究表明: 鲜活饵料组的脂肪酶活力要高于配合饲料组的, 且饵料中的脂肪含量与管角螺的脂肪酶活力呈正相关。
3.3 不同饵料对管角螺软体部营养成分的影响
管角螺的软体部营养成分的含量与其生存环境、饵料和生长周期都密切相关, 朱爱意[30]等在对东极海区野生管角螺软体部营养成分的研究中指出管角螺的粗蛋白、粗脂肪、水分和灰分别占软体部湿质量的16.91%、0.38%、79.07%和2.20%, 这与作者的试验结果有所差异, 其水分和粗脂肪的含量高于本研究中的不同饵料组, 粗灰分的含量则相反, 而粗蛋白的含量则表现为缢蛏组>野生管角螺>菲律宾蛤仔组>配合饲料组, 这可能是由于管角螺的生存环境和饵料差异所导致的。作者研究发现, 管角螺肌肉中的粗脂肪含量比较低, 不同饵料的投喂对其粗脂肪的含量有一定的影响, 表现为鲜活饵料组的粗脂肪含量要显著高于配合饲料组的(P<0.05), 粗蛋白含量在各组之间均存在显著差异(P<0.05), 其中菲律宾蛤仔和缢蛏投喂组管角螺粗蛋白和粗脂肪的含量与饵料中粗蛋白和粗脂肪的含量呈正相关。而肌肉中水分和灰分含量在各组之间没有显著差异(P>0.05), 这说明管角螺肌肉中的粗灰分和水分含量与饵料没有密切的关系。
综上, 饵料种类对管角螺的生长、肝脏消化酶活性及软体部营养成分均有很大的影响。在管角螺的养殖过程中, 投喂适宜的饵料, 可以加快管角螺的生长, 缩短养殖周期, 菲律宾蛤仔和缢蛏对管角螺的生长具有较好的促进作用, 但其成本太高, 不利于规模化养殖的开展, 配合饲料的开发依然是解决管角螺饵料问题的重要途径, 这就需要对管角螺的营养需求作详细地分析, 从饵料的适口性和消化率等方面入手研究更适合管角螺摄食和消化的饵料配方, 并不断加以完善。
[1]蔡英亚, 张英, 魏若飞. 贝类学概论[M]. 上海: 上海科学技术出版社, 1994: 162-164.
[2]潘英, 王强哲, 陈锋华, 等. 管角螺全人工育苗试验[J]. 水产科技情报, 2007, 34(2): 84-85.
[3]潘英, 陈锋华, 庞有萍, 等. 管角螺的生物学特性及养殖[J]. 水产科学, 2008, 27(1): 24-26.
[4]林志华, 王铁轩, 夏彩国. 管角螺生态及繁殖习性观察[J]. 海洋科学, 1998, 13(5): 11-12.
[5]陆珠润, 蒋霞敏, 段雪梅, 等. 不同温度、底质和饵料对管角螺孵化和稚、幼螺生长的影响[J]. 南方水产,2009, 5(3): 10-14.
[6]Morton B. Prey preference, capture and ration inHemifusus tuba(Gmelin)(prosobranchia: Melongenidae)[J]. Journal of Experimental Marine Biology and Ecology, 1985,94(1/3): 191-210.
[7]杨铭. 管角螺的繁殖生物学观察[J]. 海洋与渔业,2008, 4: 20-29.
[8]潘英, 庞有萍, 罗福广, 等.管角螺的繁殖生物学[J].水产学报, 2008, 32(2): 217-222.
[9]傅余强, 顾谦群, 刘睿, 等. 管角螺肌肉中性糖蛋白的化学组成及抗肿瘤活性研究[J]. 中国海洋药物,2002, 21(6): 20-24.
[10]罗杰, 曹伏君, 李长玲, 等. 管角螺生殖系统解剖学及组织学观察[J]. 水产学报, 2011, 35(4): 570-578.
[11]中国国家标准化管理委员会. GB/T5009.3-2003食品中的水分的测定[S]. 北京: 中国标准出版社, 2003.
[12]中国国家标准化管理委员会. GB/T5009.5-2003食品中的蛋白质的测定[S]. 北京: 中国标准出版社,2003.
[13]中国国家标准化管理委员会. GB/T5009.6-2003食品中的脂肪的测定[S]. 北京: 中国标准出版社, 2003.
[14]中国国家标准化管理委员会. GB/T5009.4-2003食品中的灰分的测定[S]. 北京: 中国标准出版社, 2003.
[15]Huy Q N, Helge R, Per A W, et al. Effects of early weaning strategies on growth, survival and digestive enzyme activities in cobia (Rachycentron canadumL.)larvae [J]. Aquacult Int, 2011, 19: 63-78.
[16]强俊, 王辉, 李瑞伟, 等. 不同饵料对奥尼罗非鱼仔稚鱼生长发育及消化酶活力的影响[J]. 水产科学,2009, 28(11): 618-623.
[17]Nagase G. Contribution to the physiology of digestion inTilapia mossambicadigestive enzymes and the effects of diets on their activity [J]. Z Vergl Physiol,1964, 49: 270- 284.
[18]汤保贵, 陈刚, 张建东, 等. 饵料系列对军曹鱼仔鱼生长、消化酶活力和体成分的影响[J]. 水生生物学报,2007, 31(4): 479-484.
[19]杨代勤.严安生, 陈芳, 等. 不同饲料对黄鳝消化酶活性的影响[J]. 水产学报, 2003, 27(6): 558-562.
[20]钱国英. 不同驯食方式对鳜鱼胃肠道消化酶活性的影响珊[J]. 浙江农业大学学报, 1998, 24(2): 207-210.
[21]王重刚, 陈品健, 顾勇, 等. 不同饵料对真鲷稚鱼消化酶活性的影响[J]. 海洋学报, 1998, 20(4): 103-106.
[22]Personle R J, Alexandre J C, Thebaud L, et al.Marine fish larvae feeding: Formulated diets or live pery [J].World Aquaculture Soc, 1993, 24 (2): 211- 224.
[23]钱国英. 饵料中不同蛋白质、纤维素和脂肪水平对加州鲈生长的影响[J]. 动物营养学报, 2000, 12(2):48-52.
[24]Hirche H J, Anger K. Digestive enzyme activities during laval development ofHyas crcurw[J]. Comp Bochem Phycial, 1987, 87B: 297-302.
[25]沈文英, 林浩然, 张为民. 饥饿和再投喂对草鱼鱼种生物化学组成的影响[J]. 动物学报, 1999, 45(4):404-412.
[26]Jobling M. Effects of starvation on proximate chemical composition and energy utilization of plaice,Pleuronectes platessaL [J]. J Fish Biol, 1980, 17: 325- 334.
[27]Kim M K, Lovell R T. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfishIctalurus punctatusin ponds[J].Aquaculture, 1995, 135: 285-293.
[28]李芹, 刁晓明. 不同饵料对瓦氏黄颡鱼稚鱼生长和消化酶活性的影响[J]. 水生态学杂志, 2009, 2(1):98-102.
[29]苏时萍, 赵兴文. 不同饵料对史氏鲟仔鱼消化酶活性的影响[J]. 生物学杂志, 2005, 22(1): 27-29.
[30]朱爱意, 赵向炯, 杨运琪. 东极海区管角螺软体部营养成分分析[J]. 南方水产, 2008, 4(2): 64-68.

