成团泛菌依赖型磷酸甘油酸变位酶基因的克隆、序列分析及产氢中的差异表达
马颖超, 朱大玲, 王广策
(1. 天津科技大学 海洋科学与工程学院, 天津市海洋资源与化学重点实验室, 天津 300457; 2. 中国科学院海洋研究所, 山东 青岛 266071)
磷酸甘油酸变位酶(phosphoglycerate mutase,PGM; EC5.4.2.1)是糖酵解过程中的一个关键酶, 主要催化 3-磷酸甘油酸(3-phosphoglycerate, 3-PGA)与2-磷酸甘油酸(2-phosphoglycerate, 2-PGA)之间的可逆反应[1-2]。PGM有两种类型: 一种为依赖型磷酸甘油酸变位酶(cofactor-dependent phosphoglycerate mutase, dPGM), 行使功能时需要辅因子(cofactor)2,3-二磷酸甘油酸(2, 3-bisphosphoglycerate, 2,3-BPGA), 存在于所有脊椎动物、大部分无脊椎动物、部分真菌以及某些细菌中, 特别是革兰氏阴性菌中; 另外一种为非依赖型磷酸甘油酸变位酶(cofactor-independent phosphoglycerate mutase, iPGM),催化反应时不需要 2, 3-BPGA 作为辅因子, 存在于所有植物、一些无脊椎动物、部分真菌和细菌中, 特别是革兰氏阳性菌中[3-8]。碳水化合物, 尤其是葡萄糖是异养微生物的主要能源, 用于维持正常的生命活动及生命特征, 而糖酵解又是利用葡萄糖的必经之路, 也是微生物利用葡萄糖的第一步, 所以糖酵解在异养微生物中具有重要作用[9]。氢气是微生物的次级代谢产物, 它的产生离不开糖酵解, 而糖酵解中的关键酶之一PGM也必定与产氢有着密切关系。然而, 目前仅对这两种PGM的基因及蛋白结构方面有很多报道, 有关PGM在氢气产生方面的研究却几乎没有, 因此, 研究 PGM 与产氢的关系, 进而通过调控糖酵解作用来提高氢气产量是一个新的研究方向, 具有重要意义。
成团泛菌(Pantoea agglomerans)BH-18是从红树林污泥中分离纯化获得的一株革兰氏阴性、兼性厌氧、高效产氢菌株[10]。该菌具有生长条件简单、耐氧、耐盐等优点, 是优良的高效产氢候选工程菌株。故本实验以成团泛菌BH-18为对象, 克隆了编码dPGM的基因序列, 并对其序列进行分析, 同时采用RT-PCR的方法监测了成团泛菌BH-18在产氢过程中dPGM基因转录水平上的变化, 为进一步研究成团泛菌产氢机理, 进而改造获得高效产氢菌株奠定基础。
1 材料与方法
1.1 菌株及培养条件
成团泛菌BH-18是从广西省北海(109°E, 21°N)红树林污泥中分离得到的高效产氢菌株。所用的培养基为LMH培养基(pH7.2~7.5), 培养条件为37℃振荡培养[10]。用于提取细菌总DNA的成团泛菌接种于含有100 mL LMH培养基的锥形瓶中; 用于提取产氢过程中细菌总RNA的成团泛菌接种于含有200 mL LMH培养基的血清瓶中, 充入惰性气体后进行间歇产氢实验。
1.2 编码dPGM基因的克隆
1.2.1 成团泛菌BH-18总DNA的提取
取对数期的成团泛菌BH-18, 采用常规酚-氯仿法提取获得细菌总DNA[11], 之后进行1.0 %琼脂糖凝胶电泳来检测DNA的完整性。
1.2.2 引物设计
根据GenBank上已登录的肠杆菌编码dPGM的基因序列设计引物gpmA-1F(5′-ATGGCTGTAACTA AGCTGG-3′)和gpmA-751R(5′-TTACTTCGCTTTACC CTGA)。引物由北京六合华大基因科技股份有限公司合成。
1.2.3 编码dPGM基因的克隆
以成团泛菌BH-18总DNA为模板,gpmA-1F和gpmA-751R 为引物, PCR扩增反应采用25 μL体系:10×Taq Buffer, 2.5 μL; dNTP Mixture(各2 mmol/L), 2 μL;引物(10 μmol/L)各0.5 μL; 模板DNA, 1μL; Taq酶(5 U/μL)(Solarbio), 0.2 μL; 加灭菌蒸馏水至25 μL。反应程序为: 94 ℃ 预变性 5 min; 94 ℃ 3 0 s, 49 ℃ 30 s,72 ℃ 1 min, 35个循环; 72 ℃延伸10 min。PCR扩增产物经1.0 %琼脂糖凝胶电泳检测, 用Bio-Rad Chemi-DocXRS凝胶成像系统采集图像。
1.3 编码dPGM的基因序列分析
PCR产物经凝胶回收试剂盒(Omega)回收后, 由北京六合华大基因科技股份有限公司测序。通过软件BLAST, 将该序列与相似的变位酶基因序列进行比对。同时, 根据推导出的氨基酸序列, 采用Bioedit和Mega4软件构建NJ系统进化树
1.4 dPGM 在产氢过程中转录水平上的差异表达分析
1.4.1 成团泛菌BH-18总RNA的提取
分别在成团泛菌BH-18 产氢开始(A)、产氢2 h(B)、产氢4 h(C)、产氢6 h(D)、产氢8 h(E)和产氢结束(F)6个时间点取发酵液, 离心收集菌体, -80 ℃ 冻存用于RNA的提取。成团泛菌BH-18总RNA通过RNAprep pure培养细胞/细菌总RNA提取试剂盒(天根生化科技有限公司)提取获得。通过1.0 %的琼脂糖凝胶电泳判断RNA的完整性, 通过测定A260/A280判断RNA的浓度和纯度。
1.4.2 引物设计
根据已测定的成团泛菌BH-18中编码dPGM的基因序列, 设计引物gpmA-292F(5′- CTCAACAA AGCCGAAACCGC-3′)和gpmA-565R(5′- CAGGGAG TTACCGTGAGC G-3′)。引物由北京六合华大基因科技股份有限公司合成。
1.4.3 dPGM在产氢过程中转录水平上的差异表达分析
以提取的成团泛菌BH-18总RNA为模板, 根据说明, 用Promega的M-MLV反转录酶合成cDNA第一链, 以此为模板, 用引物gpmA-292F和gpmA-565R,进行RT-PCR扩增dPGM基因的cDNA片段。RT-PCR扩增反应采用25 μL体系: 10×Taq Buffer, 2.5 μL;dNTP Mixture(各2 mmol/L), 2 μL; 引物(10 μmol/L)各0.5 μL; 模板cDNA, 0.5 μL; Taq (5 U/μL)(Solarbio),0.2 μL; 加灭菌蒸馏水至25 μL。然后按以下步骤进行PCR 循环: 94 ℃ 预变性 5 min; 94 ℃ 3 0 s, 53 ℃ 30 s,72 ℃ 1 min, 35个循环; 72 ℃延伸10 min。PCR扩增产物取5 μL 经1.0%琼脂糖凝胶电泳检测, 并用Bio-Rad ChemiDocXRS凝胶成像系统采集图像。
2 结果
2.1 编码dPGM基因的克隆
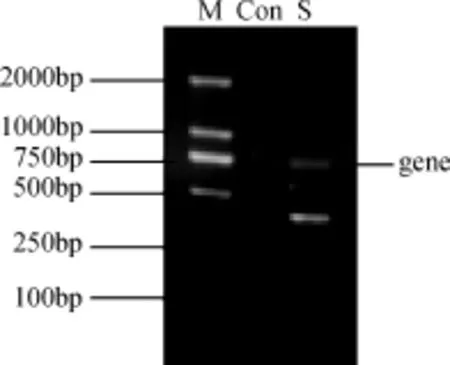
图1 成团泛菌BH-18中编码dPGM基因的克隆Fig.1 Clone of dPGM-encoding gene in Pantoea agglomerans
PCR扩增获得两条带(图1), 片段大小分别约为750bp和500bp。其中750bp与文献中报道的编码dPGM的基因大小一致[12-13], 所以初步确定该条带为目的片段。但是由于该条带较弱, 故回收纯化后进行二次扩增, 以获得高纯目的基因。
2.2 编码dPGM基因的测序结果
将大小约为750 bp的条带大量扩增, 纯化该条带后送该条带到华大基因进行序列测定。测序结果表明该基因整个开放阅读框ORF为753bp, 编码250aa, 序列(GenBank登录号: JX156332)见图2。
2.3 编码dPGM的基因序列分析
测序结果用软件BLAST将该序列与相似的变位酶基因序列进行比对。结果表明该基因保守性相对较高, 与肠杆菌科的众多菌株中的dPGM基因相似性100%, 这也与之前的报道相符[13]。采用Bioedit和Mega4软件成功构建NJ系统进化树, 结果表明成团泛菌BH-18的dPGM氨基酸序列与Enterobacter asburiae的dPGM聚为一类, 而与成团泛菌属菌株的相应蛋白关系较远(图3)。由此表明, dPGM的氨基酸序列在属内不保守。
2.4 成团泛菌BH-18总RNA的提取结果

图2 成团泛菌BH-18中编码dPGM基因完整开放阅读框及推导的氨基酸序列Fig.2 The complete open reading frame of dPGM-encoding gene and the deduced amino acid sequence of dPGM in Pantoea agglomerans BH-18

图3 成团泛菌BH-18 dPGM NJ法构建的系统进化树(基于氨基酸序列)Fig.3 The NJ phylogenetic tree of dPGM in Pantoea agglomerans BH-18, based on the amino acid sequences
如图4所示, 成团泛菌BH-18产氢不同阶段提取的总RNA, 经琼脂糖凝胶电泳检测, 结果总RNA条带清晰, 表明提取的总 RNA完整性较好, 没有发生降解。经紫外分光光度计分析,A260/A280的比值为2.0,表明总RNA无蛋白质和DNA污染。因此提取的总RNA完整性和质量都较好, 可用于反转录及半定量分析。
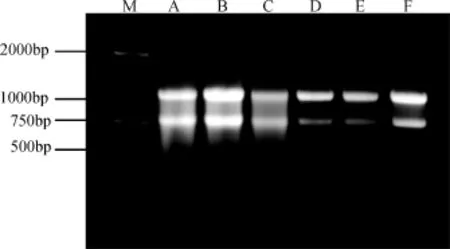
图4 产氢不同阶段提取到的成团泛菌BH-18 RNAFig.4 RNA extraction of Pantoea agglomerans BH-18 in different phases of hydrogen production
2.5 dPGM 在产氢过程中转录水平上的差异表达分析
RT-PCR扩增结果见图5, 图5a是管家基因16s DNA在产氢不同阶段的RT-PCR结果。由图5a可知,管家基因在各个阶段表达稳定, 可以作为样本的参照。图5b是编码dPGM基因在产氢不同阶段的RT-PCR结果。由图5b可知, 在产氢开始时编码dPGM的基因未转录; 在产氢2 h和4 h时基因开始转录但转录量较低; 产氢6 h和8 h时转录量升高,其中产氢6 h时转录量达到最高; 产氢结束后, 该酶还有少量的转录。即酶的转录是伴随着产氢而进行的。

图5 RT-PCR扩增结果Fig.5 RT-PCR amplification results
3 讨论
本实验从成团泛菌BH-18中克隆获得了编码dPGM的基因, 其ORF为753 bp, 编码250 aa。通过BLAST软件, 将编码dPGM的基因与相似的变位酶基因序列进行比对。结果表明该基因保守性较高, 与肠杆菌科众多菌株中的dPGM基因相似性100%。之后又根据翻译获得的氨基酸序列, 采用Bioedit和Mega4软件成功构建NJ系统进化树, 结果表明dPGM的氨基酸序列在属内不保守, 但是与Enterobacter asburiaedPGM的氨基酸序列相似。最后, 采用RT-PCR的方法监测成团泛菌BH-18产氢过程中编码dPGM的基因在转录水平上的变化, 发现酶的转录是伴随着产氢而进行的, 之前的研究[10]显示产氢6 h和8 h是产氢速率较高的阶段, 而在此阶段该酶的转录量也增加, 这说明该基因的转录与产氢情况呈正相关。由此我们推断, 依赖型磷酸甘油酸变位酶可能是成团泛菌BH-18产氢过程中的关键酶之一。
成团泛菌BH-18是一种抗逆性较强的高效产氢菌株。它具有生长条件简单、耐氧、耐盐等优点, 适合作为优良的产氢工程菌株。成团泛菌BH-18并不是在生长初期就产生氢气, 接种的菌株直到对数生长期的后期才开始产生氢气, 产氢时间长达12h, 而且氢气并不是其生长代谢所必须的物质, 由此可见,氢气是成团泛菌BH-18的次级代谢产物。同时, 整个产氢过程一直处于厌氧的环境下, 而一般微生物在厌氧环境中, 需要进行糖酵解作用来提供生命活动所需要的能量, 因此, 糖酵解作用与成团泛菌发酵产氢密切相关, 而通过调控糖酵解作用来提高氢气产量将是一个新的研究方向。磷酸甘油酸变位酶是糖酵解作用中的一个重要酶, 现代医学中把敲除编码磷酸甘油酸变位酶的基因或阻断其表达作为控制肿瘤生长的新思路[14], 而在微生物制氢方面, 目前没有相关的报道, 但本文研究发现dPGM的表达在转录水平上与产氢情况呈正相关, 这一发现表明该酶可能是产氢的关键酶之一, 或许可以通过dPGM来调控糖酵解作用, 进而影响氢气的产生。即便这一设想不能实现, 也可以为深入研究糖酵解作用与产氢过程的相关性及基因工程改造获得高效产氢菌株提供理论依据。
[1]Winn S I, Watson H C, Harkins R N, et al. Structure and activity of phosphoglycerate mutase[J]. Philosophical Transactions of the Royal Society of London. B,Biological Sciences, 1981, 293(1063): 121-130.
[2]Fothergill-Gilmore L A, Watson H C. The phosphoglycerate mutases[J]. Advances in Enzymology and Related areas of Molecular Biology, 1989, 12: 227-313.
[3]Fraser H I, Kvaratskhelia M, White M F. The two analogous phosphoglycerate mutases ofEscherichia coli[J]. FEBS Letters, 1999, 455(3): 344-348.
[4]Jedrzejas M J. Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase[J]. Progress in Biophysics and Molecular Biology, 2000, 73(2-4): 263.
[5]Bond C S, White M F, Hunter W N. Mechanistic implications forEscherichia colicofactor-dependent phosphoglycerate mutase based on the high-resolution crystal structure of a vanadate complex1[J]. Journal of Molecular Biology, 2002, 316(5): 1071-1081.
[6]Johnsen U, Schönheit P. Characterization of cofactordependent and cofactor-independent phosphoglycerate mutases fromArchaea[J]. Extremophiles, 2007, 11(5):647-657.
[7]Foster J M, Davis P J, Raverdy S, et al. Evolution of bacterial phosphoglycerate mutases: non-homologous isofunctional enzymes undergoing gene losses, gains and lateral transfers[J]. PLOS One, 2010, 5(10): 13576.
[8]Bond C S, White M F, Hunter W N. High resolution structure of the phosphohistidine-activated form ofEscherichia colicofactor-dependent phosphoglycerate mutase[J]. Journal of Biological Chemistry, 2001,276(5): 3247-3253.
[9]杨生玉, 王刚, 沈永红. 微生物生理学[M]. 北京: 化学工业出版社, 2007.
[10]Zhu D, Wang G, Qiao H, et al. Fermentative hydrogen production by the new marinePantoea agglomeransisolated from the mangrove sludge[J]. International Journal of Hydrogen Energy, 2008, 33(21): 6116-6123.
[11]卢圣栋. 现代分子生物学实验技术(第二版)[M]. 北京: 中国协和医科大学出版社, 1999.
[12]Matsuzawa, T, Mori K, Kadowaki T, et al. Genome sequence ofPantoea agglomeransStrain IG1[J].Journal of Bacteriology, 2012, 194(5): 1258-1259.
[13]宋林霞, 徐振彪. 磷酸甘油酸变位酶[J]. 生命的化学,2011, 31(1): 86-89.
[14]王娟, 陆彬彬, 李娟, 等. 磷酸甘油酸变位酶 1 (PGAM1)在乳腺癌及癌旁正常组织中的表达及意义 [J]. 现代肿瘤医学, 2012, 19(11): 2213-6.

