脂肪和蛋白质营养对封闭循环水养殖大西洋鲑生长和肌肉品质的效应
柳 阳 , 李 勇 , 高婷婷 , 孙亚琼 , 周邦维 , 王顺奎, 王晓晨
(1.中国科学院 海洋研究所, 山东 青岛 266071; 2.中国科学院大学, 北京 100049; 3. 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071; 4. 山东东方海洋科技股份有限公司, 山东 烟台264003)
大西洋鲑(Salmon salarL.)隶属鲑科(Salmonoidea)鲑属(Salmon)冷水性鱼类, 据其生活习性不同, 可分为洄游型和陆封型两种, 洄游型广泛分布于北欧(北纬 55°~70°, 东 经 10°~30°)和 北 美 东 北 部 (北 纬55°~70°, 西经 50°~84°)[1]。大西洋鲑肌肉富含 ω-3长链高度不饱和脂肪酸, 包括EPA和DHA, 可降低人患冠心病、动脉硬化和其他疾病的风险[2-3], 具有很高的食品营养价值和养殖经济效益。
鱼类对蛋白质和脂肪的消化利用与饲料中所含该类营养的质量和数量密切相关[4-5], 也与特有养殖模式下的水生态环境相关[6-8]。目前对大西洋鲑营养和饲料研究主要针对北欧深海或半潜式网箱养殖模式[9-10], 高脂肪是其配合饲料的主要特点[11-13]。在工业化封闭循环海水养殖模式下, 饲养洄游型大西洋鲑, 在中国尚属首次, 其营养需求特点和专用饲料研究为空白。
本试验研究的目的是在北纬37 °、东经121°的中国东部封闭循环海水养殖模式下, 探讨大西洋鲑的蛋白质和脂肪需求特点。通过设置饲料不同蛋白质和脂肪水平, 进行其对大西洋鲑生长性能和肌肉品质的效应研究, 初步查明在该养殖模式下膨化颗粒配合饲料中脂肪和蛋白质营养的组合特征、需求特点及初步需要量范围, 为工业化养殖大西洋鲑生态营养和肉质改善型配合饲料的研发提供依据。
1 材料与方法
1.1 试验设计与分组
在工业化封闭循环海水养殖条件下, 进行 3×2双因素随机动物试验, 即3个脂肪水平: 18%、21%、24%, 分别以F18、F21、F24表示; 2个蛋白质水平:38%、48%, 分别以P38、P48表示, 共形成6种试验处理膨化颗粒配合饲料, 每处理3个重复。
试验用鱼由山东东方海洋烟台开发区分公司提供。从生产车间养殖池的同源同批大西洋鲑幼鱼中,挑选规格整齐、体格健壮、平均质量在(650.0±45.50)g的幼鲑 720尾, 随机分配到封闭循环水养殖试验车间的18个养殖桶(重复)中, 每重复40尾鱼, 各试验组鱼初始体质量经方差分析差异不显著(P>0.05), 达到同质要求。
1.2 试验饲料
试验饲料组成及营养成分见表1。根据试验设计和同质优化方法, 确定3脂肪水平与2蛋白质水平的6种试验饲料配方, 将其编号为: P38F18、P38F21、P38F24、P48F18、P48F21、P48F24。按照试验饲料配方组成, 将相关原料一次混合、超微粉碎、二次混合、再经水产饲料专用双螺杆挤压膨化机(瑞士布勒公司制造的BCTGD62型)制成直径7 mm缓沉型颗粒配合饲料, 经烘干、冷却、打包后待用。随机抽取各试验饲料样品进行有关营养成分含量分析。
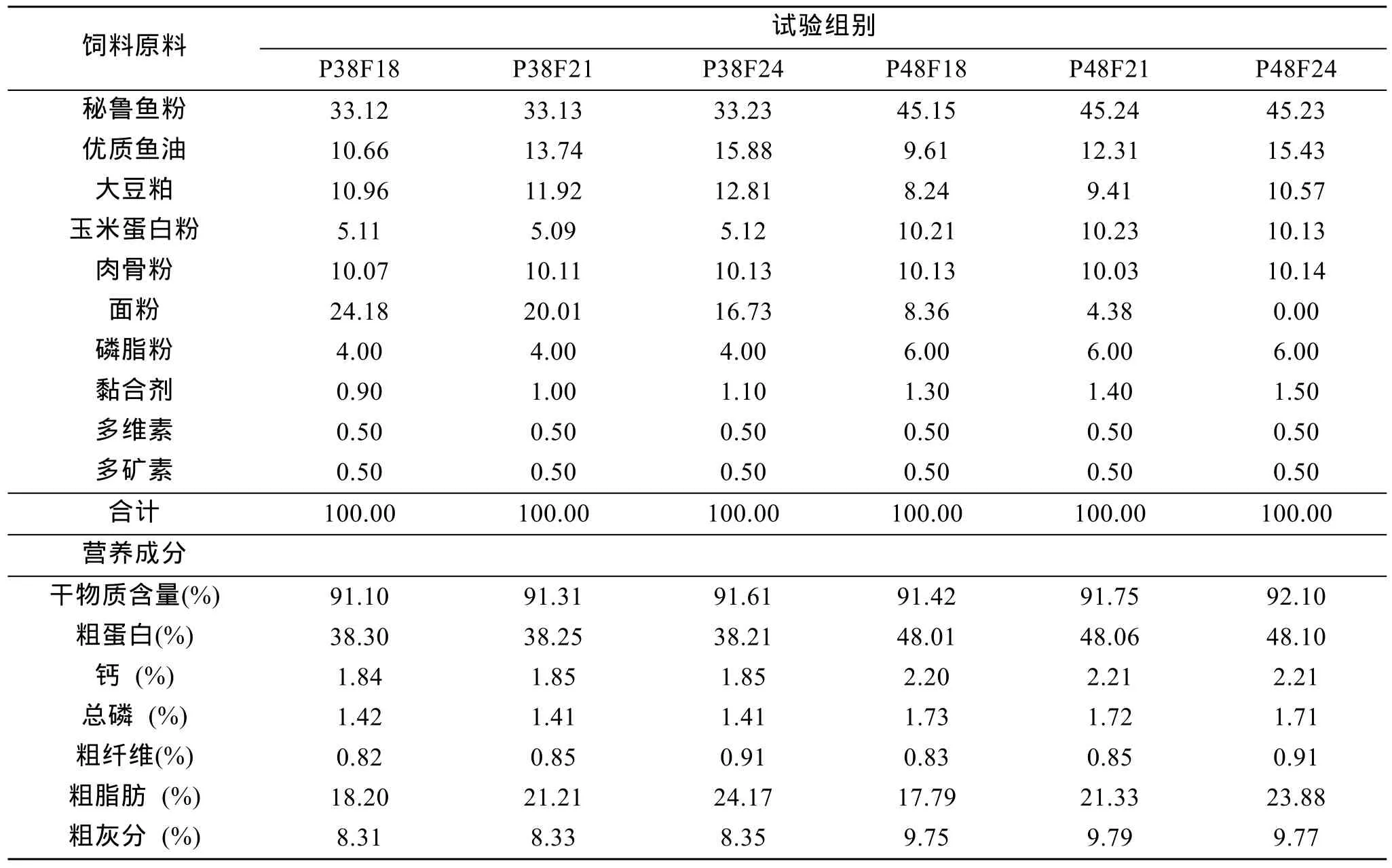
表1 试验膨化颗粒配合饲料组成及主要营养成分含量Tab.1 Ingredients and chemical composition of trial pellet diets for Atlantic salmon (Salmon Salar L.)
1.3 饲养管理
试验于2012年6月~8月进行, 试验期56 d。试验幼鱼养殖在直径2 m、高1 m、体积约2.7 m3的圆桶中, 液氧充氧。封闭循环水养殖系统条件基本一致:养殖初始密度为9.38~9.73 kg/m3, 水源为深井海水、养殖海水温度为 16.8~18.0℃、盐度为 23、pH 为7.2~7.5、溶解氧为 11.4~12.7 mg/L、流速约 3 m3/h, 循环率为24次/d。每天添加新水量约为10%。
试验用鱼适应 1周后开始投喂试验饲料, 适应期投喂 50%挪威 Skretting饲料+50%试验饲料的混合料, 日投饲量约为鱼初始体质量的 0.5%, 每天在8: 00、14: 00、20: 00时间点投喂。投喂时密切观察鱼的摄食动态, 根据其摄食活力及时调整投饵量,每次投饵约0.5 h后, 将残饵用纱绢袋收集, 计算残饵量, 记录实际摄食量。发现死鱼及时捞出并称质量记录。试验开始和结束前, 鱼停食24 h空腹称质量。
1.4 检测指标及方法
1.4.1 生长指标
生长性能指标及测算方法:
日均采食量=(总投喂量-总残饵质量)/试验天数/条数;
增质量率=(末体质量-初始体质量)/初始体质量×100;
特定生长率= (Ln末体质量-Ln初始体质量)/试验天数×100;
饲料系数=摄食量/(末体质量-初始体质量);
成活率=结束鱼数/初始鱼数×100;
每尾日增质量=(平均末体质量-平均出体质量)/试验天数
1.4.2 饲料样品检测方法
依照GB/T 14924.9-2001测定试验饲料的营养成分: 干物质于105℃烘干至恒质量; 粗蛋白用微量凯氏定氮法; 粗脂肪用索氏抽提法; 粗灰分用550℃灼烧法; 粗纤维用酸碱法; 总磷用磷钼蓝分光光度法;钙采用高锰酸钾滴定法。
1.4.3 肌肉样品采集及检测方法
试验开始前从备用的试验用鱼中随机抽取 6条经50 ppm的MS-222麻醉处理后, 在冰盘上解剖, 用解剖剪将鱼皮剪开, 取试验用鱼同一侧的肌肉, 去皮去骨后用组织匀浆机将肌肉样品混合均匀后用密封袋保存并做标记, 放置于-40℃冰箱中保存。肌肉脂肪和蛋白质含量的测定依照 GB/T5009.5-2003和GB/T5009.6-2003测定肌肉粗蛋白和粗脂肪含量, 方法和原理与饲料测定类似。
试验结束前, 试验用鱼停食24 h, 每处理取9条鱼(每重复3条)称体质量测量体长, 置于冰盘上解剖,去皮去骨后取背部相同部位的肌肉, 然后将肌肉样品放置于-40℃超低温冰箱中冷冻保存, 以备肌肉氨基酸和脂肪酸测定所用。
氨基酸测定: 样品的前处理采用盐酸水解法,先将样品烘干, 用索氏抽提法脱脂, 然后样品烘干粉碎后放入6 mol/L优级纯盐酸, 经超声和抽真空后封口, 在110℃烘箱内水解24 h后放入蒸发皿蒸干,移入容量瓶定容过滤后上机分析。色氨酸采用荧光分光光度分析法测定, 胱氨酸采用过甲酸氧化法测定, 其余氨基酸根据 GB/T 18654.11-2008法使用日立L-8800全自动氨基酸分析仪测定肌肉中氨基酸。
脂肪酸的测定: 取适量的肌肉样品, 放入组织粉碎机中绞碎, 真空干燥后干燥样品用乙醚抽提脂肪后, 用0.4 mol/L氢氧化钾-甲醇液酯化30 min, 后用热水浴浓缩, 加水分成, 上层液采用 GB9695.2-2008法利用油脂脂肪酸甲酯气相色谱-质谱分析法,各脂肪酸的含量的确定采用面积归一法计算。
1.5 统计分析
试验数据用SPSS 16.0统计分析软件进行双因素方差分析(Multivariate), 多重比较采用LSD和Duncan氏法进行, 结果数值均用平均数±标准误(Mean±S.E.)表示。
2 试验结果
2.1 生长性能
2.1.1 日均摄食量
图1显示了试验期间各处理组试验用鱼日均摄食量变化情况, 随时间推移呈缓慢上升趋势, 高蛋白中高脂肪组(P48F21、P48F24)和与低蛋白高脂肪组(P38F24)处理组表现出持续较高采食量, 高蛋白中脂肪组合(P48F21)日均摄食量最高。
表2显示, 饲料脂肪对日均摄食量有显著性影响。其随脂肪水平增加有先增加后降低特征, 中脂组(F21)显著高于低脂组(F18)。
饲料蛋白水平对日均摄食量未有显著性, 但高蛋白组明显高于低蛋白组。
两因素对日均摄食量的互作效应接近显著水准,在高蛋白中脂肪组(P48F21)有最大值, 极显著高于低蛋白低脂肪组(P38F18)65.14%(P<0.01)。
2.1.2 增质量指标
表2方差分析结果显示, 饲料脂肪对各生长指标均有极显著性影响(P<0.01), 增质量率、特定生长率随脂肪含量的增加有先增加后降低的趋势, 增质量率在中高脂肪组(平均值: 28.7%)达到最大值, 比低脂肪组(19.99%)极显著提高46.72%(P<0.01)。
饲料蛋白对各生长指标均有极显著性影响(P<0.01), 高蛋白组的增质量率、特定生长率分别比低蛋白质组极显著提高44.99%、40.82%(P<0.01)。
脂肪和蛋白两因素对各生长指标均具有显著的互作效应(P<0.05), 增质量率、特定生长率在高蛋白中脂肪组合(P48F21)有最大值。
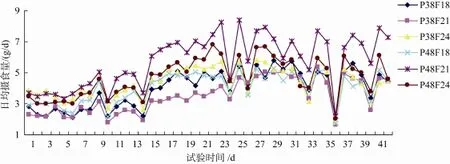
图1 部分试验期间各处理组每尾大西洋鲑日均摄食量的变化趋势Fig.1 Variation of average daily feed intake for the Atlantic salmon during the part experiment period
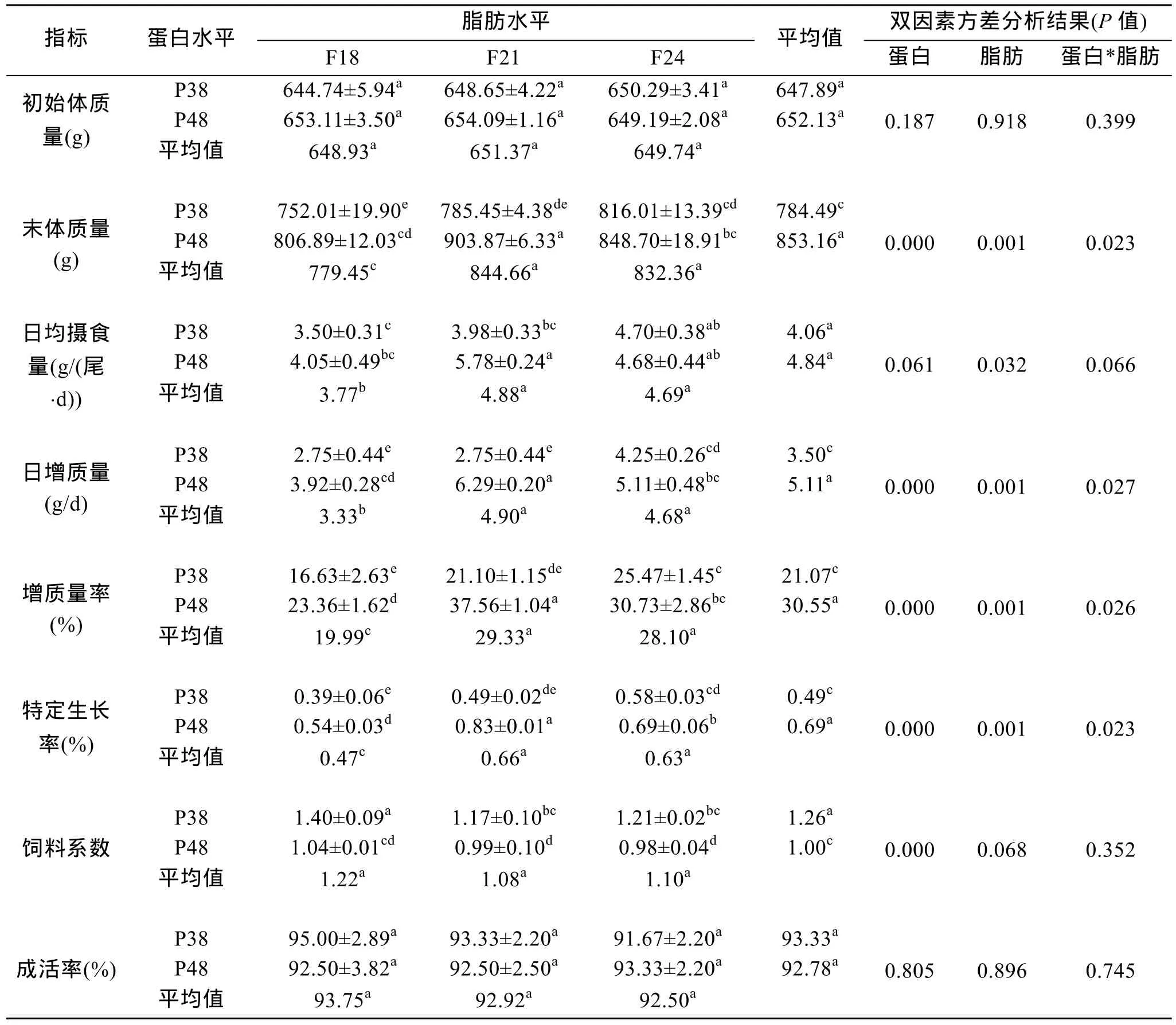
表2 饲料不同脂肪和蛋白含量对大西洋鲑鱼生长性能影响Tab.2 The effects of different feed fat and protein contents on growth performance of Atlantic salmon(Salmon salar L.)
2.1.3 饲料系数
饲料脂肪水平对饲料系数无显著影响(P>0.05),但其随饲料脂肪水平有降低的趋势, 在中、高脂肪(F21、F24)有最小值, 比低脂肪(F18)分别降低了10.70% 和10.91%。
饲料蛋白对饲料系数有极显著性影响, 高蛋白组极显著低于低蛋白组16.3%(P<0.01)。
两因素互作效应对饲料系数不显著(P>0.05)。中脂肪高蛋白(P48F21)饲料系数最低。
2.2 肌肉成分结果
2.2.1 肌肉化学成分
试验之前随机取 6条试验用鱼测其肌肉中脂肪和蛋白质含量(表 3), 肌肉脂肪含量为 4.27%、肌肉蛋白质含量为22.09%。
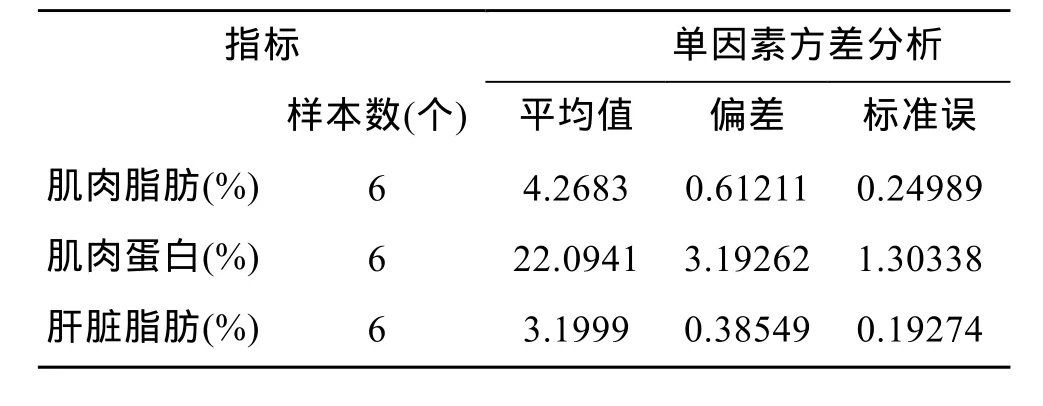
表3 试验前试验用鱼肌肉和肝脏中脂肪和蛋白质含量(占鲜样百分比)Tab.3 The body chemical composition of 6 randomly selected fish at the start of experiment(% of wet weigh)
由表4可见, 经过56 d养殖试验后, 试验用鱼肌肉粗脂肪平均含量高于试验前, 但粗蛋白平均含量低于试验前。
饲料脂肪对肌肉脂肪及蛋白含量均无显著性影响(P>0.05), 但随饲料脂肪水平增加肌肉脂肪含量先增加后降低。
饲料蛋白含量对肌肉脂肪、蛋白均有极显著性影响, 肌肉脂肪含量在低蛋白组极显著高于高蛋白组 18.14%(P<0.01); 肌肉蛋白质在高蛋白组极显著高于低蛋白组5.83%(P<0.01)。
蛋白和脂肪两因素对肌肉脂肪、蛋白含量互作效应不显著(P>0.05)。
2.2.2 肌肉氨基酸
表5表明, 试验共测得17中氨基酸, 其中必需氨基酸9种, 非必需氨基酸种8种。
饲料脂肪对氨基酸含量无显著影响(P>0.05), 谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)、天门冬氨酸(Asp)是影响鱼类肌肉口味的 4种风味氨基酸, 这 4种氨基酸含量随脂肪水平的增加有降低趋势。
饲料蛋白对肌肉 13种(必需氨基酸与风味氨基酸)氨基酸含量有显著影响, 高蛋白组含量高于低蛋白组3.6%~17%(P<0.05或0.01), 说明高蛋白饲料有利于氨基酸在肌肉中沉积。Asp、Glu、Gly在高蛋白组分别比低蛋白组显著或极显著提高 4.65%(P<0.05)、6.03%(P<0.05)、8.62%(P<0.01)。
饲料脂肪和蛋白两因素对肌肉氨基酸互做效应不显著(P>0.05)。
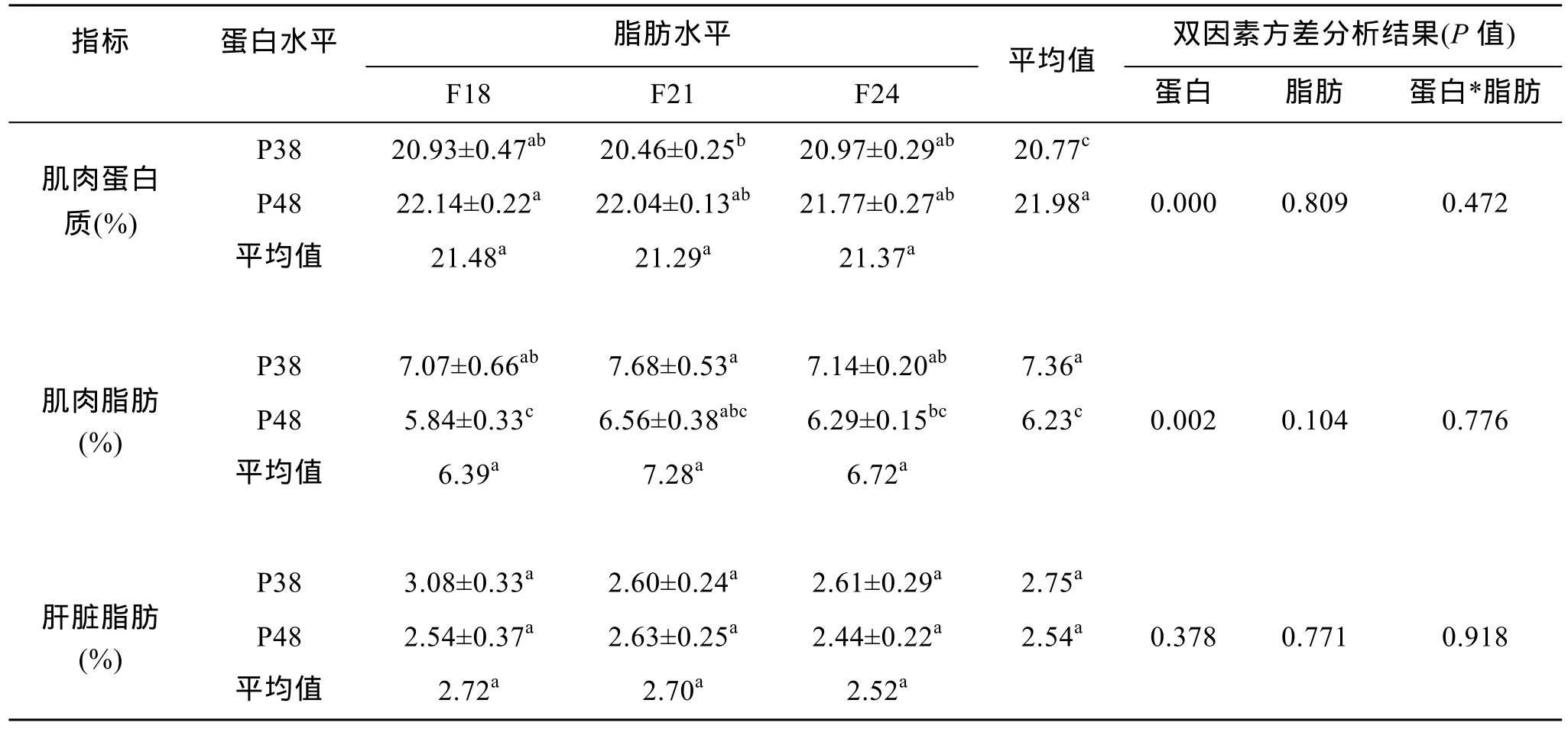
表4 试验结束后各处理组试验用鱼肌肉和肝脏中脂肪和蛋白质含量(占鲜样百分比)Tab.4 The body chemical composition of different treatments of fish at the end of experiment(% of wet weigh)
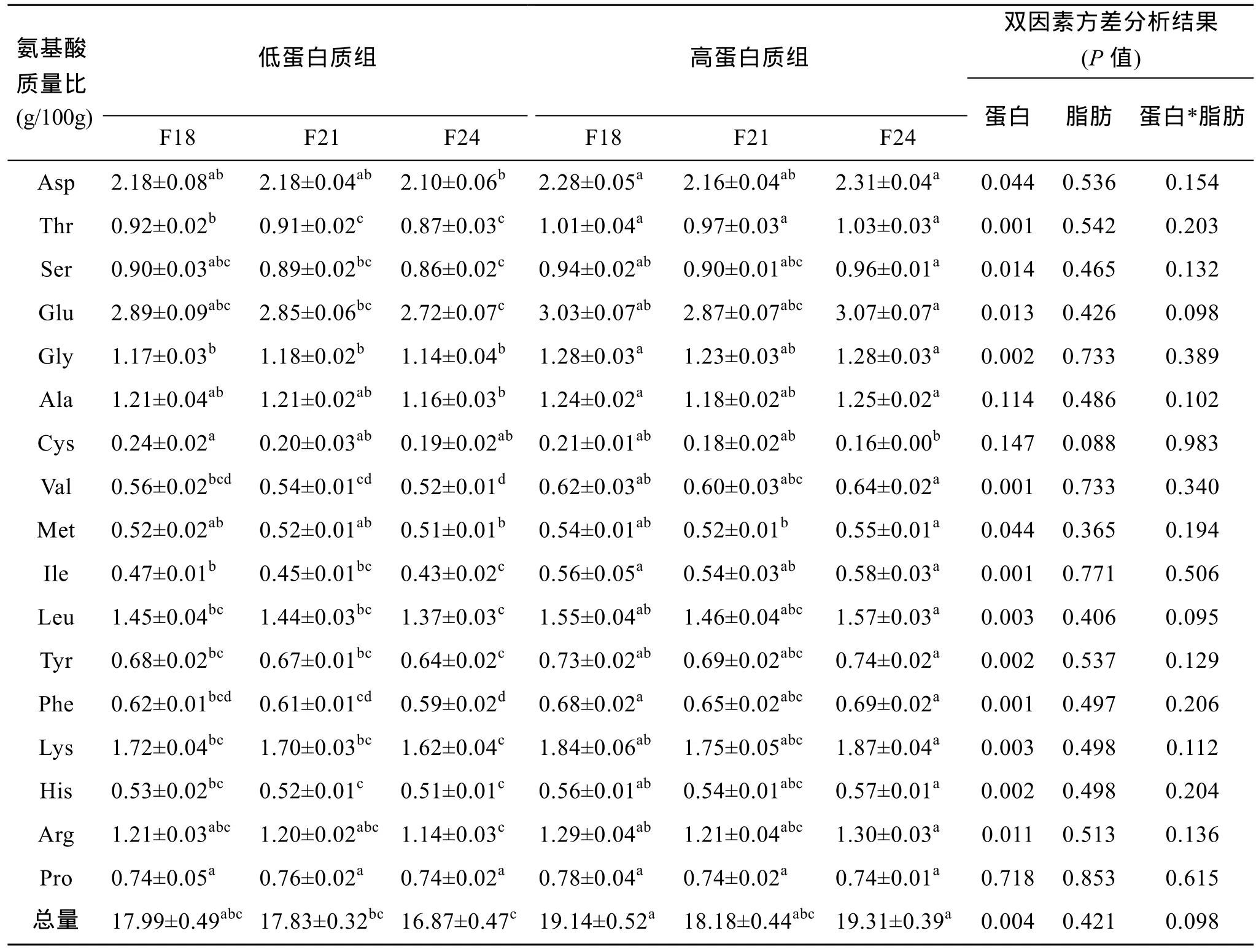
表5 饲料不同脂肪和蛋白含量对大西洋鲑肌肉氨基酸含量影响(占鲜样百分比)Tab.5 The effects of different feed fat and protein contents on amino acid in muscle of Atlantic salmon(Salmon salar L.)(% of wet weigh)
2.2.3 肌肉脂肪酸
从表 6可见, 饲料脂肪水平对∑ω-3PUFA、∑ω-6PUFA、DHA有显著影响, 其含量随饲料脂肪含量升高而升高(图 2), 高脂肪(F24)比低脂肪(F18)分别显著或极显著高 13.98%、26.6%、15.41%(P<0.01或 0.05); 饲料脂肪虽然对 EPA的作用不显著, 但EPA在高脂肪水平比低脂肪提高7.67%。
饲料蛋白水平对∑ω-3PUFA 、∑ω-6PUFA、∑HUFA、EPA 、DHA 有显著或极显著影响(P<0.01或 0.05), 但其含量与饲料蛋白质水平呈负相关, 即低蛋白组高于高蛋白组。低蛋白水平极显著提高肌肉 ω-3不饱和脂肪酸含量(P<0.05), 分别显著提高DHA、EPA含量11.91%、10.02%(P<0.01或0.05)。
脂肪和蛋白两因素对 22: 6ω-3(DHA)、∑ω-6PUFA有显著互作效应(P<0.05), 肌肉高不饱和脂肪酸在低蛋白中高脂肪(P38F21和P38F24)或高脂肪高蛋白(P48F24)组合有较大含量。中脂肪低蛋白(P38F21)或高脂肪高蛋白(P48F24)对 DHA的组合效应极显著(P<0.01)。
3 讨论
3.1 饲料蛋白质和脂肪水平对生长性能影响
多数国外网箱养殖模式研究表明, 高脂肪饲料可显著促进大西洋鲑的生长, 即通过降低蛋白质和碳水化合物的相对量来提高饲料利用率进而提高生长率[12-16]。Soberg[12]用含 38%和 47%脂肪等氮饲料投喂2.05 kg大西洋鲑, 高脂肪组增质量率显著提高31个百分点。但是有研究结果表明: 虽然适当提高饲料脂肪可促进大西洋鲑生长, 提高蛋白质效率[13,17],但过高脂肪不仅在一定程度上抑制大西洋鲑生长和蛋白质效率提高, 且会导致体脂过高而降低肉色和肉质品质[18,19]。本研究结果与国外高脂肪促进生长结果不同, 而与Karalazos、Sveier[17,19]等结果相近, 即适当提高饲料脂肪水平可促进鲑鱼生长, 但进一步提高时不仅未出现增质量率持续增长现象, 反而略有降低。说明在工业化封闭循环水养殖条件下, 大西洋鲑对脂肪需求量并不像国外深海网箱那样高(挪威鲑鱼饲料脂肪38%~40%、苏格兰鲑鱼饲料脂肪和爱尔兰鲑鱼饲料脂肪26%~28%[12]), 饲料脂肪在约21%~24%即可满足需要。分析原因如下: (1)游泳能力强的鲑鱼在工业化封闭循环水养殖时活动空间小, 对高能量的脂肪需求相应下降; (2)工业化封闭循环水系统水质净化装置对高脂肪饲料溶失到水体中的油污去除作用微弱,水质易恶化, 影响鱼类摄食量和增质量率, 对高蛋白组的影响更明显(表2); (3)饲料过高脂肪会增加肝脏代谢负担, 易造成脂肪肝[20], 影响生长。
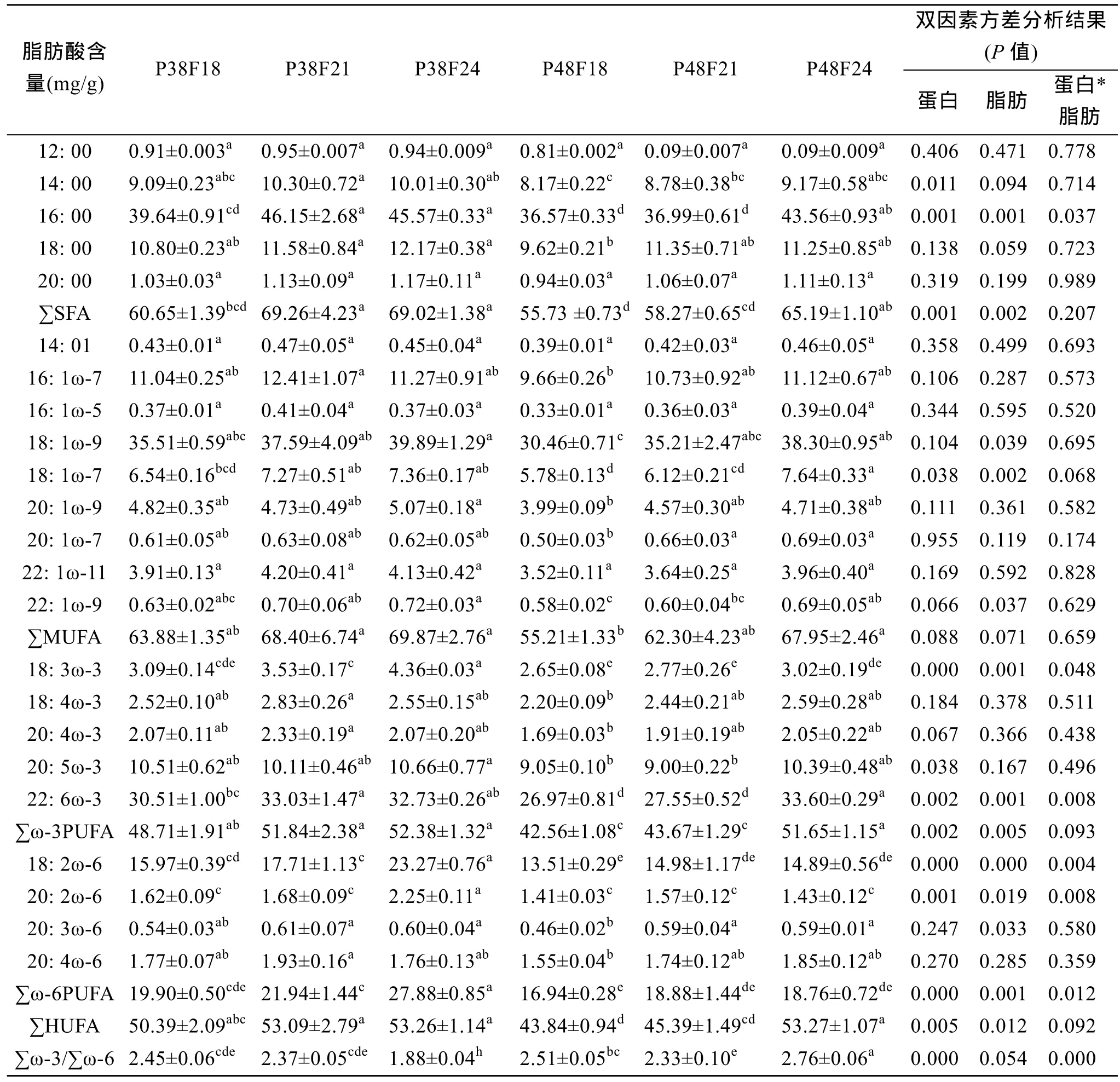
表6 饲料不同脂肪和蛋白含量对大西洋鲑肌肉脂肪酸含量影响(绝干样)Tab.6 Effects of different feed fat and protein contents on fatty acid in muscle of Atlantic salmon (Salmon salar L.)

图2 不同脂肪水平对肌肉脂肪酸的影响Fig.2 The effects of fatty acid on muscle of Salmon salar L.under different fat levels
饲料蛋白水平直接影响大西洋鲑生长, 特别是当饲料脂肪较高时, 蛋白水平可能是控制生长的关键营养因子[21]。研究表明, 增加饲料蛋白含量可促进大西洋鲑生长和提高饲料利用效率[22-24], 高蛋白饲料也可促进其他鲑科鱼类生长, 如褐鳟(Salmo trutta)幼鱼(45%和37%)[25]、虹鳟(Oncorhynchus mykiss)(42.9%和36.8%)[26]和大西洋鳕(Gadus morhua)(25%、45%和65%)[27]。但 Karalazos[28]报道添加菜籽油后低蛋白(32.8%和34.5%)饲料并不影响大西洋鲑生长。Ulla[21]研究表明, 大西洋鲑对蛋白需求量与生活史密切相关,大西洋鲑鱼苗(Parr)比银化期幼鲑(Smolt)蛋白需求低。本研究结果与 Bendiksen[22-24]等相似, 高蛋白组增质量率和饲料利用率比低蛋白组显著提高, 说明工业化封闭循环水养殖大西洋鲑对饲料蛋白质有较高需求,提高饲料蛋白水平可促进生长和提高饲料利用效率,其原因可能与脂肪需求降低有关。
本试验中, 饲料脂肪和蛋白质量因素互作效应对增重率影响显著(P<0.05), 而对饲料利用率不显著, 高蛋白中脂肪(P48F21)为提高生产性能最优组合。国外研究报道的适合大西洋鲑生长和饲料利用效率的饲料蛋白含量在34%~50%, 脂肪在20%~47%, 同时又认为提高饲料脂肪比例有利于节约蛋白质[22,29-30], 高蛋白/低脂肪有较低生长性能[21]。本研究互作组合效应与其有相似之处, 也有不同点, 说明中国工业化封闭循环水养殖大西洋鲑, 并不能照搬国外网箱养殖推崇的高脂肪饲料[12,29,30]。
3.2 饲料蛋白质和脂肪水平对肌肉品质效应
3.2.1 对肌肉蛋白质和脂肪含量的影响
饲料蛋白质/脂肪构成可影响试验用鱼肌肉蛋白和脂肪含量[15,31-33], 从而影响肌肉品质。鱼类肌肉脂肪含量在一定范围内与饲料油脂水平呈正相关[15]。投喂高脂肪饲料可提高大西洋鲑肌肉脂肪沉积但不增加肌肉蛋白含量[12]; 但饲料脂肪过量并不能使肌肉沉积更多脂肪[20]。Karalazos[17]用3种不同水平脂肪饲料投喂大西洋鲑, 肌肉脂肪含量增加趋势是中>高>低, 肌肉蛋白含量低于试验前且各组间差异不显著。本试验结果与上述结果相近, 饲料脂肪水平对肌肉脂肪和蛋白含量作用虽不显著, 但中脂肪水平具有提高肌肉脂肪趋势。
Ulla[21]报道, 饲料高蛋白更利于增加大西洋鲑肌肉蛋白质; Harald[24]用不同蛋白梯度(30%、35%、45%)饲料投喂330g大西洋幼鲑, 随饲料蛋白增加肌肉蛋白含量持续增加(先缓增后急增), 肌肉脂肪则逐渐降低。本试验效应与上述研究相一致, 饲料蛋白水平对试验用鱼肌肉脂肪和蛋白含量均有作用, 高蛋白饲料极显著提高肌肉蛋白含量, 而低蛋白饲料有助于提高肌肉脂肪含量。
本试验鱼肌肉脂肪含量较高于试验前, 而肌肉蛋白含量较低于试验前, 这一结果与大西洋鲑随生长期延长肌肉脂肪增加而蛋白下降的规律一致, 也与相关研究报道[12,24,31]相符合。
3.2.2 对肌肉氨基酸含量影响
饲料蛋白和脂肪含量对大西洋鲑肌肉氨基酸含量影响研究较少, 主要集中在对血浆游离氨基酸研究[34]。Espea[35]报道, 15%和 30%鱼浓缩蛋白饲料可提高大西洋鲑血浆游离氨基酸浓度。饲料的组成、蛋白质和氨基酸质量与鱼体组织中氨基酸的类型和含量相关[36-42]。Ogata[40]指出, 欧洲鳗鱼(Anguilla anguilla)肌肉总游离氨基酸含量与饲料蛋白含量呈正比。Marin[25]用蛋白质/碳水化合物分别为45/28和37/40的两种饲料投喂褐鳟幼鱼, 结果表明高蛋白饲料能有效提高血浆中氨基酸的浓度, 高蛋白组总氨基酸、必需氨基酸、非必需氨基酸的浓度分别比低蛋白组提高27.93%、39.12%、15.63%。鱼粉因具理想营养成分是肉食性鱼类最有价值的蛋白来源, 高鱼粉饲料意味着有更均衡的必需氨基酸组成[39]。本试验研究结果与前人关于相关鱼类研究结果一致,首次证明了工业化封闭循环水养殖模式下, 高蛋白饲料极显著提高大西洋鲑肌肉氨基酸含量。说明提高饲料蛋白质水平, 且鱼粉比例同步增加, 提高了试验用鱼对优质氨基酸的采食和消化吸收, 从而有利于肌肉氨基酸沉积。
高蛋白饲料显著提高了试验鱼肌肉 3种风味氨基酸(谷氨酸 Glu、甘氨酸 Gly、天冬氨酸 Asp)和 5种必需氨基酸(赖、苏、色、精、蛋氨酸)的含量(P<0.01或 0.05), 这对运用蛋白质营养调控提高工业化封闭循环水养殖大西洋鲑肌肉营养价值和风味有重要意义。
目前尚未见到国内外有关饲料脂肪水平对鱼类肌肉氨基酸影响的研究报道。本试验研究表明, 饲料脂肪水平对试验用鱼肌肉氨基酸含量无显著影响,此结果符合脂肪代谢规律, 即脂肪摄入后主要用于机体脂肪酸及脂肪合成和能量消耗, 对氨基酸等其他营养素的沉积并无直接作用。
3.2.3 对肌肉脂肪酸含量影响
饲料脂肪水平、类型和脂肪酸比例等影响鱼体的脂肪酸含量及组成[13,43-45]。肌肉脂肪酸含量与饲料中的比例呈线性关系[46-47]。Tocher[48]研究表明, 饲料高脂肪含量影响大西洋鲑脂肪酸代谢, 改变肌肉脂肪酸组成和脂肪含量, 进而影响其营养品质。采食脂肪26.3%饲料鱼的肌肉 EPA、DHA、ω-3PUFA含量比采食 14.1%分别显著提高 4.76%、59.26%、19.56%。本试验研究结果与上述报道较为一致, 即肌肉各脂肪酸含量(∑SFA、∑ω-6PUFA、EPA、DHA)分别与饲料脂肪含量呈正相关。其原因在于, 试验饲料以约含27%的ω-3PUFA优质鱼油为脂肪源, 随鱼油添加量提高饲料脂肪水平增加。大西洋鲑对PUFA尤其是ω-3PUFA吸收利用能力较强[49], 所以随饲料脂肪增加, 肌肉PUFA含量也增加。鱼类必需脂肪酸在饲料脂肪水平提高时更容易在肌肉中沉积[47,50]。
国内外甚少有饲料蛋白含量对大西洋鲑肌肉脂肪酸组成影响的研究报道。本试验研究发现, 试验鱼肌肉不饱和脂肪酸(包括 DHA、EPA等)在采食低蛋白饲料时显著提高, 说明低蛋白(而非高脂肪)饲料有利于试验用鱼肌肉不饱和脂肪酸合成。本课题后续测试发现, 低蛋白组试验用鱼肌肉脂肪酸合成酶(FAS)活性的确高于高蛋白组。脂肪酸合成酶主要产物为饱和脂肪酸16: 0和 C18: 0[47], 不饱和脂肪酸ω-3、ω-6 及 ω-9, 以十六或十八碳饱和脂肪酸为母链采用去饱合和增加碳链作用形成同系列长碳链及较高不饱和度的脂肪酸[51]。由于饲料高蛋白会造成肌肉脂肪酸合成酶活性下降, 从而抑制饱和脂肪酸在肌肉中合成, 进而减少不饱和脂肪酸在肌肉中的含量。这一特征发现揭示出, 对于采食较高脂肪含量(16%以上)基础饲料的大西洋鲑鱼, 欲增加肌肉中DHA、EPA等不饱和脂肪酸含量, 适当降低饲料蛋白含量是重要营养调控措施之一。
从人类消费看, 鱼类营养价值与肌肉高不饱和脂肪酸(HUFA)含量密切相关, EPA、DHA是衡量大西洋鲑肌肉品质最重要指标之一。本试验所测0.7~0.9 kg试验用鱼肌肉干样中EPA、DHA含量分别在 9.00~10.66、27.55~33.60 mg/g, 与文献[52]报道比较, EPA分别与野生(9.24 mg/g)和养殖(11.70 mg/g)大西洋鲑的相当; DHA高于野生(18.34 mg/g), 与养殖(33.75 mg/g)相当[52]。也高于用鱼油和菜籽油饲料投喂1.44~2.02 kg 大西洋鲑的 8.0~10.6、18.5~32.8 mg/g[47]。
4 小结
研究揭示, 与目前国外深海网箱养殖相比, 工业化封闭循环水养殖大西洋鲑对脂肪营养需求有一定程度降低, 饲料脂肪在约 21%~24%即可满足生长需要; 而对蛋白质营养需求较高, 饲料蛋白水平从38%提高到48%, 显著促进生长和提高饲料利用率。
试验表明, 在中国工业化封闭循环水养殖模式下, 完全可以生产出富含EPA和DHA的高品质大西洋鲑鱼。肌肉ω-3HUFA 含量与饲料脂肪水平正相关,与蛋白水平呈负相关; 而肌肉主要氨基酸含量只与蛋白水平呈正相关。
两因素与生长性能及肌肉品质间多种正负关联特征表明, 把握营养素调控的平衡与适度是至关重要的。本试验研究证明, 中高脂肪与中低蛋白组合,既利于提高生长性能, 又增加肌肉ω-3HUFA和主要氨基酸沉积, 为工业化养殖大西洋鲑的肉质改善型配合饲料研制提供了重要依据。
致谢: 感谢山东东方海洋科技股份有限公司开发区分公司为本研究提供的试验支持!感谢“大西洋鲑循环清洁生产系统研发与产业化项目”的大力资助!
[1]Folmar L C, Dickhoff W W. The parr-smolt transformation (smoltification)and seawater adaptation in salmonids [J].Aquaculture, 1980, 21: 1-37.
[2]Kris Etherton P M, Harris W S, Appel L J. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease [J].Circulation, 2002, 106:2747-2757.
[3]Kris Etherton P M, Harris W S, Appel L J.Omega-3 fatty acids and cardiovascular disease: new recommend ations form the American Heart Association [J].Arterioscler Thromb Vasc Biol, 2003, 23, 151-152.
[4]Stickney R R. Lipid requirement of some warm waters species [J]. Aquaculture, 1989, 79: 145-156.
[5]Kanazawa A. Essential fatty acid and lipid requirement of fish [M].London: Academic Perss, 1985: 281-298.
[6]Rungruangsak K, Torrissen G M, Pringle G M, et al.Effects of varying rearing temperatures on expression of different trypsin isozymes, feed conversion efficiency and growth in Atlantic salmon (Salmo salarL.)[J].Fish Physiology and Biochemistry, 1988, 19(3):247-255.
[7]Harrison P J, Thompson P A, Guo M, et al. Effects of light, temperature and salinity on the growth rate of harmful marine diatoms,Chaetoceros convolutusandC.concavicornisthat kill netpen salmon [J]. Journal of Applied Phycology, 1993, 5(2): 259-265.
[8]Koskela J, Pirhonen J, Jobling M. Effect of low temperature on feed intake, growth rate and body composition of juvenile Baltic salmon[J].Aquaculture International, 1997, 5: 479–487.
[9]Naylor R, Hindar K, Fleming I A, et al. Fugitive salmon:assessing the risks of escaped fish from net-pen aquaculture [J]. Bio Science, 2005, 55 (5): 427-437.
[10]Dempster T, Juell J E, Fosseidengen J E, et al.Behaviour and growth of Atlantic salmon (Salmo salarL.)subjected to short-term submergence in commercial scale sea-cages [J]. Aquaculture, 2008, 276: 103-111.
[11]Austreng E. Fat content in dry diets for salmon parr (Salmo salarL.)[M]. Norway: Sci Rep Agri Univ, 1976: 16.
[12]Solberg C. Influence of dietary oil content on the growth and chemical composition of Atlantic salmon(Salmo salarL.)[J].Aquaculture Nutrition, 2004, 10:31-37.
[13]Hillestad M, Johnsen F, Austreng E, et al. Long-term effects of dietary fat level and feeding rate on growth,feed utilization and carcass quality of Atlantic salmon[J].Aquaculture Nutrition, 1998, 4: 89-97.
[14]Alsted N, Johnsen A. The influence of dietary protein:fat ratio on the growth of rainbow trout,Salmo gairdneri[C]// Tokyo: University of Fisheries, 1990:209–232.
[15]Hemre G I, Sandnes K, Lie O, et al. Carbohydrate nutrition in Atlantic salmon (Salmo salarL.): growth and feed utilization[J]. Aquaculture Research, 1995, 26:149-154.
[16]Cho C Y. Feeding systems for rainbow trout and other salmonids with reference to current estimates of energy and protein requirements [J].Aquaculture, 1992, 100:107-123.
[17]Karalazos V, Bendiksen E Å, Dick J R, et al. Effects of dietary protein and fat level and rapeseed oil on growth and tissue fatty acid composition and metabolism in Atlantic salmon (Salmo salarL.)reared at low water temperatures [J]. Aquaculture Nutrition, 2007, 13:256–265.
[18]Johansen S S, Ekli M, Stangnes B, et al. Weight gain and lipid deposition in Atlantic salmon,Salmo salar,during compensatory growth: evidence for lipostatic regulation [J]. Aquaculture Research, 2001, 32:963-974.
[19]Sveier H, Wathne E, Lied E. Growth, feed and nutrient utilisation and gastrointestinal evacuation time in Atlantic salmonSalmo salarL.: the effect of dietary fish meal particle size and protein concentration [J].Aquaculture, 1999, 180: 265–282.
[20]Webster C D, Tiu L G, Tidwell J H, et al. Effects of dietary protein and lipid levels on growth and body composition of sunshine bass (Morone chrysopsxM.Saxatilis)reared in cages [J].Aquaculture, 1995, 131:291-301.
[21]Ulla N, Groingunn H, Tom H. Growth and body composition of Atlantic salmon (Salmo salarL.)parr and smolt fed diets varying in protein and lipid contents[J]. Aquaculture, 2002, 207: 65-78.
[22]Bendiksen E Å, Berg O K, Jobling M, et al.Digestibility, growth and nutrient utilisation of Atlantic salmon parr(Salmo salarL.)in relation to temperature,feed fat content and oil source[J]. Aquaculture, 2003,224: 283-299.
[23]Higgs D A, Sutton J N, Kim H,et al. Influence of dietary concentrations of protein, lipid and carbohydrate on growth protein and energy utilization, body composition,and plasma titres of growth hormone and insulin-like growth factor-I in non-transgenic and growth hormo transgenic coho salmon,Oncorhynchus kisutch(Walbaum)[J]. Aquaculture, 2009, 286: 127-137.
[24]Harald S, Arnt J R, Einar L. Growth and protein turnover in Atlantic salmon (Salmo salarL.): the effect of dietary protein level and protein particle size [J].Aquaculture, 2000, 185: 101-120.
[25]Marin I V, Borras J F, Blasco J. Effects of the protein/carbohydrate ratio of extruded diets on protein synthesis, protein growth and body composition in juvenile brown trout (Salmo trutta)[J]. Aquaculture International, 2006, 14: 337–353
[26]Lanari D, Agaro E D, Turri C. Use of nonlinear regression to evaluate the effects of phytase enzyme treatment of plant protein diets for rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture, 1998,161(1–4): 345–356.
[27]Alexandra D, Einar L. Dietary protein levels affect growth and protein metabolism in trunk muscle of cod,Gadus morhua[J].Journal of Comparative Physiology B,1992, 162: 351-357.
[28]Karalazos V, Bendiksen E Å, Bell J G. Interactive effects of dietary protein/lipid level and oil source on growth, feed utilization and nutrient and fatty acid digestibility of Atlantic salmon [J]. Aquaculture, 2011,311: 193-200.
[29]Azevedo P A, Leeson S, Cho C Y, et al. Growth,nitrogen and energy utilization of juveniles from four salmonid species: diet, species and size effects [J].Aquaculture, 2004, 234: 393-414.
[30]Einen O, Roem A J. Dietary protein/energy ratios for Atlantic salmon in relation to fish size: growth, feed utilization and slaughter quality [J]. Aquaculture Nutrition, 1997, 3: 115-126.
[31]Company R, Calduch G J A, Perez S J, et al. Protein sparing effect of dietary lipids in common dentex(Dentex dentex): a comparative study with sea bream(Sparusaurata)and sea bass (Dicentrarchus labrax)[J].Aquaculture Living Resource, 1999, 12: 23-30.
[32]Arzel J, Metailler R, Le G P, et al. Relationship between ration size and dietary protein level varying at the expense of carbohydrate and lipid in triploid brown trout fry,Salmo trutta[J]. Aquaculture, 1998, 162:259–268.
[33]Brauge C, Medale F, Corraze G. Effect of dietary carbohydrate levels on growth, body composition and glycaemia in rainbow trout,Oncorhynchus mykis,reared in seawater[J].Aquaculture, 1994, 123(1-2): 109-120.
[34]Wilson R P, Tocher D R, Bell J G. Hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition of liver in salmonids: effects of dietary vegetable oil[J].Comparative Biochemistry Physiology, 2001, 130:257-270.
[35]Espea M, Sveier H, Høgøy I, et al. Nutrient absorption and growth of Atlantic salmon (Salmo salarL.)fed fish protein concentrate [J]. Aquaculture, 1999, 174, (1-2):119–137.
[36]Nanton D A. Lall S P. McNiven M A. Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock (Melanogrammus aeglefinusL.)[J].Aquaculture Research, 2001, 32: 225-234.
[37]Lyndon A R, Davidson I, Houlihan D F. Changes in tissue and plasma free amino acid concentrations after feeding in Atlantic cod [J]. Fish Physiology and Biochemistry, 1993, 10: 365-375.
[38]Carter C G, He Z Y, Houlihan D F, et al. Effect of feeding on tissue free amino acid concentrations in rainbow trout (Oncorhynchus mykissWalbaum)[J].Fish Physiology and Biochemistry, 1995, 14: 153–164.
[39]Kaushik S J, Luquet P. Influence of bacterial protein incorporation and of sulphur amino acid supplementation to such diets on growth of rainbow trout,Salmo gairderiiRichardson[J]. Aquaculture,1980, 19: 163-175.
[40]Ogata H, Arai S, Mas A B. Effect of dietary protein levels on free amino acid contents of juvenile European eelAnguilla anguilla[J]. Fish, 1985, 51: 573-578.
[41]Kaushik S J, Luquet P. Influnece of dietary amino acid patterns on the free amino acid contents of blood and muscle of rainbow trout (Salmo gairdneriiR.)[J].Comparative Biochemistry Physiology, 1979, 64 (1):175 – 180.
[42]Eleni M, Simeon D. White muscle free amino acid concentrations following feeding a maize gluten dietary protein in Atlantic salmon (Salmo salarL.)[J].Aquaculture, 2003, 225: 133-147.
[43]Bell J G, Tocher D R, MacDonald F M, et al. Effects of dietary borage oil [enriched in γ-linolenic acid, 18:3(n-6)]on growth, mortalities, liver histopathology, and lipid composition of Juvenile Turbot (Scophthalmus maximus)[J]. Fish Physiology Biochemistry, 1995, 14:373-383.
[44]Bell J G, Dick J R, Sargent J R. Effect of diets rich in linoleic or α-linolenic acid on phospholipid fatty acid composition and eicosanoid production in Atlantic Salmon (Salmo salar)[J]. Lipids, 1993, 28: 819-826.
[45]Torstensen B E, Froyland L, Lie O. Replacing dietary fish oil with increasing levels of rapeseed oil and olive oil-effects on Atlantic salmon (Salmo salarL.)tissue and lipoprotein lipid composition and lipogenic enzyme activities[J].Aquaculture Nutrition,2004, 10: 175-192.
[46]Bell J G, McEvoy J, Tocher D R, et al. Replacement of fish oil with rapeseed oil in diets of Atlantic salmon(Salmo salarL.)affects tissue lipid compositions and hepatocyte fatty acid metabolism [J].Nutrition, 2001,131: 1535-1543.
[47]Tocher D R, Bell J G, McGhee F, et al. Effects of dietary lipid level and vegetable oil on fatty acid metabolism in Atlantic salmon (Salmo salarL.)over the whole production cycle [J]. Fish Physiology and Biochemistry, 2003, 29: 193-209.
[48]Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish [J]. Fish, 2003, 11: 107-184.
[49]Sigurgisladottir S, Lall S P, Parrish C, et al. Cholestane as a digestibility marker in the absorption of polyunsaturated fatty acid ethylesters in Atlantic salmon[J].Lipids, 1992, 27: 418-424.
[50]Tocher D R, Bell J G. Hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition of liver in salmonids: effects of dietary vegetable oil[J].Comparative Biochemistry Physiology, 2001, 130:257-270.
[51]Leonard A E, Pereiraa S L, Sprecherb H, et al.Elongation of long-chain fatty acids[J]. Progress in Lipid Research, 2004, 43: 36-54.
[52]Carole B, Michel L, Pierre J. Fatty acid composition of wild and farmed Atlantic Salmo (Salmo salar)and Rainbow Trout (Oncorhynchus mykiss)[J].Lipid, 2005,40(5): 529-530.

