煤系高岭土制备Fe-MCM-41介孔分子筛及其氨选择性催化还原NOx
吴其胜,黎水平,陆国森,张长森
(1盐城工学院材料工程学院,江苏 盐城 224051; 2南京工业大学材料科学与工程学院,江苏 南京 210009)
氮氧化物(NOx)是氮与氧的多种化合物的总称,一般NOx由95%的NO和5%的NO2组成[1],是造成大气污染的主要物质。大气中NOx一方面在太阳光辐射下会形成光化学烟雾[2],对人体健康造成危害;另一方面NOx可形成酸雨,造成农作物大幅减产甚至腐蚀建筑物[3]。人类活动排放的NOx90%以上来自于固定源和移动源的燃烧[4],这其中固定源NOx排放主要由电厂燃煤燃烧造成。由于能源结构的关系,我国 67%的 NOx排放来源于煤的直接燃烧[5]。
目前使用最为成熟的催化剂是 V2O5/TiO2或者在 V2O5/TiO2基础上进行改性的催化剂,但此类催化剂只有在较高温度下才具有较高活性。另外,TiO2价格不菲且 V2O5/TiO2基催化剂大多为日本和欧美等发达国家所控制,目前国内已安装或正在建设的SCR脱硝装置大多引进国外技术,不利于我国NOx控制技术的发展。
自1992年Kresge等[5]首次在Nature杂志上报道合成新颖的介孔氧化硅材料M41S以来,介孔材料因具有比表面积大、孔道结构均一、可以给催化活性中心提供较大的负载空间、有利于分子进出等优点,迅速成为催化领域研究的热点。过渡金属离子掺杂进入介孔分子筛骨架,赋予MCM-41某些新的特性,如选择催化和离子交换性能[6]。Huang等[7]将Fe和Mn负载于介孔氧化硅(MPs)材料上制备出Mn-Fe/MPs催化剂,在20 000 h−1的空速和160 ℃下能达到99.1%的NO去除率,并且通过实验发现水汽的存在对催化剂的活性起促进作用。万颖等[8]研究发现,在水热条件下合成的Cu-Al-MCM-41分子筛对NOx的脱除具有很好的催化活性。
本文作者利用煤系高岭土、十六烷基三甲基溴化铵(CTAB)、硝酸铁等为原料,水热制备Fe-MCM-41催化剂,并研究了其在NH3-SCR脱硝中的催化活性。
1 实验部分
1.1 实验原料及试剂
煤系高岭土由徐州矿务集团提供,XRF测定其化学成分为:SiO2,39.24%;Al2O3,36.12%;CaO,0.39%;TiO2,0.65%;K2O,0.12%;Na2O,1.21%;MgO,0.18%;Fe2O3,0.89%;烧失量,20.78%。十六烷基三甲基溴化铵(CTAB)购自上海润捷化学试剂有限公司,硝酸铁购自上海四赫维化工有限公司,酒石酸购自上海艾博添加剂有限公司,固体氢氧化钠购自上海中试化工总公司,以上药品均为分析纯。
1.2 催化剂的制备
前体的制备按照本文作者课题组以前的报道进行[9-11]。将制备的前体(按二氧化硅记)和十六烷基三甲基溴化铵、氢氧化钠、去离子水、硝酸铁以及酒石酸按 1∶0.135∶0.2∶150∶x∶2x的摩尔比称量(x=0.02、0.05、0.08和0.1)后溶于去离子水中,搅拌,移入反应釜中于110 ℃水热反应24 h,搅拌速度为200 r/min,静置过夜,用去离子水洗涤至中性,过滤,110 ℃干燥10 h,550 ℃煅烧6 h去除模板剂,得到 Fe-MCM-41介孔材料。样品按Fe/Si的摩尔比不同,记为xFe-MCM-41。
1.3 催化剂的表征
红外光谱在美国 Nicolet公司生产的NEXUS670型傅里叶变换红外光谱仪(Fourier Transform Infrared Spectroscopy,FT-IR)上测定,波数范围为400~4000 cm−1,信噪比为33 400∶1,分辨率为0.1 cm−1,线性度为0.07%,检测目的为定性分析,测定条件为KBr压片法。用美国贝克曼库尔特公司生产的 SA3100型比表面积/孔径分布及孔隙分析仪来测定样品的孔分布及吸附脱附等温线,孔径范围为直径2~200 nm,样品300 ℃处理3 h。试样比表面积根据BET公式计算(Ps/P0=0.05~0.20),孔径分布根据BJH法计算。用日本JEOL公司生产的 JEM-2100型高分辨透射电子显微镜(high resolution transmission electron microscopy,HRTEM)观察试样的微观形貌和孔结构,加速电压为200 kV。
1.4 催化活性评价
NO、NH3、O2和N2分别通过质量流量计精确控制各气体的流量,各组分气体经充分混合后进入自制反应管。混合气在反应管中经预热,在催化剂上进行氮氧化物的催化还原反应。反应前后的气体浓度用崂应3012H型烟气分析仪进行定量分析,反应管置于电炉炉膛内,电炉智能控温仪可实现程序控温。
2 结果与讨论
2.1 FT-IR分析
MCM-41、xFe-MCM-41样品红外光谱图如图1所示。MCM-41介孔材料谱带中1080 cm−1波数表征Si—O—Si非对称伸缩振动,800 cm−1和460 cm−1波数分别表征Si—O对称伸缩振动和Si—O弯曲振动[12]。xFe-MCM-41表现出与MCM-41基本相同的红外光谱特征,只是由于Fe的摩尔量比Si大,使得Fe—O键的键长变长,折合质量变大,键力常数变小[13],使得xFe-MCM-41谱带在1080 cm−1波数出现红移,这种红移被认为是Fe进入MCM-41介孔材料骨架的证据。xFe-MCM-41在960 cm−1波数出现新的吸收谱带,这可能是Fe进入MCM-41骨架的又一证据[14],且随着Fe掺杂量增加,960 cm−1谱带附近的吸收峰越来越明显。

图1 xFe-MCM-41和MCM-41红外谱图
2.2 N2吸附分析
图2为不同Fe掺杂量的催化剂低温N2吸附脱附等温线和孔径分布曲线。由BET公式和BJH 法算得的比表面积、平均孔径和孔体积列于表1。由图2(a)可见,样品的吸附等温线属于 Langmuir IV型曲线,即典型的介孔材料吸附曲线,说明合成样品为介孔材料。样品 N2吸附过程分为 3个阶段[15-16]:在Ps/P0小于0.2的区域,N2吸附量随着相对压力的增高而逐渐增加,这是因为N2在分子筛的孔壁表面上进行单分子以及多分子吸附造成的;在Ps/P0为0.2~0.4范围时,N2吸附量陡然增加,在图中表现为突跃,这是因为分子筛的介孔结构导致氮气介孔中发生毛细凝聚现象,吸附量的急剧增加表明样品内存在介孔结构且孔径比较均匀;在Ps/P0大于0.4时,出现不太明显的H4型滞后环,这也进一步说明样品具有介孔结构。从图2(b)可以看出,样品孔径分布范围都较狭窄,表明分子筛的孔径分布均匀。由表1数据可以看出,样品平均孔径在3.45~3.97 nm,且随着Fe掺杂量的增加平均孔径也相应增加,但样品的比表面积和孔容积则随 Fe3+掺杂量的增加而减小。
2.3 HRTEM分析
图3为Fe-MCM-41催化剂的HRTEM图。由图可看到 Fe-MCM-41分子筛孔道分布均匀,具有六方排列的规则结构,所不同的是随着Fe掺入量增加,介孔结构的有序度逐渐降低。经计算样品孔径在3.8 nm左右,与低温N2吸附测试结果一致。
2.4 样品的催化活性
2.4.1 Fe掺杂量对催化剂活性的影响
图4为不同Fe掺杂量制备的Fe-MCM-41催化剂在不同温度下的SCR活性。从图4中可以看出,在200~350 ℃,Fe-MCM-41对NO的转化率随温度升高而增加;继续升高温度至 350 ℃以上,NO的转化率开始下降,这是由于在温度高于350 ℃时会发生NH3分解和氧化现象,导致参与反应的NH3量减少,从而NO转化率下降。

表1 xFe-MCM-41的部分结构特征

图2 样品的N2吸附脱附等温线和孔径分布曲线

图3 Fe-MCM-41催化剂HRTEM图
由图4还可看出,空白样的SCR活性较低,最高只有20.3%;掺杂Fe后,活性明显提高。当Fe掺杂量从0.02增加到0.05时,NO的转化率明显增加,最高转化率达90.7%,进一步增加Fe掺杂量至0.08时催化剂活性又下降。这主要是由于介孔材料骨架中阳离子位分布的规律性导致 Fe进入骨架中阳离子位时会受到一定的阻力,即阳离子实际交换量小于理论交换量。当Fe掺杂量从0.02增加到0.05时,由于进入介孔材料骨架中阳离子位的Fe增加,所以催化活性点增多。当Fe掺杂量达到0.08时,介孔材料中阳离子交换量已达饱和,多余的Fe会以氧化物的形式聚集在介孔材料的表面或孔道内,导致部分催化活性位被覆盖。
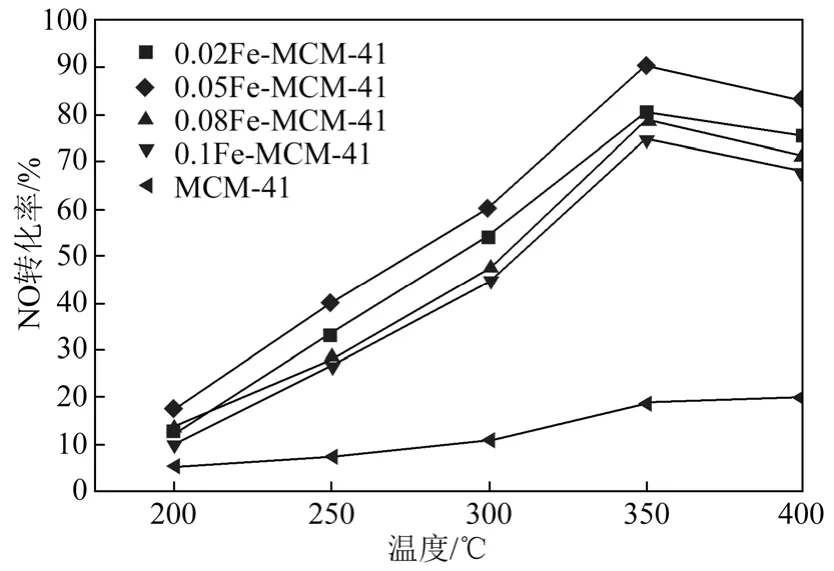
图4 Fe-MCM-41催化剂上的脱硝活性
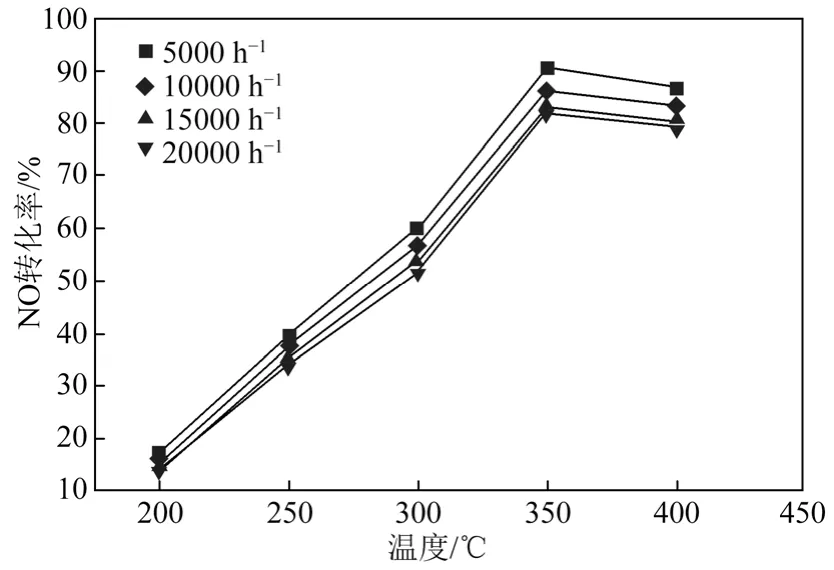
图5 0.05Fe-MCM-41催化剂不同空速下的脱硝活性
2.4.2 空速(GHSV)对催化剂活性的影响
空速是评价催化剂性能的一个重要指标,空速决定了反应气体在催化剂上的停留和反应时间,从而影响NO的转化率。图5为空速对0.05Fe-MCM-41催化活性的影响。当空速由5000 h−1增大到20 000 h−1时,脱硝效率不断下降,这是因为随着空速的增大,NH3与催化剂接触的时间变短,向催化剂内部扩散无法完成,从而导致反应效率下降。
2.4.3 氨氮比对催化活性的影响
氨氮比对 NH3-SCR反应有很大的影响,它不仅直接决定着催化剂性能,而且它影响副反应的发生。图6为氨氮比对0.05Fe-MCM-41催化剂活性的影响。由图6可知,当氨氮比小于1.1时,NO的转化率随氨氮比的增加而增加;当氨氮比达到1.1时,NO的转化率达最高;继续增加氨氮比,NO转化率反而下降。这是因为NH3投入量较低时(小于1.1),提高反应气中NH3的含量可以增加单位质量催化剂上 NH3的吸附量,加快SCR反应速率,在空速一定的情况下,表现为NO去除率的增加。但NH3投入量过高时,将使得烟气中未反应的NH3量增大,不仅造成了还原剂的浪费,还会引发NH3逃逸造成二次污染。特别是当反应温度较高时,NH3氧化等副反应的反应速率将增大,既降低了NO的脱除,又容易生成N2O等二次污染物。

图6 0.05Fe-MCM-41在不同氨氮比下的脱硝活性

图7 氧浓度对0.05Fe-MCM-41脱硝活性的影响
2.4.4 O2浓度对催化活性的影响
图7为O2浓度对0.05Fe-MCM-41催化剂活性的影响。由图7可见,在无氧的情况下,NO基本无转化。当通入少量O2后,NO的转化率显著升高,当O2浓度达2.5%时,催化剂活性达最佳并趋于稳定。根据Rideal-Eley机理模型[16],O2是以吸附在催化剂上的吸附态参加反应的,当O2分压增加时,催化剂上吸附的氧增多,能够在一定程度上氧化NO,有利于NO的转化,但当O2分压增加到一定值时,催化剂上的吸附态氧将达到饱和,从而影响趋于平稳。
3 结 论
以煤系高岭土、十六烷基三甲基溴化铵、硝酸铁等为原料,用水热法合成出不同 Fe掺杂量Fe-MCM-41介孔分子筛,并研究其 NH3选择性催化还原NO活性。结果表明样品具有规则介孔结构,且随着Fe掺杂量的增加,介孔分子筛的比表面积和孔体积减小,介孔有序性降低。Fe-MCM-41介孔分子筛对NH3选择性催化还原NO具有优良的催化活性,当n(Fe)/n(Si)为0.05、空速为5000 h−1、氨氮比为1.1、O2浓度为2.5%、反应温度为350 ℃时催化剂 0.05Fe-MCM-41对 NO的转化率最高,可达90.7%。
[1] Guido Busca,Luca Lietti,Gianguido Ramis,et al. Chemical and mechanistic aspects of the selective catalytic reduction of NOxby ammonia over oxide catalysis:A review [J].Applied Catalysis B:Environmental,1998,(18):1-36.
[2] Chen Zhihuang,Yang Qing,Li Hua,et al. Cr-MnOxmixed-oxide catalysts for selective catalytic reduction of NOxwith NH3at low temperature [J].Journal of Catalysis,2010,276:56-65.
[3] Pǎrvulescu V I,Grange P,Delmon B. Catalytic removal of NO [J].Catalysis Today,1998,46:223-316.
[4] Li Junhua,Chang Huazhen,Ma Lei,et al. Low-temperature selective catalytic reduction of NOxwith NH3over metal oxide and zeolite catalysis-A review [J].Catalysis Today,2011,175:147-156.
[5] Beck J S,Vartuli J C,Roth W J,et al. A new family of mesoporous molecular sieves prepared with liquid crystal templates [J].Journal of American Chemistry Society,1992,114(27):10834-10843.
[6] Qiao Kui,Zhang Fumin,Pan Duoli,et al. Synthesis,characterization and catalytic oxidation performance of high Ti-containing Ti-MCM-41 molecular sieves [J].Chinese Journal of Inorganic Chemistry,2008,24(5):748-755.
[7] Huang Jihui,Tong Zhiquan,Huang Yan,et al. Selective catalytic reduction of NO with NH3at low temperatures ouer iron and manganese oxides supported on mesoporous silica [J].Applied Catalysis B:Environmental,2008,78:309-314.
[8] 万颖,王正.Cu-Al-MCM-41催化剂选择性催化还原NOx[J].催化学报,2002,23(3):257- 261.
[9] Wu Qisheng,Li Shuiping. The effect of surfactant/silica and hydrothermal time on the specific surface area of mesoporous materials from coal-measure kaolin [J].Journal of Wuhan University of Technology(Materials Science Edition),2009,3:514- 518.
[10] Wu Qisheng,Li Shuiping. Synthesis of TiO2/Al-MCM-41 composites with coal-measure kaolin and performance in its photocatalysis [J].Materials Sciences and Applications,2011,2:14-19.
[11] 吴其胜,黎水平,苏沙沙. 煤系高岭土水热合成介孔材料[J]. 化工进展,2009,28(3):458-461.
[12] Takahashi R,Sato S,Sodesawa T,et al. High surface-area silica with controlled pore size prepared from nancomposite of silica and citric acid [J].Journal of Physical Chemistry B,2000,104:12184- 12191.
[13] Wu C,Kong Y,Gao F,et al. Synthesis characterization and catalytic performance for phenol hydroxylation of Fe-MCM-41 with high iron content [J].Microporous and Mesoporous Materials,2008,113:163-170.
[14] Gokulakrishnan N,Panduran A,Sinha P K. Catalytic wet peroxide oxidation technique for the removal of decontaminating agents ethlenediaminetetracetic acid and oxalic acid from aqueous solution using efficient fenton type Fe-MCM-41 mesoporous materials [J].Industrial & Engineering Chemistry Research,2009,48:1556-1561.
[15] Qu F,Zhu G,Huang S,et al. Effective controlled release of captopril by silylation of mesoporous MCM-41 [J].Chemphyschem,2006,7(2):400-406.
[16] 闰志勇,高翔,岑可法,等.NH3选择性催化还原烟气中NO的反应动力学[J].动力工程,2007,27(4):601- 606.

