浅析弱酸弱碱盐水解的程度和结果
盛 荣
(扬州市江都区育才中学 江苏 扬州 225200)
弱酸弱碱盐中阴、阳离子的水解反应可以相互促进,其中某些盐的水解反应可以完全进行生成相应的难溶或易挥发的弱酸和弱碱,这样的过程也就是通常所说的双水解[1]。对于双水解反应的定义教科书中并未明确给出,多数参考书中强调能完全进行的才可称为双水解,如按此定义,就需要先确定水解程度的大小,而这通常是根据有无该盐的溶液存在加以判断,将Al3+与HCO3-之类混合后即可发生剧烈反应的离子归入双水解反应是毫无异议的,但对于在水溶液中不能表现出明显现象的离子间的水解情况则是众说不一,学生经常对(NH4)2CO3之类熟悉的弱酸弱碱盐究竟有无发生双水解感到困惑。此疑问其实是将水解进行的程度和水解后的结果等同看待造成的,以下对几种弱酸弱碱盐的水解做近似计算以分析其区别。
一、醋酸铵的水解
1.CH3COONH4的水解常数Kh

由以上数据可见,醋酸铵的水解常数Kh不大,其水解趋势很弱,但仍然比CH3COO-和NH4+的水解常数大5个数量级(NH4++H2O⇌NH3·H2O+H+的 Kh= KW·Kb-1=5.65×10-10、CH3COO-+H2O⇌CH3COOH + OH-的 Kh=KW·Ka-1= 5.68×10-10), 说明 CH3COO-和 NH4+的水解相互促进[2]。
2.CH3COONH4的水解程度和结果
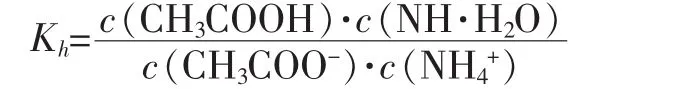
因为Kb与Ka相近,所以
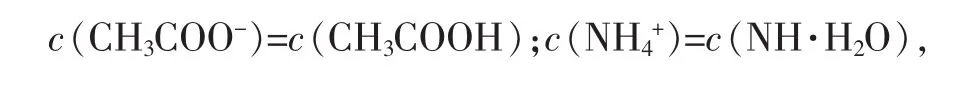
可得醋酸铵的水解度:

如此小的水解度对其溶液存在有何影响呢?以其饱和溶液计算:醋酸铵在水中的溶解度为148g(4℃),水解后 100g 水中约含 NH3·H2O、CH3COOH 各 0.011 mol,而常用浓氨水浓度为14.8 mol∕L,醋酸更是可与水互溶,不会有大量NH3、CH3COOH从溶液中逸出;而稀溶液中NH3·H2O、CH3COOH浓度更小,更不易逸出。因此醋酸铵水溶液可较稳定存在,溶质仍主要保持NH4+和CH3COO-形式。
二、Al3+与 HCO3-的水解
1.水解程度
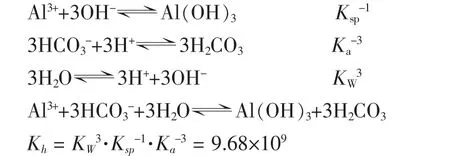
因Kh很大,该反应可较彻底进行。由多次方程直接求解h不易,以下反向验算水解结果。设a mol的Al3+与3amol的HCO3-在1L溶液中充分反应,由于有CO2逸出,反应后得H2CO3(CO2)的饱和溶液,25℃时其总浓度约为0.04 mol∕L,再设生成 Al(OH)3为 x mol∕L,则有:
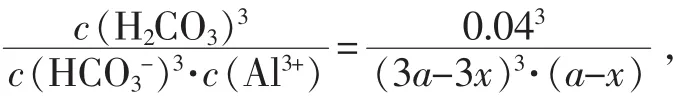
2.机理讨论
有文章对Al3+与HCO3-溶液混合时的反应机理做了分析,意图辨别双水解反应是按下列哪条途径进行:①先由 H2O 电离为 H+和 OH-, 再分别由 Al3+和 OH-、HCO3-和H+结合促进水电离而使反应完全;②先由Al3+和HCO3-分别水解生成 H+和 OH-, 再由 H+和 OH-结合而促进反应完全[3]。笔者以为仅从这几个反应的平衡常数判断反应的机理并不适当,因为平衡常数是热力学中用以说明反应程度的物理量;而反应机理的研究则是动力学领域,需要分析反应级数、中间产物、基元反应等内容,仅由平衡常数不足以得出结论。实际上溶液中离子间的结合一般为快速反应,不同的反应机理难以在直接可见的现象上反映出来;而从热力学角度分析上述三式的加和与 Al3++3H2O⇌Al (OH)3+3H+、3HCO3-+3H2O⇌3H2CO3+3OH-、3H++3OH-⇌3H2O三式的加和是等价的,这些方程式只表示始、终态之间物质的转变,不能表示反应机理。笔者以为中学阶段认识到H+和OH-、Al3+和OH-、HCO3-和 H+相互结合而促进反应完全即可[4],无需也无法辨明微观反应机理。
三、NH4HCO3的水解
NH4++HCO3-+H2O⇌NH3·H2O+H2CO3的 Kh=1.31×10-3,h = 3.5%
(HCO3-的水解常数比 NH4+大 40 倍左右, 即 HCO3-的水解程度更大一些,不过它们均比双水解反应的Kh小得多,本文忽略此区别做近似计算,下同。)
15℃时 NH4HCO3饱和溶液浓度约为 2.17 mol∕L,水解后 H2CO3(CO2)浓度为 0.076mol∕L,与其饱和溶液浓度接近,稳定性很差,可有CO2逸出(NH3溶解度大于CO2,但因有刺激性气味更易被感知)而使溶液组成改变,此结果与NH4HCO3饱和溶液在15℃以上液相与固相组成不一的资料记载相符[5]。如温度升高,气体溶解度减小而逸出,NH4HCO3也就发生了分解。
四、(NH4)2CO3的水解
NH4++CO32-+H2O⇌NH3·H2O+HCO3-的 Kh= 10.1,设(NH4)2CO3浓度为 a mol∕L,水解后溶液中 NH3·H2O浓度为x mol∕L,则有:

再进行二次水解:NH4++HCO3-+H2O⇌NH3·H2O+H2CO3,设水解后溶液中 H2CO3(CO2)浓度为 y mol∕L,则有:

五、结论
1.由于弱酸根离子与弱碱阳离子水解的相互促进,弱酸弱碱盐的水解程度大幅增加。
2.不同弱酸弱碱盐的水解程度大小不一。一般来讲Al3+、Fe3+等的弱酸盐由于对应氢氧化物Ksp极小而近于完全水解,碳酸盐、硫化物等也由于 HCO3-、HS-的 Ka很小而水解程度较高。(由于Kh的确定需要具体数据,h大于多少才认为是反应完全也无明确标准,笔者更倾向将弱酸阴离子和弱碱阳离子之间相互促进的水解都称为双水解,而不一定强调反应完全。)
3.水解结果(水解后是否有该盐的溶液存在)由水解程度大小和水解产物有无脱离溶液两方面共同决定。一般来说有Ksp极小的沉淀生成的弱酸弱碱盐不能存在于水溶液中(如硫化铝、碳酸铁、硅酸铵等);但如果水解产物未脱离溶液,即使水解程度较高也还是有溶液存在(如碳酸铵、硫化铵等),但构成固体的离子不能在溶液中大量存在,即溶液中的溶质不同于固体组成;对于碳酸氢铵、碳酸氢镁之类水解程度不太高但产物易脱离溶液的则要依据具体的温度、浓度分别判断。
[1] 陆军.关于双水解反应的研究性学习报告——基于《化学反应原理》模块的知识[J].中学化学教学参考,2010,(3):29-30
[2] 北京师范大学无机化学教研室等.无机化学 (上册)[M].第三版.北京:高等教育出版社,1992:99-107
[3] 张德山,蒋盛邦.对碳酸钠和氯化铝在溶液中反应是“双水解”的商榷[J].化学教育,1989,(2):46-48
[4] 陆燕海,林肃浩.给泡沫灭火器加注几则教学参考[J].化学教学,2010,(9):74-76
[5] 刘芳,王淑娟,张曦等.碳酸氢铵溶液解吸二氧化碳研究[J].环境科学学报,2009,29 (9):1886-1890
——饱和溶液与不饱和溶液

