回归·整合·拓展——例谈高三复习中关于教材使用的思考
马娟娟
(江苏省宜兴市第一中学 江苏 宜兴 214206)
教材是教学、复习、备考的依托。 在新课程背景下,高三化学复习对教材的使用应持怎样的策略才能将教材的作用发挥到极致? 下面以“工业生产中除杂质铁”为例,结合教材内容、习题以及高考试题加以阐释。
一、回归教材 明确目标
苏教版第一次提及处理废水中的Fe2+是在《化学1》(2009 年6 月版)76 页。 只有如下简单文字:“为除去废水中的Fe2+,常先将废水中的Fe2+氧化成Fe3+,再调节溶液的pH 使Fe3+转化为红褐色的Fe(OH)3沉淀析出。 ”
对以上教学内容,该向学生提出怎样的学习要求?
例1.(苏教版教材86 页第9 题)化学实验室产生的废液中含有大量会污染环境的物质, 为了保护环境,化学实验室产生的废液必须经处理后才能排放。 某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了下列方案对废液进行处理, 以回收金属,保护环境。
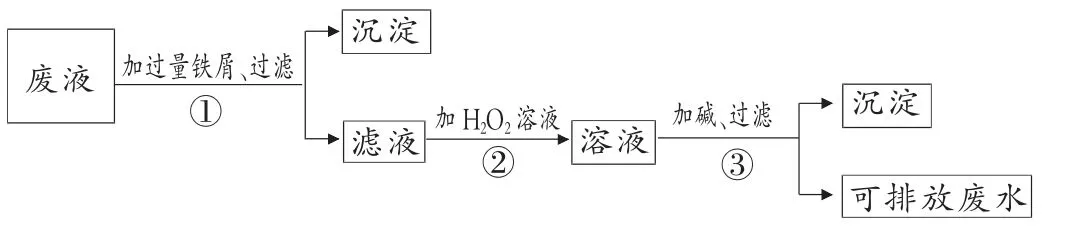
(1)废液经操作①得到的沉淀中含有的金属单质是__________。
(2)在操作②中观察到的实验现象是_______。
(3)操作③中发生反应的离子方程式为_______。试题简评:试题以书本中铁的知识为载体,考查了废水中除去Fe2+的原理和不活泼金属的制取原理以及氧化还原反应的知识。 较好地体现了课标和教材在《化学1》对该部分内容的双基要求,给学生明确了学习目标。
答案:(1)Fe、Cu、Ag (2)溶液由浅绿色变为棕黄色(3)Fe3++3OH-=Fe(OH)3↓
后来在《化学反应原理》(2009 年7 月版)92 页,较详细地叙述了除杂的过程:“在无机化合物的制备和提纯、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。 例如,除去硫酸铜溶液中混有的少量铁离子, 可向溶液中加入氢氧化铜或碱式碳酸铜,调节溶液的pH 至3~4, 铁离子就会全部转化为氢氧化铁沉淀除去。 ”
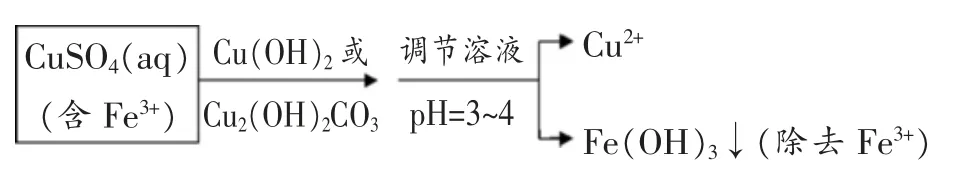
虽然氢氧化铜也难溶于水,但氢氧化铁的溶解度比氢氧化铜小得多,当溶液的pH 超过5 时,铜离子才开始转化为氢氧化铜沉淀。 因此,我们可以通过控制溶液的pH,达到除去铁离子而让铜离子保留在溶液中的目的。
教学思考:教材编写的依据是课程标准,必修与选修的教材对内容要求的深度和广度都不同,必修教材只是让学生明白这一除杂的方法,而选修教材中则通过KSP对pH 的具体计算提出了要求, 符合学生的认知特点和循序渐进的原则。 教学中教师要重视教材,回归教材,并依据课程标准给学生提出明确的学习目标,将双基落到实处。
二、整合教材 归纳提高
重视教材,绝不是把课本当“圣经”,教学时不必拘泥于教材,要善于进行归纳总结,将教材进行整合,创造性地使用教材,这就是本次课改提倡的“不是教教材,而是用教材教”的真正意图。
例2 (南京市2012-2013 学年高三年级学情调研卷
改编) 从生产印刷电路板(生产原理:2FeCl3+Cu=2FeCl2+CuCl2)的废液中提取CuCl2·2H2O 晶体。 实验流程如下:
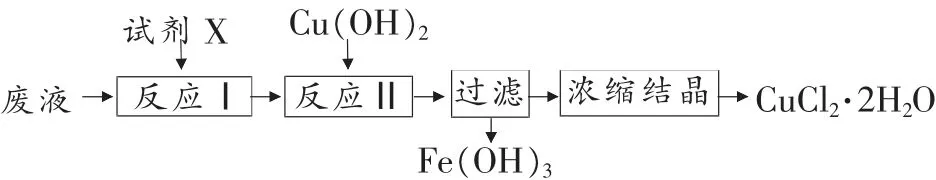
室温下,相关物质的溶度积常数如下表:

?
(1) 上述流程中试剂X 可以选用_______(填化学式)。 反应Ⅱ调节溶液的pH 为4.0, 此时溶液中的c(Fe3+)=_______。
(2)如何证明反应Ⅱ中沉淀已完全?_______。
(3)沉淀过滤后,用蒸馏水洗涤,检验沉淀是否洗涤干净的方法_______。
(4)“浓缩结晶”须在低温下进行,其原因是_______。
试题简评:试题仍以书本中铁的知识为载体,不仅考查了废水中除去Fe2+、Fe3+的原理和氧化还原反应的知识,同时考查了KSP计算和沉淀洗涤、结晶、Fe3+的检验等实验的相关知识。
答案:(1)Cl2或H2O24.0×10-8mol·L-1(2)静置,取上层清液少量于试管中,滴加KSCN 溶液,若没有出现血红色,说明沉淀已完全。 (3)取最后一次洗涤液少许于试管中,滴入硝酸酸化的硝酸银溶液,若无白色沉淀生成,则沉淀洗涤干净。 (4)抑制CuCl2水解
教学思考:虽然在《化学1》和《化学反应原理》有关“工业生产中除杂质铁”中,并未涉及Fe3+的检验、沉淀洗涤、结晶等实验知识,但是这些都是《化学1》中重要的知识点。 因此,教学时不能局限于教材,要通过归纳总结,不断地对教材进行加工和重新组合,提升学生运用知识解决问题的能力。
三、拓展教材 凸显能力
教师充分利用教材提供的资源,挖掘教材蕴含的培养学生思维、能力等方面的因素,对教材的内容进行拓展、延伸。 显然,这样不是“照搬教材”,而是“活用教材”。 很多时候,在一些典型素材上,只要再挖掘得深一点、联系得广一些,教材的价值就更丰富。 真是“材不在多,用透则灵。 ”
例3.(2010 年福建卷24 题)硫酸锌可作为食品锌强化剂的原料。 工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3, 并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
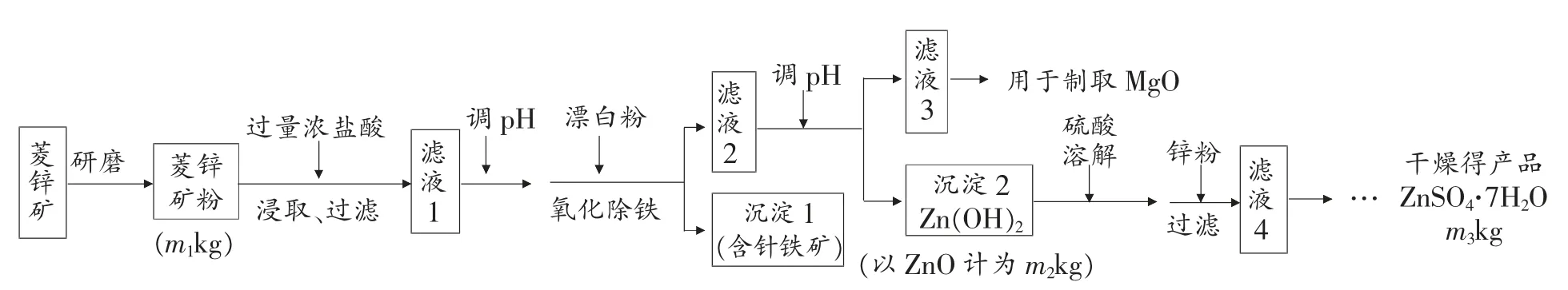
(1)将菱锌矿研磨成粉的目的是______________。
(2)完成“氧化除铁”步骤中反应的离子方程式:

(3) 针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O 和H,化学式量为89,化学式是_______。
(4) 根据下表数据,调节“滤液2”的pH 时,理论上可选用的最大区间为_______。
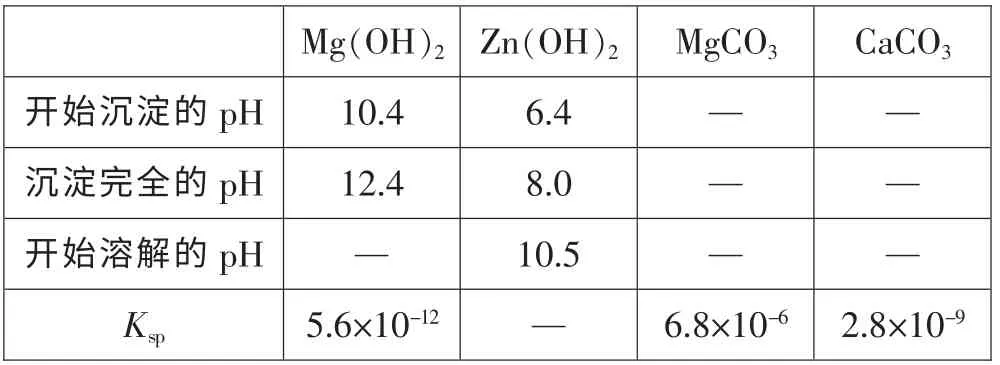
?
(5) 工业上从“滤液3”制取MgO 过程中,合适的反应物是_________(选填序号)。
a. 大理石粉 b. 石灰乳 c. 纯碱溶液 d. 烧碱溶液
(6) “滤液4”之后的操作依次为_________、_________________________、过滤,洗涤,干燥。
(7) 分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于_________________________。
试题简评:试题在传统“工业生产除杂质铁”的基础上,超越了教材的信息,考查了镁、钙等杂质的处理,同时考查了锌离子沉淀的pH 的选择范围。 乍一看是觉得无从入手,细细品味后却似曾相识。
答案:(1) 增大反应物接触面积或增大反应速率或使反应更充分;(2)22 Fe(OH)2+11ClO-+11H2O=22 Fe (OH)3+11Cl-;(3)FeO(OH);(4)8.0<pH<10.4;(5)b 或d;(6)蒸发浓缩 冷却结晶;(7)125m2/81m1
教学思考:在新课程背景下,能力考查成为高考的重点,高考化学试题依据课程标准,遵循考试说明,超越了教材素材。 “拓展教材”不是增加教材的知识点,增加学生学习的难度,而是通过分析、类比的方法,找出拓展知识与教材知识之间的联系与区别,实现知识的迁移运用,从而凸显学生的能力。
综上所述,教材不是教师教和学生学的“枷锁”,而是“跳板”。教师在高三复习过程中,不能脱离教材,要依据课程标准的理念,认真解读教材,把握教材内涵,回归教材,对教材有效地重新整合与适度地拓展延伸。
[1] 祁学俊,朱怀义.尊重与丰富 拓展与超越——例谈高三复习中对教材的应用[J].中学化学教学参考,2010,(1~2):55-57
[2] 王祖浩.普通高中课程标准实验教科书·化学1[M].南京:江苏教育出版社,2009:76,86
[3] 王祖浩. 普通高中课程标准实验教科书·化学反应原理[M].南京:江苏教育出版社,2009:92
——依托《课程标准》的二轮复习策略

