疗效评价中酶联免疫吸附试验数据处理的方法学研究*
金树根 孙学华 雷 燕 李 曼 高月求,3△
1.上海中医药大学附属曙光医院细胞免疫实验室 (上海,201203) 2.上海市中医临床重点实验室 3.上海中医药大学附属曙光医院肝病科
一直以来,国内在药物体外抗病毒疗效评价中,因价格相对便宜,病毒抗原蛋白含量检测很多是采用ELISA检测,虽不少研究采用人工合成的病毒抗原蛋白作为标准品做梯度稀释并曲线拟合进行病毒抗原蛋白定量[1,2],更多实验中病毒抗原蛋白定量是简单直接采用OD值表示,认为药物对病毒抑制率 (%)=(空白对照组平均OD值-药物干预组平均OD值)/空白对照组平均 OD值 ×100%,半数抑制浓度(50%concentration of inhibition,IC50,又称半数有效浓度EC50)即为空白对照组平均OD值一半时的药物浓度[3~5]。然而,在我们实验时发现,与基于CL、TRIF检测技术可出阳性结果并求出IC50不同,基于ELISA检测技术的科华ELISA试剂检测HBsAg和HBeAg时,同一药物同一浓度采用目前计算方法却没有阳性结果,无法求出 IC50。鉴此,我们对基于ELISA检测技术所得数据进行IC50计算的方法学进行研究,以便为病毒疗效评价提供准确信息。
1 材料与方法
1.1 一般材料 ①仪器:全波长酶标仪 (SpectraMax M5e,Molecular Devices;Powerwave XS Universal MQX200R,Biotek),滤光片检测技术的酶标仪 (Multiskan Ex,Fortune-labsystems;KHB ST-360,上海科华公司,简称科华),全自动化学发光仪(I2000,美国ABBOTT公司,简称ABBOTT)、时间分辨荧光分析仪 (Efficuta型,新波生物技术有限公司,简称新波生物)。②试剂:HBsAg和HBeAg ELISA试剂盒 (科华),HB-sAg和HBeAg CL诊断试剂盒 (ABBOTT),HBsAg和HBeAg TRIF分析试剂盒 (新波生物)。③样品:HepG2和HepG2.2.15细胞株培养上清液 (本院细胞免疫实验室提供)。
1.2 样本预处理 将收集保存好的HepG2和HepG2.2.15细胞株培养上清液解冻,用HepG2细胞株培养上清液对HepG2.2.15细胞株培养上清液进行2、4、8、16、32、64、128倍稀释,以备检测用。
1.3 样品检测 ①ELISA:将HepG2.2.15细胞株培养上清液原液和2、4、8、16、32、64、128倍稀释液作为标准液,以HepG2细胞株培养上清液为阴性实验对照,按说明书进行操作,采用450/630nm双波长进行检测,OD=OD450-OD630。②CL分析:按说明书,由曙光医院检测中心完成。③TRIF分析:按说明书,由曙光医院检测中心完成。
1.4 统计学方法 采用CurveExpert软件分析对ELISA检测数据进行曲线拟合并计算待测样品的相对浓度。
2 结果
2.1 HepG2.2.15细胞株培养上清液不同稀释倍数HBeAg ELISA检测OD值变化 见表1。发现原倍对半稀释 (真正IC50浓度)时OD值与原倍血清OD值不是对半的关系,有时相当接近。
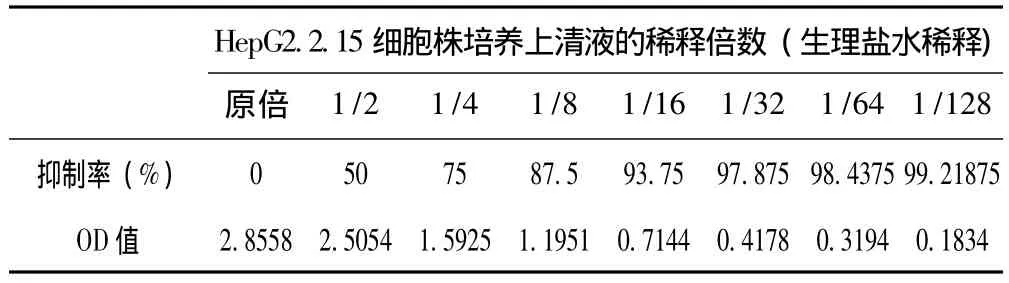
表1 HepG2.2.15细胞株培养上清液不同稀释倍数HBeAg ELISA检测OD值变化
2.2 HepG2.2.15细胞株培养上清液HBeAg ELISA检测OD值与样品浓度关系 见图1。
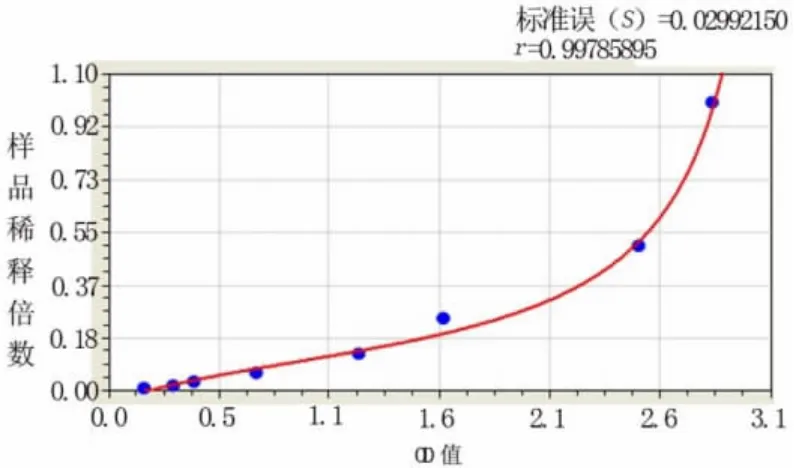
图1 HepG2.2.15细胞株培养上清液不同稀释倍数HBeAg ELISA检测OD值变化曲线
由图1可见HBeAg浓度 (y轴)与OD值 (x轴)非直线相关,呈类似抛物线型曲线关系。采用相关系数 (r)最接近1的标准曲线拟合进行未知样品检测结果换算。
2.3 不同批次试剂、不同批次实验的HBeAg ELISA检测OD值变化 结果见表2、图2(A、B)以及表3、图3(A、B)。其结果显示,不同批次试剂、不同批次实验的HBeAg ELISA检测OD值均各不相同,其OD值与样品浓度关系呈类似抛物线型或S型等曲线关系。
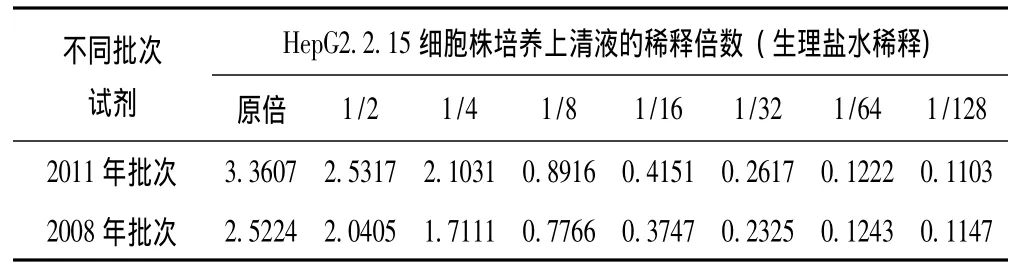
表2 不同批次试剂HBeAg ELISA检测OD值变化
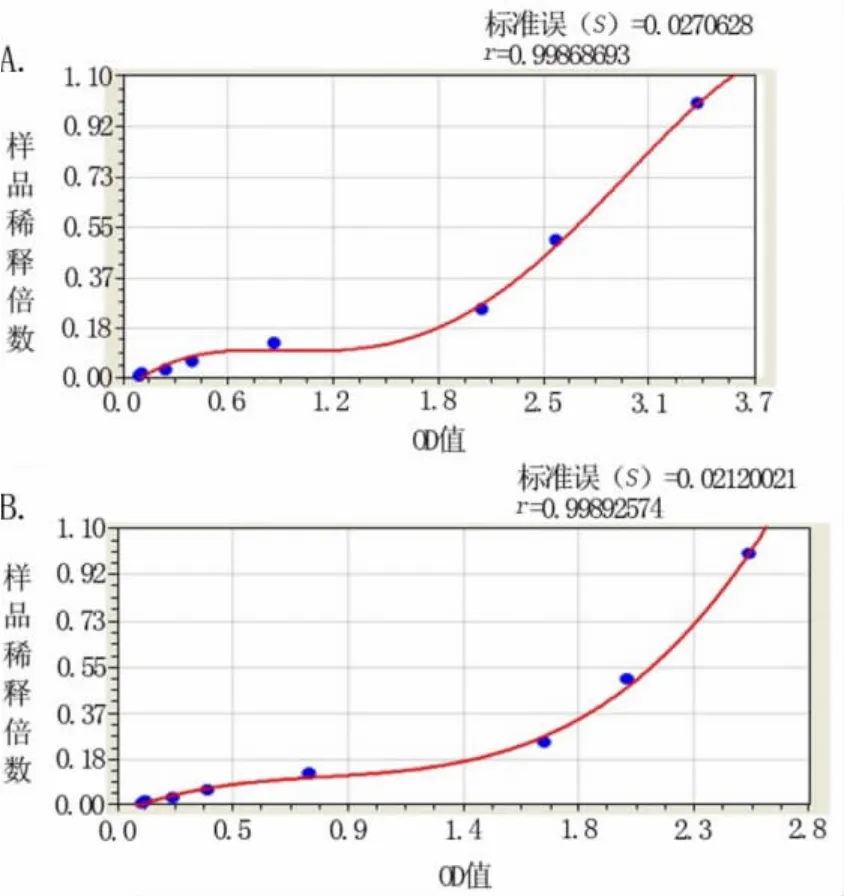
图2 不同批次试剂HBeAg ELISA检测OD值变化曲线(其中A为2011年批次试剂,B为2008年批次试剂)
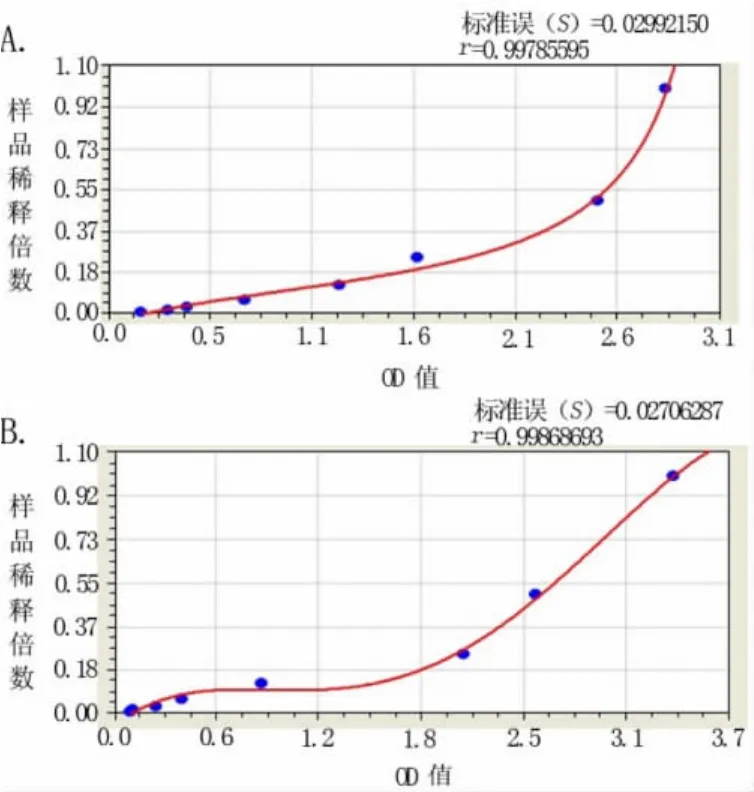
图3 同批次试剂不同批次实验HBeAg ELISA检测OD值变化曲线(其中A为20110325批次实验,B为20110331批次实验)
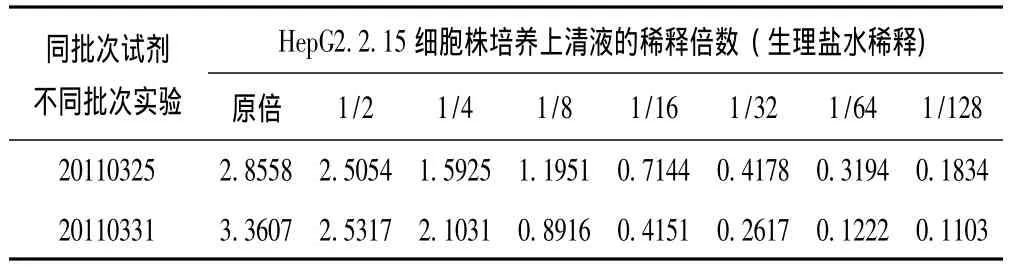
表3 同批次试剂不同批次实验HBeAg ELISA检测OD值变化
2.4 不同酶标仪对HBsAg ELISA检测OD值变化的影响 见表4、图4(A~C)。因原实验室SpectraMax M5e酶标仪仪器故障,我们改用另外一台Fortune-labsystems酶标仪进行检测,发现新鲜与冷藏样品倍半稀释,发现最高浓度样品OD值偏低近1,而且样品浓度与OD值呈S线型关系。我们进而采用单位内3台不同酶标仪进行比较研究,发现只有采用 Biotek酶标仪检测结果与SpectraMax M5e酶标仪检测结果相当,而Fortune-labsystem酶标仪与科华酶标仪结果类似,高浓度样品OD值偏低近1,而且样品浓度与OD值呈S线型关系。

表4 不同酶标仪对HBsAg ELISA检测OD值变化的影响
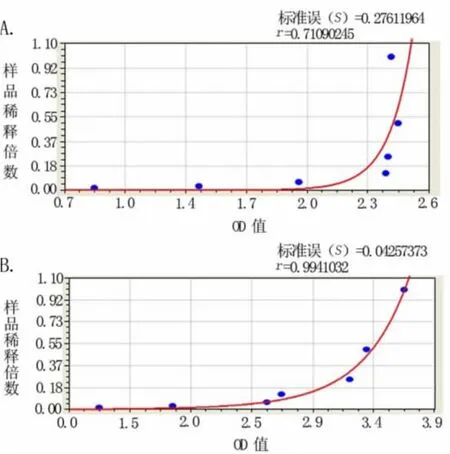
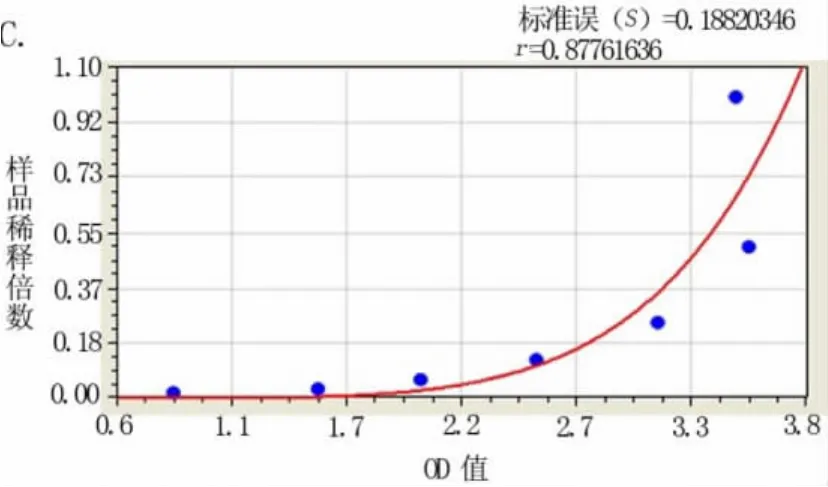
图4 不同酶标仪对HBsAg ELISA检测OD值变化曲线(其中A为Fortune-labsystems酶标仪,B为Biotek酶标仪,C为科华酶标仪)
2.5 检测样品保存条件对HBeAg ELISA检测的影响 见表5。
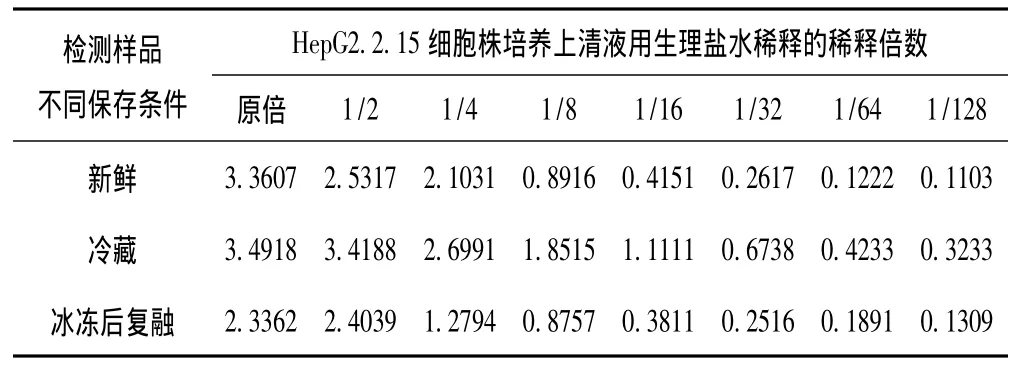
表5 检测样品不同保存条件对HBeAg ELISA检测OD值变化的影响
与新鲜样品相比较,检测样品冷藏对ELISA检测结果影响不大,样品浓度与OD值仍呈类似抛物线型关系,但检测样品冰冻后复融对ELISA检测结果影响大,表现在实验中有时为1/2稀释样品的OD值反而比原倍样品的OD值还高,样品浓度与OD值仍呈类似S线型关系,特别是人的混合血清生理盐水稀释后检测此现象多见 (数据从略)。
2.6 3种检测方法检测HBsAg和HBeAg含量的比较 见表6。CL、TRIF检测结果有良好线性关系,但ELISA检测进行曲线拟合后,结果与CL、TRIF检测结果相一致。
2.7 不同稀释液对HBsAg和HBeAg ELISA检测的影响 见表7。虽然不同稀释液对HBsAg和HBeAg ELISA检测OD值有影响,但进行曲线拟合后,其结果是相一致的。
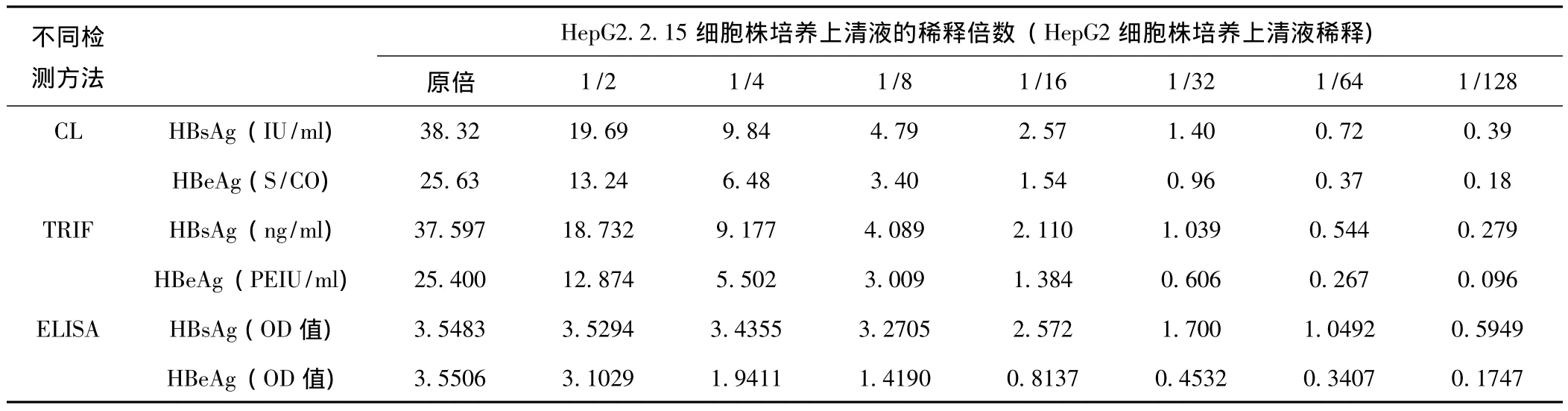
表6 HepG2.2.15细胞株培养上清液不同稀释倍数HBsAg和HBeAg ELISA检测与CL、TRIF检测比较
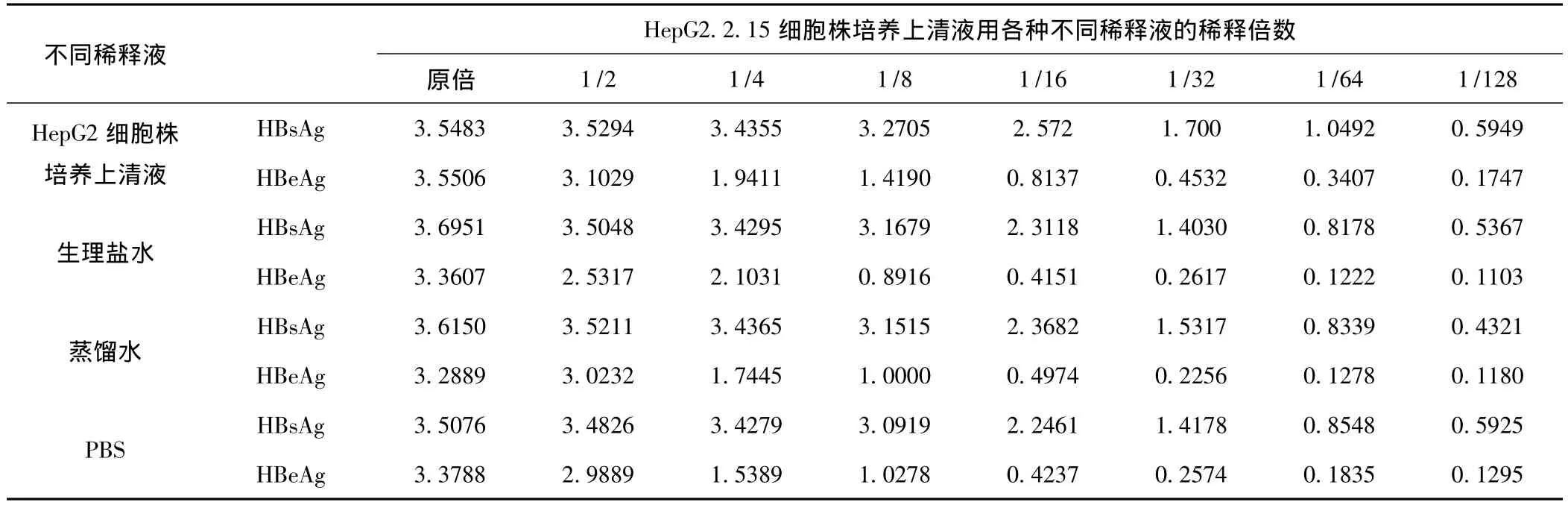
表7 不同稀释液对HBsAg和HBeAg ELISA检测OD值变化的影响
3 讨论
大量临床报道,苦参素有良好的抗HBV作用,然而体外细胞实验中,我们前期研究采用ELISA检测HBsAg和HBeAg进行苦参生物碱抗HBV作用研究发现,苦参素虽有一定的抗HBV作用,但因半数有效浓度 (IC50/EC50)高于或接近半数毒性浓度(TC50),而无法求出SI(选择指数)/TI(治疗指数),似与临床结果不一致[5]。最近我们采用ELISA检测HBsAg和HBeAg进行白桦酯酸抗HBV作用研究,发现其结果与他人和我们以往研究结果相出入[6],IC50和SI/TI均无法求出。同时,我们将样品采用ABBOTT等试剂进行检测发现,其结果表明白桦酯酸抑制HBeAg分泌的IC50与相关文献相一致,SI/TI>2。鉴此,为了对病毒疗效评价提供准确信息,我们对基于ELISA检测技术所得数据进行方法学研究。
将HepG2.2.15细胞株培养上清液进行梯度稀释,采用ELISA进行HBsAg和HBeAg检测,我们惊异地发现,对半稀释的样品 (1/2稀释液,相当于50%病毒抑制率,即IC50)其OD值与没有稀释的样品 (原液)OD值极为接近。而有时OD值是原液OD值一半时的稀释倍数已达3倍以上 (即病毒抑制率75%以上),有的竟高达50倍 (即病毒抑制率98%),说明以前采用病毒抑制率 (%)=(空白对照组平均OD值-药物干预组平均OD值)/空白对照组平均OD值×100%这一作法完全低估了抗病毒药物的作用。究其原因,可能是国内研究人员误将适用于线性相关的放免法检测所得结果的此一计算方法移植于ELISA检测所得结果的计算中[4,7]。
除样品冰冻后复融实验结果病毒浓度与OD值拟合曲线均呈S型外,不同批次试剂、同批次试剂不同批次实验和其他不同样品前处理的HBeAg ELISA检测OD值均虽各不相同,病毒浓度与OD值拟合曲线虽均仍呈类似抛物线型,但ELISA检测进行曲线拟合后,结果与化学发光免疫、时间分辨荧光免疫检测结果相一致。不同稀释液对HBsAg ELISA检测具体OD数值有影响,但不影响曲线拟合类似抛物线型。因此,建议在今后采用ELISA检测技术所得数据进行IC50计算的抗病毒药物作用的疗效评价中,采用含病毒样品梯度稀释制作标准曲线并进行曲线拟合,以便能正确计算IC50和SI/TI,为抗病毒疗效评价提供准确信息。尽量不采用冰冻保存样品的方法,或冰冻保存样品采用合适稀释,以便制作正确的标准曲线和正确检测样品中待检物质。
应用不同的酶标仪,结果发现对HBsAg ELISA检测采用滤光片检测技术的酶标仪不仅OD值偏低,而且因最高浓度样品OD值反低于其样品倍半稀释的OD值,致样品浓度与OD值呈S线型关系,而全波长酶标仪其OD值与病毒浓(滴)度呈抛物线关系。因此我们认为如果采用滤光片检测技术的酶标仪,建议对所有样品进行适当稀释,以便制作正确的标准曲线和正确检测样品中待检物质。
[1] ZHAO G,YIN Z,DONG J.Antiviral efficacy against hepatitis B virus replication of oleuropein isolated from Jasminum officinale L.var.grandiflorum [J].J Ethnopharmacol,2009,125(2):265 -268.
[2] ZHOU Z,ZHANG Y,DING XR,et al.Protocatechuic aldehyde inhibits hepatitis B virus replication both in vitro and in vivo[J] .Antiviral Res,2007,74(1):59-64.
[3]李常青,李小月,张俊丽,等.叶下珠复方Ⅱ号抗乙型肝炎病毒的体外实验研究[J].中国热带医学,2009,9(2):217-218.
[4]任健,张倩落,郑莉.转阴灵抗乙型肝炎病毒的体外实验研究[J].西北药学杂志,2008,23(3):154-156.
[5]聂红明,陈建杰,高月求,等.苦参碱与氧化苦参碱体外抗乙肝病毒的比较[J].世界华人消化杂志,2008,16(36):4046-4050.
[6] YAO D,LI H,GOU Y,et al.Betulinic acid-mediated inhibitory effect on hepatitis B virus by suppression of manganese superoxide dismutase expression[J] .FEBS J,2009,276(9):2599 -2614.
[7]范涛,傅希贤,张国庆,等.中草药抗乙型肝炎病毒活性及其作用机理体外实验研究[J].中华实验和临床病毒学杂志,1996,10(1):27-30.

