正常胰腺在3.0TMR不同DWI序列上的ADC值评价
姚秀忠,许红莲,顾君英,饶圣祥,孙非,王鹤,曾蒙苏
磁共振扩散加权成像(diffusion weighted imaging,DWI)被广泛用于上腹部,为突出上腹部病灶的对比度,通常要结合一定的脂肪抑制技术如频率选择或反转恢复,而并行采集技术的应用可以进一步抑制由于高速梯度切换所带来的图像扭曲伪影[1]和缩短扫描时间。为提高DWI的稳定性及其对肝内病灶定量及定性的诊断率,除常规应用的憋气DWI外,呼吸门控DWI、呼吸门控背景抑制DWI、自由呼吸背景抑制DWI都在探索性研究中[2-3]。3.0T 主磁场强度理论上使其图像信噪比比1.5T提升2倍[4],从而成为高空间分辨力及缩短腹部成像时间的基石。尽管有研究者在3.0TMR上进行胰腺癌的DWI研究,但是对于各种DWI序列在正常胰腺中的ADC值的评价比较尚无报道。
材料与方法
1.研究对象
将2011年01月-2011年12月30例年龄35~70岁的正常志愿者(男16例,女14例,平均55.7岁)纳入本次研究。受检者行MRI检查前禁饮食6h,取仰卧位,呼吸幅度及频率保持均匀,憋气方式采用呼气末憋气。
2.扫描方法及参数
应用3.0TMR扫描仪 (Signa HDx),8通道相控阵表面线圈。DWI扫描方法:所有DWI序列均基于SE-EPI序列成像,成像序列包括三方向扩散梯度憋气DWI(breath-hold DWI with MPG pulses in X、Y、Z direction,BH600ALL)、单方向扩散梯度憋气DWI(breath-hold DWI with MPG pulses in Z direction,BH600SI)、呼 吸 门 控 DWI (respiratory-triggered DWI with MPG pulses in X、Y、Z direction,TRIG600ALL)、呼吸门控反转恢复脂肪抑制DWI(respiratory-triggered DWI with MPG pulses in X、Y、Z direction and inversion recovery for fat saturation,TRIG600ALL+BS)和自由呼吸反转恢复脂肪抑制DWI(free-breathing DWI with MPG pulses in X、Y、Z direction and inversion recovery for fat saturation,FB600ALL+BS),层厚5mm,层距2mm,带宽250KHz,FOV 400mm×280mm,矩阵130×96,背景抑制采用反转恢复(inversion recovery,IR),反转时间(inversion time,TI)为220ms(本研究曾应用频率饱和作为背景抑制的方法,但是由于皮下脂肪不能完全抑制,导致相位方向的伪影与腹部脏器甚至胰腺重叠,图像质量明显下降,因此放弃频率饱和方法),b值为0和600s/mm2,其余扫描参数如表1所示。
3.图像分析及采集数据
在GE Advantage Workstation 4.3工作站上分别测量3.0TMR不同扩散序列图像中正常胰腺(胰头、胰体及胰尾)的平均ADC值,根据需要选取圆形或椭圆形兴趣区(region of interest,ROI),既要使ROI尽量大,又要保证其在目标组织内,避开伪影。
4.统计学方法
应用SPSS16.0统计学软件,正常胰腺的ADC值数据呈正态分布及方差齐性时用单因素方差分析和LSD检验,方差不齐时进行数据转换或者非参数检验,以P<0.05为有统计学意义。
结 果
在 BH600ALL、 BH600SI、 TRIG600ALL、TRIG600ALL+BS和FB600ALL+BS序列中,正常胰腺ADC值差异有统计学意义(F=21.864,P<0.001);其中FB600ALL+BS序列上胰腺ADC值最高[(1.84±0.28)×10-3mm2/s],而BH600SI序列上胰腺ADC值最低[(1.34±0.30)×10-3mm2/s](表2)。除TRIG600ALL+BS和FB600ALL+BS序列间正常胰腺的ADC值无统计学差异外(P=0.796),余两两序列上胰腺的ADC值均有统计学差异(P均<0.05,表3)。

表2 正常胰腺在不同DWI序列上的ADC值比较 (10-3 mm2/s)
在 BH600ALL、 BH600SI、 TRIG600ALL、TRIG600ALL+BS和FB600ALL+BS 5个DWI序列中,胰腺各部位的ADC值均有统计学差异,F值分别为10.999、6.352、3.842、5.521及13.006,P 值均<0.05,其中胰头的ADC值最低,与胰尾的ADC值有统计学差异,P 值分别为0.000061、0.001、0.01、0.023及0.000023,而胰体、胰尾之间无统计学差异,P值分别为0.346、0.129、0.467、0.401及0.435。另外,在BH600ALL、TRIG600ALL+BS和FB600ALL+BS DWI序列中,胰头与胰体的ADC值有统计学差异,P 值分别为 0.001、0.003 及 0.000276,而 在BH600SI和TRIG600ALLDWI序列中,胰头与胰体的ADC值无统计学差异,P值分别为0.051及0.058(表4)。
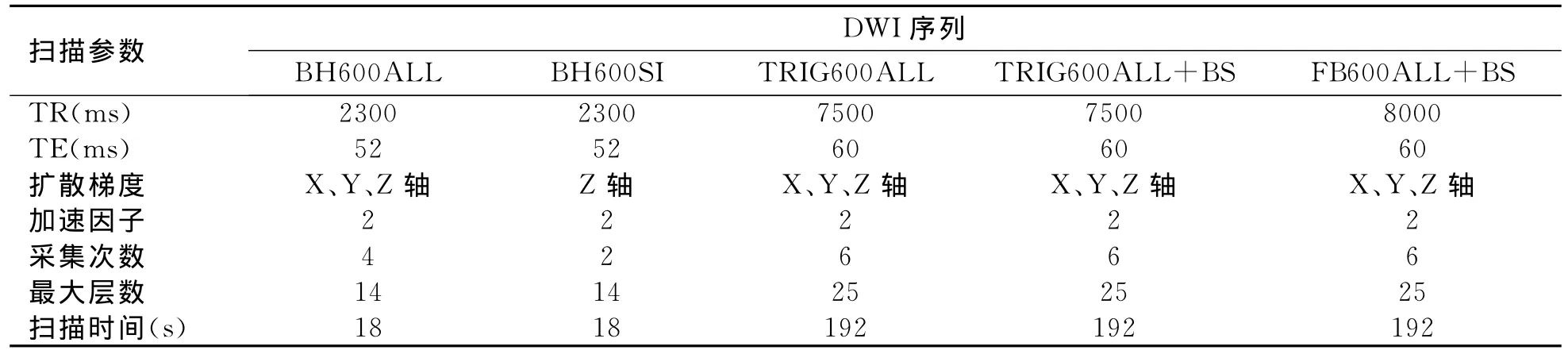
表1 3.0TMR不同DWI序列采集参数

表3 正常胰腺不同DWI序列的ADC值LSD两两检验(P值)
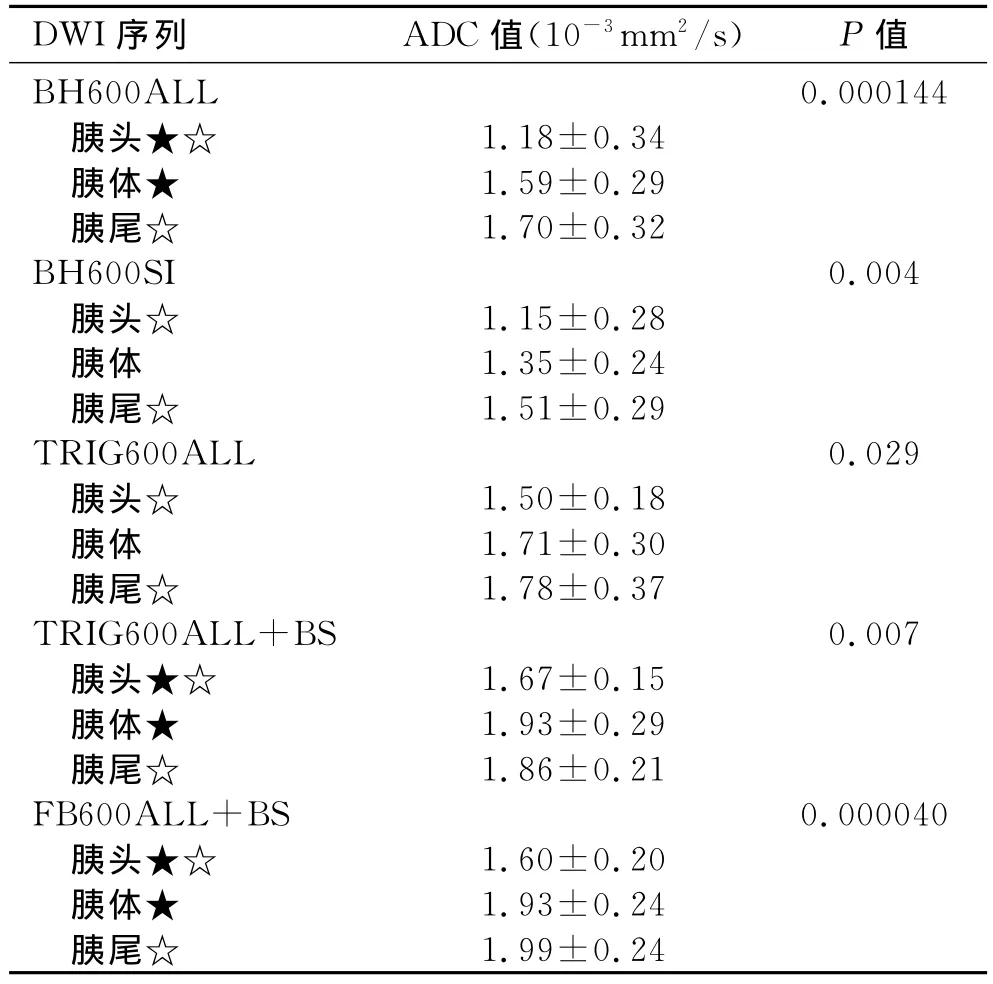
表4 正常胰腺不同部位在不同DWI序列上的ADC值
讨 论
正常胰腺组织的ADC值是用于胰腺病变筛查与鉴别诊断的基础,因此,正常胰腺组织在不同DWI序列中的ADC值大小及其变化的分析极为重要。ADC值的大小与很多因素相关,包括DWI扩散序列信号采集方法、组织细胞密度、纤维含量、血供及生理运动。胰腺作为腹腔内深在位置的不规则线形器官,被周围血管肠道包绕,另外,3.0TMR所带来的更大的能量沉积、磁敏感伪影、呼吸运动以及胰腺周围肠道和血管运动的敏感性使胰腺DWI更具有挑战性,同时会影响不同DWI序列的ADC值。
本研究采用3.0TMR扫描仪中,应用不同DWI信号采集序列及方法,结果发现BH600ALL、BH600SI、TRIG600ALL、TRIG600ALL + BS 和FB600ALL+BS 5个序列在正常胰腺中的ADC值有统计学差异。其中FB600ALL+BS序列上胰腺ADC值最高为(1.84±0.28)×10-3mm2/s,然后依次为TRIG600ALL+BS、TRIG600ALL、BH600ALL 及BH600SI。在5个DWI序列中,除TRIG600ALL+BS和FB600ALL+BS序列间正常胰腺的ADC值无统计学差异外,余两两序列上胰腺的ADC值均有统计学差异。带有呼吸(无论是门控呼吸还是自由呼吸)的3个DWI序列上正常胰腺的ADC值均高于两个憋气序列,说明呼吸运动影响胰腺ADC值,ADC值不仅包括水分子扩散运动及血流灌注效应,还包括呼吸的生理运动;两个背景抑制DWI序列(TRIG600ALL+BS和FB600ALL+BS)中正常胰腺的ADC值统计学上均高于无背景抑制的TRIG600ALL序列,说明TI为220ms的组织特别是脂肪抑制,会导致ADC值的增加,而TRIG600ALL+BS和FB600ALL+BS间正常胰腺的ADC值无统计学上差异,说明门控并不能解决ADC值测量中的呼吸运动影响,每次呼气末采集扩散信号时的胰腺并不在同等位置,仍然有错位问题。BH600ALL和BH600SI两个憋气DWI序列之间正常胰腺的ADC值有统计学上差异,对于各向同性的胰腺,前者高于后者的原因可能是三个轴的扩散梯度所测量的ADC值高于单个轴。
在 BH600ALL、 BH600SI、 TRIG600ALL、TRIG600ALL+BS和FB600ALL+BS 5个DWI序列中,方差分析显示胰头、胰体及胰尾的ADC值均有统计学差异,而胰头的ADC值最低。在BH600ALL、BH600SI、TRIG600ALL和FB600ALL+BS 4个序列中,胰头、胰体及胰尾的ADC值依次增高,而在TRIG600ALL+BS序列中,胰体的ADC值最高,且相对于其它4个序列,胰腺的ADC值离散程度较低。文献报道应用b值为600s/mm2的频率饱和反转恢复脂肪抑制的憋气DWI序列,胰尾的ADC值统计学上低于胰头及胰体,同时胰腺癌的ADC值高于正常胰腺[5]。在3.0TMR上,应用b值为400s/mm2的频率饱和反转恢复脂肪抑制的自由呼吸DWI序列,经过重复测量,胰体的ADC值高于胰头及胰尾,胰头略高于胰尾[6]。本研究各序列的共同点是胰头的ADC值在统计学上均低于胰尾,胰体和胰尾的ADC值无统计学 差 异,在 BH600ALL、TRIG600ALL+BS 和FB600ALL+BS序列中,胰头的ADC值统计学上均低于胰体,而在BH600SI和TRIG600ALL序列上,胰头与胰体之间的ADC值均无统计学差异。这种胰头、胰体及胰尾ADC值的不稳定性可能与胰腺呈线性及各部位周围组织带来的伪影有关。
总之,在 BH600ALL、BH600SI、TRIG600ALL、TRIG600ALL+BS和FB600ALL+BS 5个DWI序列中,胰腺的ADC值随着部位的不同呈不均衡表现。
[1]Naganawa S,Kawai H,Fukatsu H.Diffusion-weighted imaging of the liver:technical challenges and prospects for the future[J].Magn Reson Med Sci,2005,4(4):175-186.
[2]Kandpal H,Sharma R,Madhusudhan KS,et al.Respiratory-triggered versus breath-hold diffusion-weighted MRI of liver lesions:comparison of image quality and apparent diffusion coefficient values[J].AJR,2009,192(4):915-922.
[3]Kwee TC,Takahara T,Koh DM,et al.Comparison and reproducibility of ADC measurements in breathhold,respiratory triggered,and free-breathing diffusion-weighted MR imaging of the liver[J].J Magn Reson Imaging,2008,28(5):1141-1148.
[4]Merkle EM,Dale BM.Abdominal MRI at 3.0T:the basics revisited[J].AJR,2006,186(6):1524-1532.
[5]Yoshikawa T,Kawamitsu H,Mitchell DG,et al.ADC measurement of abdominal organs and lesions using parallel imaging technique[J].AJR,2006,187(6):1521-1530.
[6]Braithwaite AC,Dale BM,Boll DT,et al.Short-and midterm reproducibility of apparent diffusion coefficient measurements at 3.0Tdiffusion-weighted imaging of the abdomen[J].Radiology,2009,250(2):459-465.

