白藜芦醇抑制胰岛素样生长因子1促乳腺癌细胞增殖及其机制的研究*
郭慧琳,张献全
(重庆医科大学附属第二医院肿瘤科,重庆 400010)
乳腺癌是女性最常见的恶性肿瘤之一,尽管化疗和内分泌疗法已普遍应用于乳腺癌的治疗,并显示出一定效果,但是有相当部分的患者治疗后复发转移[1]。因此,寻求预防和治疗乳腺癌复发转移的有效低毒药物具有重要意义。胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)与乳腺癌的发生、发展密切相关,IGF-1通过自分泌和旁分泌方式在乳腺癌的发病中发挥重要作用,靶向抑制IGF-1的促肿瘤细胞增殖效应可提高对乳腺癌细胞的杀伤作用[2]。白藜芦醇是广泛存在于葡萄、虎杖等多种植物中的非黄酮类多酚化合物。研究发现白藜芦醇对多种恶性肿瘤细胞具有显著的抑制作用[3]。但是,白藜芦醇能否抑制IGF-1的促乳腺癌的增殖效应并不清楚。本研究将人乳腺癌MCF-7细胞作为研究对象,观察白藜芦醇对IGF-1促乳腺癌细胞增殖的抑制效应,并探讨其抑制IGF-1作用的分子机制。
1 材料与方法
1.1 主要试剂与细胞株 DMEM干粉培养基购自美国Hy-Clone公司;磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化PI3K(p-PI3K)、丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinases,AKT)及磷酸化AKT(p-AKT)抗体均为兔抗多克隆抗体,购自美国Cell Signaling公司;PI3K抑制剂——Wortmannin购自美国Sigma公司;SuperSignal化学发光试剂盒购自美国Pierce公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)为北京中衫金桥生物技术有限公司产品。人乳腺癌MCF-7细胞株购自中科院上海生化细胞研究所。
1.2 细胞培养 将MCF-7细胞置于含10%胎牛血清的DMEM培养基中,在37℃,含有95%空气和5%CO2的培养箱中常规培养。待细胞长至融合状态时以0.25%胰蛋白酶消化、传代。
1.3 细胞增殖实验 将细胞制成单细胞悬液,计数后将细胞密度调整为1×104/mL,接种于96孔培养板,培养24h,细胞贴壁后换为无血清培养基培养4h,分别用不同浓度IGF-1(10、20、40ng/mL)或白藜芦醇(10、25、50μmol/L)作用 MCF-7细胞48h,然后每孔加入20μL MTT(5mg/mL)溶液,置培养箱中继续培养4h,吸弃上清液终止培养,每孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μL,于振荡器上摇匀10min,在490nm波长处测各孔细胞的吸光度值。以不用药物处理的细胞作为对照。
1.4 免疫印迹实验 药物作用后的MCF-7细胞经常规方法提取蛋白,考马斯亮蓝法测定细胞提取物的蛋白质浓度。加入上样缓冲液,沸水浴5min,取等量总蛋白行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),采用半干转移法将蛋白质转移至硝酸纤维素膜。室温下用5%脱脂奶粉封闭3h,然后将膜与抗PI3K、p-PI3K、AKT及p-AKT抗体(1∶400稀释)作用,4℃孵育过夜;用含吐温-20的Tris缓冲液(Tris-buffered saline with Tween-20,TBST)洗膜3次;加入羊抗兔IgG(1∶5 000稀释),室温孵育1h;TBST洗膜3次,采用Super-Signal化学发光试剂盒显色发光。
1.5 统计学处理 应用SPSS17.0软件进行统计学分析,计量资料用表示,组间比较采用t检验,两组以上的比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
2 结 果
2.1 IGF-1对MCF-7细胞的促增殖效应 IGF-1作用48h后,MCF-7细胞增殖明显,随着IGF-1作用浓度的不断增加,其对MCF-7细胞增殖的促进效应不断增强(P<0.05),见图1。
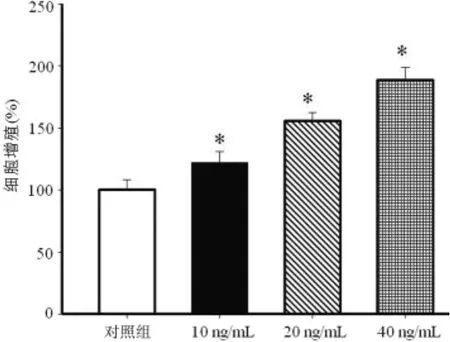
图1 不同浓度IGF-1对MCF-7细胞增殖的影响
2.2 白藜芦醇对MCF-7细胞增殖的抑制效应 白藜芦醇对MCF-7细胞具有一定的增殖抑制作用,随着白藜芦醇作用浓度的增加,其对MCF-7细胞的抑制效应逐渐增强(P<0.05),见图2。
2.3 白藜芦醇对IGF-1促MCF-7细胞增殖的抑制效应 白藜芦醇(10、25、50μmol/L)与IGF-1(40ng/mL)共同作用MCF-7细胞48h后,MCF-7细胞增殖明显降低,并呈浓度依赖性(P<0.05),见图3。
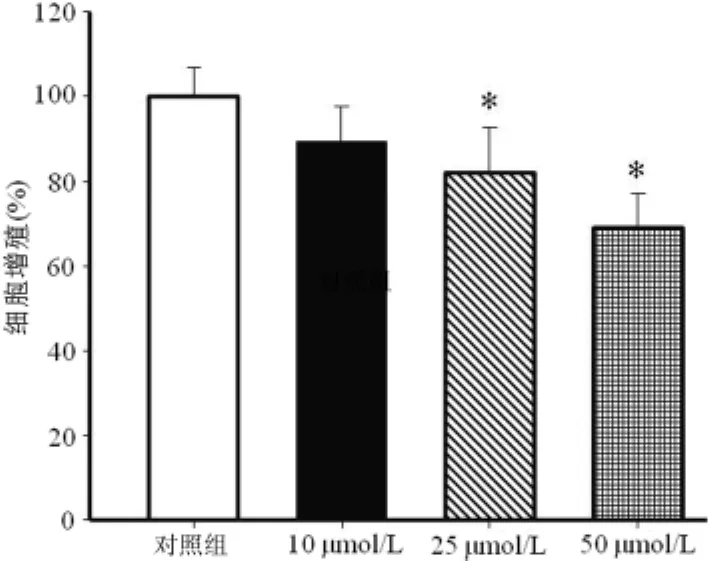
图2 不同浓度白藜芦醇对MCF-7细胞增殖的影响

图3 白藜芦醇对IGF-1促MCF-7细胞增殖的抑制效应
2.4 PI3K-AKT信号途径在IGF-1介导的促MCF-7细胞增殖中的作用 为了明确PI3K-AKT信号途径在IGF-1介导的促MCF-7细胞增殖中的作用,利用PI3K抑制剂Wortmannin与IGF-1共作用MCF-7细胞48h。结果显示经Wortmannin(10-6mol/L)预处理后,IGF-1(40ng/mL)对 MCF-7细胞的促增殖效应受到明显抑制(P<0.05),见图4,提示PI3K-AKT信号途径在IGF-1介导的促MCF-7细胞增殖效应中发挥了重要作用。
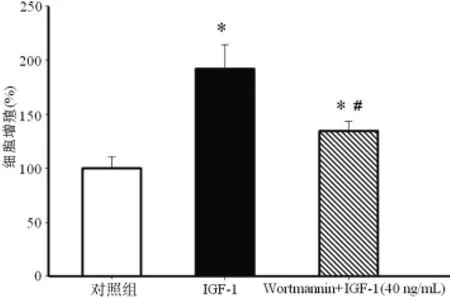
图4 Wortmannin对IGF-1促MCF-7细胞增殖效应的影响
2.5 白藜芦醇对IGF-1促增殖信号的抑制作用 为了探讨白藜芦醇抑制IGF-1促MCF-7细胞增殖的分子机制,采用免疫印迹法检测白藜芦醇对IGF-1促增殖信号的影响。结果发现,IGF-1(40ng/mL)作用30min后,p-PI3K与p-AKT蛋白的表达水平明显提高(P<0.05),但对总PI3K与AKT蛋白表达没有影响(P>0.05)。以白藜芦醇(50μmol/L)、IGF-1(40ng/mL)共同作用MCF-7细胞后,细胞中p-PI3K与p-AKT蛋白表达水平明显低于IGF-1组(P<0.05),见图5、6。上述结果提示白藜芦醇抑制IGF-1促MCF-7细胞增殖效应与其抑制IGF-1激活的PI3K-AKT信号途径密切相关。

图5 白藜芦醇(50μmol/L)对IGF-1诱导p-PI3K表达的影响

图6 白藜芦醇(50μmol/L)对IGF-1诱导p-AKT表达的影响
3 讨 论
IGF-1是促进细胞增殖、分化与血管形成等生物学效应的多肽生长因子。IGF-1与其受体结合后,具有促进肿瘤细胞增殖,诱导细胞向恶性表型转化,抑制肿瘤细胞凋亡等作用,与多种恶性肿瘤的发生、发展、转移密切相关[4]。IGF-1以内分泌、自分泌和旁分泌方式作用于靶器官,局部合成和分泌的IGF-1可能与血液循环中的IGF-1共同对局部组织发挥作用。来自12个国家的7个前瞻性研究数据显示,血液循环中IGF-1水平与乳腺癌的危险性密切相关,乳腺癌组织中IGF-1的表达水平可作为独立预后因素[5-6]。而且,IGF-1受体基因的表达与原发性乳腺癌的预后具有密切关联,特异性抑制IGF-1受体可以降低乳腺癌细胞的增殖[7-8]。以上研究提示IGF-1在乳腺癌的发展、发展中具有重要作用,如何有效抑制其促肿瘤细胞的增殖效应具有重要意义。
近年来,白藜芦醇的抗肿瘤活性受到广泛重视。研究发现白藜芦醇对肺癌、肝癌、前列腺癌等多种肿瘤具有显著抑制作用[9-10]。其中,白藜芦醇对乳腺癌的多种生物学作用引起人们的关注。研究表明白藜芦醇在多种乳腺癌细胞中具有抑制增殖效应。Sareen等[11]在体外实验中证实白藜芦醇能有效降低乳腺癌移植瘤的大小。白藜芦醇通过半胱-天冬氨酸蛋白酶(cysteinyl aspartate specific protease,Caspase)依赖或非依赖的方式诱导乳腺癌细胞凋亡;通过抑制基质金属蛋白酶(matrix metalloproteinase,MMP)的表达而降低乳腺癌细胞的迁徙;还可以明显增强环磷酰胺、雷帕霉素等药物的抗肿瘤作用[12-14]。Levi等[15]证实白藜芦醇与乳腺癌发病率呈负相关。但是,白藜芦醇作为重要的肿瘤细胞抑制剂,是否对IGF-1的促乳腺癌细胞增殖效应具有抑制作用并不清楚。本研究以乳腺癌MCF-7细胞为研究对象,观察白藜芦醇对IGF-1促乳腺癌细胞增殖是否具有抑制效应。结果发现,IGF-1促MCF-7细胞的增殖作用明显,而白藜芦醇能明显抑制IGF-1的促MCF-7细胞增殖效应。与白藜芦醇单独作用抑制MCF-7细胞的增殖效应比较,白藜芦醇与IGF-1共同作用对MCF-7细胞的抑制作用更为显著。
PI3K-AKT信号途径在乳腺癌细胞增殖过程中发挥了重要作用。雌激素通过雌激素受体依赖的PI3K-AKT信号途径促进乳腺癌细胞的增殖;PI3K-AKT途径导致Bcl-2转录与表达增强,促进了乳腺癌细胞的生存;PI3K活性过高可导致乳腺癌细胞对内分泌治疗的抵抗或逃逸[16-17]。近年来的研究还发现PI3K-AKT的下游激酶也在雌激素受体介导的乳腺癌细胞生存中扮演了重要角色[18]。而且,PI3K-AKT信号途径在IGF-1等诸多因素促肿瘤细胞增殖中扮演了重要角色[19]。本研究发现利用PI3K抑制剂Wortmannin能够有效抑制IGF-1的促MCF-7细胞增殖作用,提示PI3K-AKT信号途径参与了IGF-1的促MCF-7细胞增殖过程。有报道指出白藜芦醇通过PI3K-AKT信号途径抑制乳腺癌细胞的迁移和侵袭[13]。本研究通过免疫印迹检测发现,IGF-1能够显著提高MCF-7细胞p-PI3K与p-AKT蛋白的表达水平,提示其激活MCF-7细胞的PI3K-AKT信号途径。进一步研究发现白藜芦醇能够显著降低IGF-1促p-PI3K与p-AKT蛋白表达的作用,提示白藜芦醇抑制IGF-1促MCF-7细胞增殖与其抑制IGF-1激活PI3KAKT信号途径有关。
综上所述,白藜芦醇对IGF-1介导的乳腺癌细胞增殖具有明显抑制作用,在一定程度上能够遏制IGF-1的促瘤效应,其抑制IGF-1促乳腺癌细胞增殖效应与抑制PI3K-AKT信号途径有关。对白藜芦醇进一步深入研究将对其在乳腺癌治疗的临床应用具有重要意义。
[1]Mego M,Mani SA,Cristofanilli M.Molecular mechanisms of metastasis in breast cancer——clinical applications[J].Nat Rev Clin Oncol,2010,7(12):693-701.
[2]Walsh LA,Damjanovski S.IGF-1increases invasive potential of MCF 7breast cancer cells and induces activation of latent TGF-β1resulting in epithelial to mesenchymal transition[J].Cell Commun Signal,2011,9(1):10.
[3]Shukla Y,Singh R.Resveratrol and cellular mechanisms of cancer prevention[J].Ann N Y Acad Sci,2011,1215:1-8.
[4]Alberobello AT,D′esposito V,Marasco D,et al.Selective disruption of insulin-like growth factor-1(IGF-1)signaling via phosphoinositide-dependent kinase-1prevents the protective effect of IGF-1on human cancer cell death[J].J Biol Chem,2010,285(9):6563-6572.
[5]Endogenous H,Breast CA.Insulin-like growth factor 1(IGF1),IGF binding protein 3 (IGFBP3),and breast cancer risk:pooled individual data analysis of 17prospective studies[J].Lancet Oncol,2010,11(6):530-542.
[6]Chong KY,Subramanian A,Mokbel K,et al.The prognostic significance of the insulin-like growth factor-1 ligand and receptor expression in breast cancer tissue[J].Surg Oncol,2011,104(3):228-235.
[7]Fu P,Ibusuki M,Yamamoto Y,et al.Insulin-like growth factor-1receptor gene expression is associated with survival in breast cancer:a comprehensive analysis of gene copy number,mRNA and protein expression[J].Breast cancer Res Treat,2011,130(1):307-317.
[8]Mukohara T,Shimada H,Ogasawara N,et al.Sensitivity of breast cancer cell lines to the novel insulin-like growth factor-1receptor(IGF-1R)inhibitor NVP-AEW541is dependent on the level of IRS-1expression[J].Cancer Lett,2009,282(1):14-24.
[9]Miki H,Uehara N,Kimura A,et al.Resveratrol induces apoptosis via ROS-triggered autophagy in human colon cancer cells[J].Int J Oncol,2012,40(4):1020-1028.
[10]Bae S,Lee EM,Cha HJ,et al.Resveratrol alters microRNA expression profiles in A549human non-small cell lung cancer cells[J].Mol Cells,2011,32(3):243-249.
[11]Sareen D,Darjatmoko SR,Albert DM,et al.Mitochondria,Calcium,and calpain are key mediators of resveratrol-induced apoptosis in breast cancer[J].Mol Pharmacol,2007,72(6):1466-1475.
[12]Alkhalaf M,El-Mowafy A,Renno W,et al.Resveratrolinduced apoptosis in human breast Cancer cells is media-ted primarily through the caspase-3-dependent pathway[J].Arch Med Res,2008,39(2):162-168.
[13]Tang FY,Yc S,Chen NC,et al.Resveratrol inhibits migration and invasion of human breast-cancer cells[J].Mol Nutr Food Res,2008,52(6):683-691.
[14]Singh N,Nigam M,Ranjan V,et al.Resveratrol as an adjunct therapy in cyclophosphamide-treated MCF-7cells and breast tumor explants[J].Cancer Sci,2011,102(5):1059-1067.
[15]Levi F,Pasche C,Lucchini F,et al.Resveratrol and breast Cancer risk[J].Eur J Cancer Prev,2005,14(2):139-142.
[16]Bratton MR,Duong BN,Elliott S,et al.Regulation of ER-alpha-mediated transcription of Bcl-2by PI3K-AKT crosstalk:implications for breast Cancer cell survival[J].Int J Oncol,2010,37(3):541-550.
[17]Miller TW,Hennessy BT,González-Angulo AM,et al.Hyperactivation of phosphatidylinositol-3kinase promotes escape from hormone dependence in estrogen receptor-positive human breast cancer[J].J Clin Invest,2010,120(7):2406-2413.
[18]Wang Y,Zhou D,Phung S,et al.SGK3is an estrogen-inducible kinase promoting estrogen-mediated survival of breast Cancer cells[J].Mol Endocrinol,2011,25(1):72-82.
[19]Ma JC,Sawai H,Matsuo Y,et al.IGF-1mediates PTEN suppression and enhances cell invasion and proliferation via activation of the IGF-1/PI3K/AKT signaling pathway in pancreatic Cancer cells[J].J Surg Res,2010,160(1):90-101.

