依维莫司联合顺铂对人胃癌SGC7901细胞凋亡及Bcl-2、Bax表达的影响
刘 莹,朱祖安,崔 涛,孔庆兖,刘 磊,张瑞瑞
(1.徐州医学院病理学教研室,江苏徐州 221004;2.徐州医学院附属医院消化内科,江苏徐州 221002))
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的过度活化与肿瘤的发生、发展密切相关[1-2]。顺铂是当前消化道肿瘤联合化疗中常用的药物之一,但其药理作用的发挥往往需要很高剂量,从而导致较为严重的胃肠道不良反应。因此,联合用药成为减少顺铂不良反应的有效手段。依维莫司(everolimus,RAD001)是mTOR特异性抑制剂雷帕霉素的衍生剂,Fingar等[3]将RAD001作用于成人T细胞白血病(adult T-cell leukemia,ATL)和人T淋巴细胞白血病病毒-1(human T-cell leukemia virus type 1,HTLV-1)白血病的T细胞后发现其能阻滞细胞周期,诱导细胞凋亡。Chiang等[4]研究发现RAD001联合吉西他滨及紫杉醇治疗非霍奇金淋巴瘤对肿瘤细胞凋亡有协同作用。Hayun等[5]研究显示,雷帕霉素和姜黄素通过降低Bcl-2,升高Bax,从而提高半胱-天冬氨酸蛋白酶(cysteinyl aspartate specific protease,Caspase)-9、Caspase-3和Caspase-7的活性,诱发慢性B细胞性白血病细胞的凋亡。本实验通过体外培养人胃癌SGC7901细胞,并予RAD001及顺铂处理,检测细胞凋亡及细胞中Bcl-2、Bax蛋白表达的改变,探讨Bcl-2/Bax在RAD001联合顺铂促SGC7901细胞凋亡中的作用。
1 材料与方法
1.1 材料 人胃癌SGC7901细胞株购自中国科学院上海细胞生物学研究所;RPMI 1640培养基、胎牛血清均购自美国Gibco公司;RAD001购自美国Sigma公司,用二甲基亚砜(dimethyl sulfoxide,DMSO)配成1mmol/L贮备液,实验时用RPMI 1640稀释为实验所需浓度;顺铂购自江苏豪森药业股份有限公司;鼠抗人Bcl-2(sc-130308)、Bax(sc-6236)单克隆抗体均购自美国Santa Cruz公司;链霉素抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)免疫细胞化学试剂盒及二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色剂均购自北京中杉金桥生物技术有限公司;Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒(KGA107)购于南京凯基生物科技发展有限公司;其他试剂均为分析纯级。
1.2 方法
1.2.1 细胞培养 SGC7901细胞在37℃,5%CO2培养箱中培养,培养基含10%胎牛血清、100U/mL青霉素和100μg/mL链霉素,用0.5%的胰蛋白酶消化传代,取对数生长期、细胞活力大于99%的细胞用于实验研究。
1.2.2 细胞凋亡的流式细胞仪检测 消化对数生长期SGC7901细胞,制成密度为1.0×105/mL的细胞悬液,置于6孔板内,每孔5mL。24h细胞附壁后移去上清液,无血清培养12h后,加入药物干预,将细胞分为对照组,顺铂组(2.50mg/L干预),RAD001低、中、高浓度组(浓度分别为5.00、10.00、20.00nmol/L)及联合组(顺铂1.25mg/L+RAD001 5.00nmol/L干预),每组3个平行样本。48h后收集细胞,采用Annexin V-FITC细胞凋亡检测试剂盒进行染色,流式细胞仪检测细胞凋亡率。
1.2.3 细胞Bcl-2、Bax蛋白的SP免疫细胞化学法检测 消化对数生长期SGC7901细胞,制成密度为1.0×105/mL的细胞悬液,置于放入圆形盖玻片的6孔板内,每孔5mL,细胞分组同1.2.2部分,24h后按分组加药干预,每组3个平行样本。继续培养48h,取出盖玻片,用中性甲醛溶液固定,采用SP免疫细胞化学法检测细胞中Bcl-2和Bax蛋白的表达,Bcl-2和Bax蛋白主要表达于细胞质,阳性染色为深浅不一的黄棕色颗粒。每组随机观察10个高倍视野,计数阳性细胞数占视野总细胞数的百分比。
1.2.4 细胞Bcl-2、Bax蛋白的Western blot检测 待细胞铺满瓶底约90%后,移去上清液,实验分组同1.2.2,按分组加入药物,最终体积5mL,每组3个平行样本。药物作用48h后收集细胞,加入蛋白裂解液,提取蛋白后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),半干转至硝酸纤维膜上,加入鼠抗人Bcl-2、Bax单克隆抗体,4℃冰箱过夜孵育后,洗涤加入第二抗体,室温孵育2h,洗涤后用显色液显色,以β-actin为内参。
1.3 统计学处理 采用SPSS16.0软件进行统计学分析,计量资料用表示,组间比较采用单因素方差分析,两两比较采用q检验。检验标准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 RAD001、顺铂对SGC7901细胞凋亡率的影响 RAD001单独或联合顺铂作用SGC7901细胞48h后,对照组,顺铂组,RAD001低、中、高浓度组及联合组的细胞凋亡率分别为(8.04±0.48)%、(18.94±0.75)%、(10.47±1.05)%、(13.93±2.45)%、(17.20±0.65)%及(23.18±1.05)%。除RAD001低浓度组细胞凋亡率与对照组比较,差异无统计学意义(P>0.05)外,其他各组细胞凋亡率均较对照组显著增加(P<0.05);随着RAD0001浓度的增加,细胞凋亡率逐渐增加,结果显示细胞凋亡率存在RAD0001浓度依赖性(P<0.05);联合组分别与RAD001中浓度组、顺铂组比较,差异有统计学意义(P<0.05),见图1。

图1 RAD001、顺铂对SGC7901细胞凋亡影响的流式细胞分析(48h)

图2 RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响(SP×400)
表1 免疫细胞化学检测RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响(,n=3)
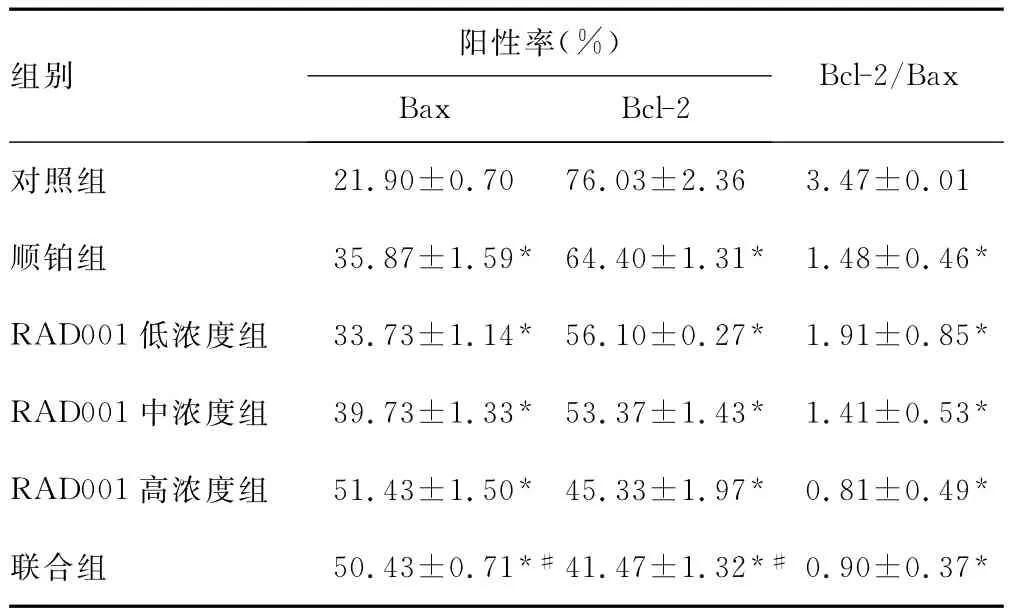
表1 免疫细胞化学检测RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响(,n=3)
*:P<0.05,与对照组比较;#:P<0.05,与顺铂组、RAD001中浓度组比较。
阳性率(%)组别Bcl-2/Bax Bax Bcl-2 21.90±0.70 76.03±2.36 3.47±0.01顺铂组 35.87±1.59* 64.40±1.31* 1.48±0.46*RAD001低浓度组 33.73±1.14* 56.10±0.27* 1.91±0.85*RAD001中浓度组 39.73±1.33* 53.37±1.43* 1.41±0.53*RAD001高浓度组 51.43±1.50* 45.33±1.97* 0.81±0.49*联合组 50.43±0.71*#41.47±1.32*#0.90±0.37对照组*
表2 Western blot检测RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响(,n=3)

表2 Western blot检测RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响(,n=3)
*:P<0.05,与对照组比较。
组别0.35±0.01 1.32±0.07顺铂组 0.59±0.02* 0.68±0.01*RAD001低浓度组 0.47±0.01* 0.84±0.03*RAD001中浓度组 0.58±0.02* 0.74±0.01*RAD001高浓度组 0.67±0.01* 0.64±0.03*联合组 0.68±0.03* 0.61±0.03 Bax Bcl-2对照组*
2.2 RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响 免疫细胞化学检测显示,SGC7901细胞Bcl-2和Bax蛋白主要表达于细胞质,阳性染色为棕黄色颗粒,见图2。作用48h后,与对照组比较,RAD001组、顺铂组及联合组SGC7901细胞Bcl-2蛋白表达下降,而Bax蛋白表达增加,Bcl-2/Bax比值降低(P<0.05),见表1;联合组分别与RAD001中浓度组、顺铂组比较,差异有统计学意义(P<0.05)。Western blot检测显示,与对照组比较,RAD001单独或联合顺铂作用48h后,SGC7901细胞Bcl-2蛋白表达下降,Bax蛋白表达增加(P<0.05),其中以联合组改变最明显,见图3、表2。

图3 Western blot检测RAD001、顺铂对SGC7901细胞Bcl-2和Bax蛋白表达的影响
3 讨 论
mTOR是一种进化十分保守的丝氨酸/苏氨酸蛋白激酶,其主要控制与细胞生长和增殖密切相关蛋白质的合成[6],目前发现mTOR与恶性肿瘤生长、增殖、分化、凋亡等密切相关[7-8]。雷帕霉素可与细胞内受体FK506结合蛋白12(FK506-binding protein,FKBP12)结合形成 FKBP-雷帕霉素复合物,再与mTOR的FRB激酶结构域相结合,从而抑制mTOR的激酶活性[9]。过去对于RAD001的研究国内局限于其作为免疫抑制剂在移植方面的应用,近年在肿瘤方面的研究不断增多[10-12]。
研究表明,mTOR在胃癌的发生、发展中呈现过表达[13-14],mTOR阳性患者较 mTOR阴性患者预后差[15-16]。本实验中利用mTOR特异性抑制剂RAD001干预胃癌SGC7901细胞,流式细胞仪检测细胞凋亡结果发现,高浓度RAD001可以促进SGC7901细胞凋亡;联合用药作用更为显著。这些结果进一步证实mTOR在胃癌的发生、发展过程中发挥了重要作用。
作者前期研究发现RAD001可通过下调Survivin蛋白表达而促进SGC7901细胞的凋亡,从而抑制胃癌SGC7901细胞的增殖[17]。从凋亡发生的机制来看,Survivin和Bcl-2分别通过不同通路行使不同的抗凋亡功能。在凋亡过程中有多种蛋白参与调控,除Survivin外,Bcl-2蛋白家族是人们研究最多的一类凋亡蛋白。Bcl-2家族成员分为两大类:促凋亡类,如Bid、Bax、Bak等;抑凋亡类,如Bcl-2、Bcl-x1等,这2类蛋白可通过形成异二聚体发挥相互拮抗或放大作用[18-19]。因此,Bcl-2/Bax的比值是决定细胞凋亡与否的主要因素。从作用机制而言,Bcl-2不仅可能通过抑制细胞色素C从线粒体的释放而调控线粒体渗透性转换孔的开启,从而抑制Caspase-3的活化,还可能参与抑制Caspase-3的合成[20-21]。
为了进一步探讨RAD001的促细胞凋亡机制,本实验中采用SP免疫细胞化学及Western blot方法检测细胞Bcl-2和Bax蛋白的表达。结果显示RAD001单独及联合顺铂可诱导SGC7901细胞凋亡,联合作用强于单独用药。RAD001单独作用SGC7901细胞可下调Bcl-2,上调Bax蛋白表达,Bcl-2/Bax比值下降;RAD001联合顺铂作用后这种作用增强。因此,作者认为RAD001联合顺铂可通过上调Bax和下调Bcl-2蛋白的表达,诱导SGC7901细胞凋亡。但本实验仅为体外实验,下一步作者将会应用RAD001联合顺铂作用于裸鼠异种移植性胃癌模型,进行哺乳动物的体内实验,以揭示RAD001在胃癌治疗上的潜在应用价值,为其今后临床应用提供实验依据。
[1]Lang SA,Gaumann A,Koehl GE,et al.Mammalian target of rapamycin is activated in human gastric cancer and serves as a target for therapy in an experimental model[J].Int J Cancer,2007,120(8):1803-1810.
[2]Lang SA,Gaumann A,Koehl GE,et al.Mammalian target of rapamycin is activated in human gastric cancer and serves as a target for therapy in an experimental model[J].Int J Cancer,2007,120(8):1803-1810.
[3]Fingar DC,Blenis J.Target of rapamycin(TOR):an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression[J].Oncogene,2004,23(18):3151-3171.
[4]Chiang CT,Yeh PY,Gao M,et al.Combinations of mTORC1 inhibitor RAD001with gemcitabine and paclitaxel for treating non-Hodgkin lymphoma[J].Cancer Lett,2010,298(2):195-203.
[5]Hayun R,Okun E,Berrebi A,et al.Rapamycin and curcumin induce apoptosis in primary resting B chronic lymphocytic leukemia cells[J].Leuk Lymphoma,2009,50(4):625-632.
[6]Latres E,Amini AR,Amini AA,et al.Insulin-like growth factor-1 (IGF-1)inversely regulates atrophy-induced genes via the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin (PI3K/Akt/mTOR)pathway[J].J Biol Chem,2005,280(4):2737-2744.
[7]Philp AJ,Campbell IG,Leet C,et al.The phosphatidylinositol 3′-kinase p85alpha gene is an oncogene in human ovarian and colon tumors[J].Cancer Res,2001,61(20):7426-7429.
[8]Mabuchi S,Altomare DA,Cheung M,et al.RAD001inhibits human ovarian cancer cell proliferation,enhances cisplatin-induced apoptosis,and prolongs survival in an ovarian cancer model[J].Clin Cancer Res,2007,13(14):4261-4270.
[9]Jacinto E,Hall MN.Tor signalling in bugs,brain and brawn[J].Nat Rev Mol Cell Biol,2003,4(2):117-126.
[10]Xu B,Wu Y,Shen L,et al.Two-dose-level confirmatory study of the pharmacokinetics and tolerability of everolimus in Chinese patients with advanced solid tumors[J].J Hematol Oncol,2011,4:3.
[11]Lim T,Lee J,Lee DJ,et al.Phase I trial of capecitabine plus everolimus(RAD001)in patients with previously treated metastatic gastric cancer[J].Cancer Chemother Pharmacol,2011,68(1):255-262.
[12]Lee KH,Hur HS,Im SA,et al.RAD001shows activity against gastric cancer cells and overcomes 5-FU resistance by downregulating thymidylate synthase[J].Cancer Lett,2010,299(1):22-28.
[13]Murayama T,Inokuchi M,Takagi Y,et al.Relation between outcomes and localisation of p-mTOR expression in gastric cancer[J].Br J Cancer,2009,100(5):782-788.
[14]徐大志,夏良平,林桐榆,等.磷酸化的哺乳动物雷帕霉素靶蛋白在胃癌组织中的表达[J].中山大学学报:医学科学版,2009,30(3):304-307.
[15]潘军,于观贞,陈颖,等.mTOR和VEGF在胃癌中的表达及与预后关系的研究[J].临床肿瘤学杂志,2008,13(8):695-699.
[16]Boehm A,Mayerhofer M,Herndlhofer S,et al.Evaluation of in vivo antineoplastic effects of rapamycin in patientswith chemotherapy-refractory AML[J].Eur J Intern Med,2009,20(8):775-778.
[17]刘磊,刘莹,孔庆兖.RAD001对胃癌SGC7901细胞生长的抑制作用及分子机制[J].南京医学大学学报:自然科学版,2011,31(1):31-37.
[18]Fernández-Luna JL.Apoptosis regulators as targets for cancer therapy[J].Clin Transl Oncol,2007,9(9):555-562.
[19]Topuridze ML,Kipiani VA,Pavliashvili NS,et al.Molecular mechanisms of apoptosis[J].Georgian Med News,2007(150):38-45.
[20]Lalier L,Cartron PF,Juin P,et al.Bax activation and mitochondrial insertion during apoptosis[J].Apoptosis,2007,12(5):887-896.
[21]Adams JM,Cory S.Bcl-2-regulated apoptosis:mechanism and therapeutic potential[J].Curr Opin Immunol,2007,19(5):488-496.
——雷帕霉素

