纳美芬对脑肿瘤术后患者血浆皮质醇、促肾上腺皮质激素及葡萄糖水平的影响
邓民强,田仁副,潘 柯,周 晗,姜清泉,向 飞
(湖北省恩施州中心医院神经外科,湖北恩施 445000)
脑肿瘤的手术治疗为有创治疗,通常在术后引发强烈的应激反应,过强的应激反应对患者康复不利[1]。因此,降低手术后患者的应激水平对其康复和预后起着重要作用。目前临床常用阿片类受体拮抗剂来降低术后患者的应激水平,这类药物能降低阿片肽所导致的继发性颅脑损伤,在脑保护方面起着积极作用[2-3]。笔者以接受颅脑肿瘤切除术患者为研究对象,探讨新一代阿片受体拮抗剂——盐酸纳美芬对术后患者应激状态、神经功能改善及预后的作用,现将结果报道如下。
1 资料与方法
1.1 一般资料 选择2009年4月至2011年6月在本科住院接受脑肿瘤手术的185例患者,经病理检查,其中,垂体瘤58例(侵袭性38例,非侵袭性20例),颅咽管瘤22例,胶质瘤55例,脑膜瘤32例,肺癌脑转移瘤18例。选择同期入院尚未接受颅内手术的44例脑肿瘤患者作为对照。上述患者均经头颅CT和(或)磁共振成像(magnetic resonance imaging,MRI)检查确诊。
1.2 入选标准 (1)年龄在16周岁以上;(2)无既往开颅手术史;(3)3个月内随访无再次行开颅手术;(4)术后随访无癫痫发作;(5)无危及生命的心血管疾病,收缩压不超过120mm Hg或舒张压不超过90mm Hg(1mm Hg=0.133kPa);(6)术后未使用阿片肽类或阿片肽类受体拮抗药。
1.3 分组及治疗方案 将上述接受脑肿瘤手术的185例患者作为治疗组,按治疗方案再分为常规治疗组(n=90)及纳美芬治疗组(n=95),44例尚未接受颅内手术的患者为对照组,3组患者的年龄、性别组成、肿瘤病理类型、基础血糖水平差异无统计学意义(P>0.05),具有可比性。所有入选对象均严格规范用药。常规治疗组患者术后接受常规抗感染、营养神经及对症治疗;纳美芬治疗组患者在常规治疗的基础上,从术后第1天开始静脉滴注盐酸纳美芬(灵宝市豫西药业有限责任公司)8μg·kg-1·d-1,持续6d。
1.4 指标检测 抽取对照组患者清晨空腹血;常规治疗组与纳美芬治疗组患者均于术后纳美芬治疗前(d0),纳美芬治疗第2天(d2)、第4天(d4)、第6天(d6)时抽取空腹血。血液标本经抗凝处理,离心10min(离心半径8cm,4 000r/min)。采用Roche 6000全自动生化分析仪,用葡萄糖氧化酶-过氧化物酶(glucose oxidase-peroxidase,GOD-POD)法检测血浆葡萄糖(检测试剂为Roche公司配套试剂);采用酶放大化学发光法检测血浆皮质醇及促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),检测试剂盒为美国DPC公司产品,所有检测均严格按试剂盒说明书进行操作,检测过程未出现异常。
1.5 疗效评价 常规治疗组与纳美芬治疗组患者于术后第3、5、7、14、60天采用格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分及Barthel指数评分进行神经功能评估,Barthel指数评分与术前相同或不低于60分认定为神经功能改善。患者术后有效随访90d,第90天采用卡氏身体功能状态(Karnofsky′s performance status,KPS)评分进行远期疗效评价,KPS评分不低于70分为具有较好的自理能力。
1.6 统计学处理 采用SPSS11.5软件进行统计学分析,经正态分布检验,符合正态分布的计量资料以表示,计量资料用单侧t检验,计数资料用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 患者术后血浆皮质醇、ACTH及葡萄糖检测结果的比较在d0、d2、d4、d6时间点,常规治疗组患者的血浆皮质醇、ACTH、葡萄糖浓度均明显高于对照组(P<0.05);纳美芬治疗组患者血浆皮质醇、葡萄糖浓度在d6时间点与对照组的差异无统计学意义(P>0.05),其余时间点上述3项指标均明显高于对照组(P<0.05)。d0时间点,常规治疗组与纳美芬治疗组患者上述指标间的差异无统计学意义(P>0.05);在d2、d4、d6时间点,纳美芬治疗组患者的血浆皮质醇、ACTH、葡萄糖浓度均显著低于常规治疗组(P<0.05)。见表1。
2.2 患者术后GCS评分的比较 为了评价患者术后的神经功能改善情况,术后第3、5、7、14、60天对常规治疗组及纳美芬治疗组患者进行GCS评分[4],并统计两组患者的GCS得分,见表2。以第3天GCS评分结果为基数,分析患者意识状态的改善情况,纳美芬治疗组患者累计意识等级上升情况明显优于常规治疗组(P<0.05),见表3。
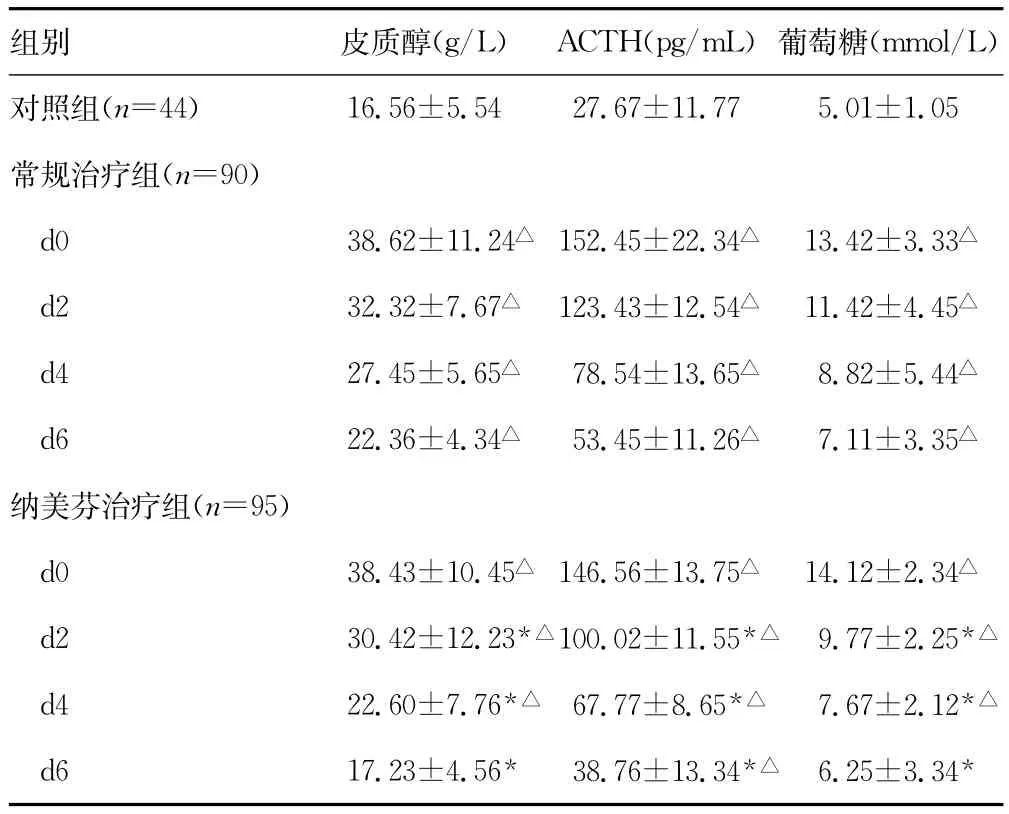
表1 术后各组患者血浆皮质醇、ACTH、葡萄糖浓度的比较
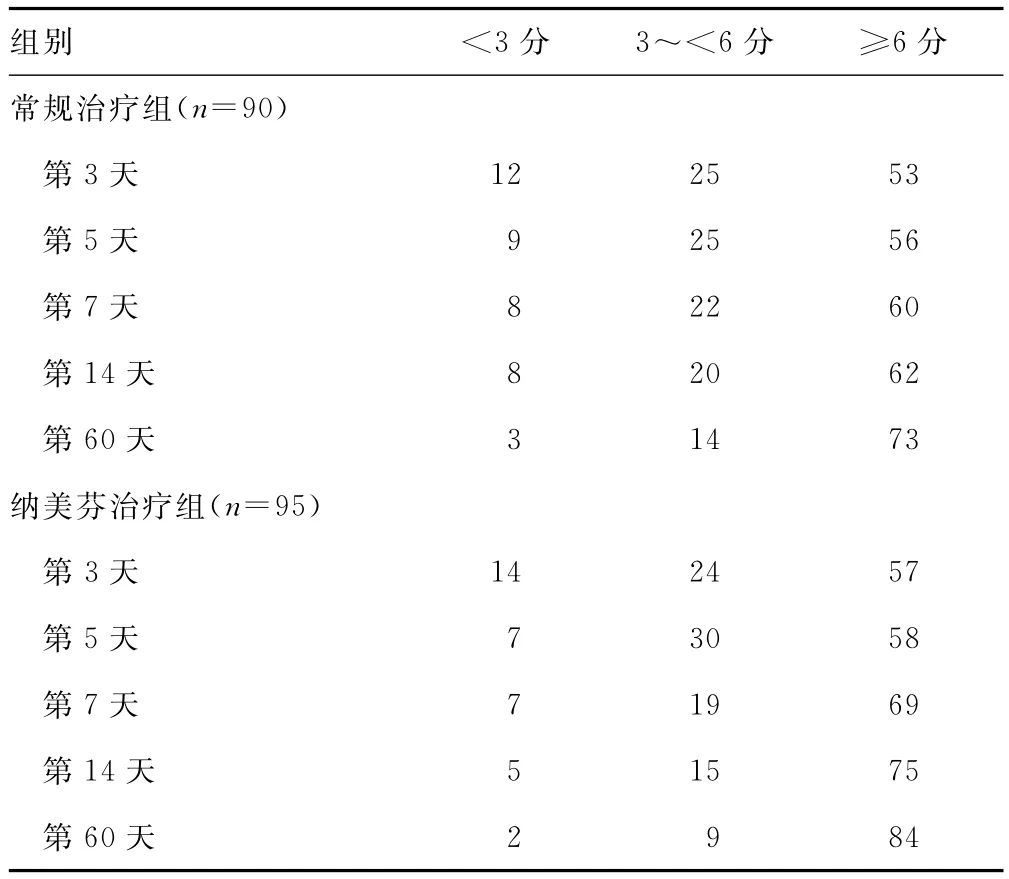
表2 术后常规治疗组及纳美芬治疗组患者GCS评分的比较(n)

表3 术后常规治疗组及纳美芬治疗组患者累计意识等级上升情况的比较(GCS评分,n)
2.3 患者术后神经功能改善情况的比较 根据Barthel指数评分结果,术后纳美芬治疗组患者神经功能的改善情况均优于常规治疗组。在术后第14天和术后第60天,纳美芬治疗组患者神经功能的改善尤为明显,两组比较,差异有统计学意义(P<0.05),见表4。
2.4 患者术后远期预后的评价 随访患者90d后,73.68%(70/95)的纳美芬治疗组患者KPS评分不低于70分,而常规治疗组患者为54.44%(49/90),纳美芬治疗组患者的远期预后显著优于常规治疗组(P<0.05)。
3 讨 论
应激或应激反应是机体对环境中有害刺激,如麻醉、感染、中毒、创伤、恐惧等作出的一系列生理功能反应[5],以交感神经-肾上腺髓质系统兴奋和下丘脑-垂体-肾上腺皮质分泌增多为主。手术是一种创伤性刺激,术后一段时间内患者会表现出应激激素(如儿茶酚胺类激素、胰高血糖素等)的分泌增加[6],患者血浆皮质醇、ACTH、葡萄糖浓度发生变化。有研究表明[7],创伤性应激引起肾上腺皮质激素含量增加后可促进胃酸、胃蛋白酶分泌,而抑制胃碱性黏液分泌,从而导致应激性胃溃疡。创伤会引起垂体ACTH分泌增多[8],皮质醇含量也会随之上升,这是对机体的保护机制[9]。但是,如果手术刺激引起的应激反应太强,对患者本身的恢复是不利的[1],特别是颅脑手术创伤导致的应激,会对患者的预后产生不良影响[10-11]。控制术后疼痛时间与强度能够显著降低患者体内促炎性细胞因子水平,如白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)和缩血管物质内皮素-1的产生,能降低应激导致的继发性颅脑损伤[12]。
有研究表明,皮质醇、ACTH联合评价较二者单独评价能更好地判断下丘脑-垂体-肾上腺皮质功能[13]。通过检查血浆葡萄糖浓度可间接反映升高血糖的激素(如皮质醇、胰高血糖素)水平。研究发现,在重症监护病房中,应激性高血糖的发生率为43%~51%[14],应激性高血糖能显著增加患者的病死率[15],故皮质醇、ACTH、葡萄糖这三者都能作为判断患者术后应激水平的指标[16]。本研究就是通过血浆皮质醇、ACTH水平来反映应激水平的高低,用血浆葡萄糖浓度来判断体内升高血糖激素的水平。
纳美芬在临床上应用十分广泛,如抗休克、昏迷复苏、脑保护等,是一种新型阿片类受体拮抗剂。研究证明它在颅脑损伤中对脑组织有保护作用[17-20]。与传统阿片类受体拮抗剂——纳诺酮比较,纳美芬对神经的保护作用更持久,能显著降低颅脑损伤患者的休克率和病死率[21]。其可能的机制是减少阿片类受体信号的传导,降低神经系统的兴奋性,从而使垂体分泌的应激性激素降低,并降低因应激所致昏迷、休克等病理状态的损害作用,有利于患者的术后恢复。手术创伤对患者来说是一强烈刺激,可导致机体产生应激反应。本研究通过研究颅脑手术后患者的应激程度、应激反应水平的下降速度以及患者预后,发现术后应用纳美芬能使患者的应激状态迅速降低,并显著改善患者的预后。
颅脑手术引起的颅脑损伤是不可避免的,术后如何降低患者的应激对患者的康复和预后有重要的意义,本研究分析纳美芬治疗后患者体内的应激水平和神经功能恢复的短期状况和长期水平,结果发现,接受颅脑手术的患者血浆皮质醇、ACTH、葡萄糖水平都明显上升,接受纳美芬治疗的患者血浆皮质醇、ACTH、葡萄糖在术后大约1周内恢复到正常水平,这与患者体内的应激水平有关。与孙石平等[16]的研究结果相吻合的是,纳美芬治疗组患者血浆皮质醇、ACTH、葡萄糖恢复到正常水平的速率比对照组快。术后第6天,纳美芬治疗组患者的皮质醇、ACTH、葡萄糖浓度与对照组的差异无统计学意义,而常规治疗组患者的皮质醇、ACTH、葡萄糖浓度明显高于治疗组,提示此时患者体内的应激状态比较高。
通过GCS评分来分析患者意识改善状态,结果发现使用纳美芬治疗的患者意识等级上升情况明显优于未使用纳美芬的患者。Barthel指数评分也表明在术后第14天和术后第60天,纳美芬治疗组患者的神经功能改善显著优于常规治疗组。KPS评分提示纳美芬治疗组患者的远期预后显著优于常规治疗组。
综上所述,纳美芬作为一种阿片类受体拮抗剂,在脑肿瘤术后的大脑保护以及预后中具有积极作用,能快速降低患者的应激水平。今后,还需进一步开展对该药物在调节机体应激状态中作用的研究,为其在临床脑损伤和术后的应用奠定基础。
[1]Rodrigues SM,LeDoux JE,Sapolsky RM.The influence of stress hormones on fear circuitry[J].Annu Rev Neurosci,2009,32:289-313.
[2]Chen CJ,Cheng FC,Liao SL,et al.Effects of naloxone on lactate,pyruvate metabolism and antioxidant enzyme activity in rat cerebral ischemia/reperfusion[J].Neurosci Lett,2000,287(2):113-116.
[3]Raymond CC,Cristina R,Richard EG,et al.A novel effect of an opioid receptor antagonist,naloxone,on the production of reactive Oxygen species by microglia:a study by electron paramagnetic resonance spectroscopy[J].Brain Res,2000,854(1â):224-229.
[4]胡枢坤,黄峰平,郑康.纳美芬对脑肿瘤术后的脑保护作用[J].国际神经病学神经外科杂志,2011,38(4):319-322.
[5]庄心良,曾因明,陈伯銮.现代麻醉学[M].3版.北京:人民卫生出版社,2008.
[6]刘云会,刘永吉,王世宾,等.急性重症脑外伤患者血浆儿茶酚胺含量变化的临床意义[J].中华神经外科杂志,1990,6(3):10-14.
[7]邓响潮,李燕舞,王汝俊.应激性溃疡的发生机制及防治研究[J].中国现代药物应用,2008,2(6):3-5.
[8]麦建章,梁干雄,全华斌,等.颅脑损伤血浆皮质醇水平与应激性溃疡出血的相关性探讨[J].中国现代医学杂志,2002,12(6):22-24.
[9]Driscoll P,Escorihuela RM,Fernández-Teruel A,et al.Genetic selection and differential stress responses.The Roman lines/strains of rats[J].Ann N Y Acad Sci,1998,851:501-510.
[10]叶铁虎,龚志毅,金永芳,等.异丙酚、咪唑安定用于静脉麻醉的比较[J].中华麻醉学杂志,1996,16(1):133.
[11]王珊娟,杭燕南,许灿然.100例后颅窝手术的麻醉体会[J].临床麻醉学杂志,1999,15(3):40-41.
[12]马薇涛,李红英,于卫,等.帕瑞昔布对神经外科经蝶入路术后疼痛和机体应激相关细胞因子的影响[J].实用医学杂志,2011,27(11):2034-2036.
[13]Tanriverdi F,Senyurek H,Unluhizarci K,et al.High risk of hypopituitarism after traumatic brain injury:aprospective investigation of anterior pituitary function in the acute phase and 12months after trauma[J].J Clin Endocrinol Metab,2006,91(6):2105-2111.
[14]Van den Berghe G,Wouters PJ,Bouillon R,et al.Outcome benefit of intensive insulin therapy in the critically ill:insulin dose versus glycemic control[J].Crit Care Med,2003,31(2):359-366.
[15]郭延召,许樟荣.应激性高血糖的临床研究进展[J].中华老年多器官疾病杂志,2011,10(4):293-296.
[16]孙石平,朱涛,余云湖,等.重型颅脑创伤患者血清COR、ACTH及血糖的变化[J].中华神经外科疾病研究杂志,2011,10(5):404-407.
[17]Sharma HS,Patnaik R,Patnaik S,et al.Antibodies to dynorphin a(1-17)attenuate closed head injury induced bloodbrain barrier disruption,brain edema formation and brainpathology in the rat[J].Acta Neurochir Suppl,2010,106:301-306.
[18]Clark WM,Coull BM,Karukin M,et al.Randomized trial of cervene,a^I°receptor-selective opioid antagonist,in acute ischemic stroke[J].J Stroke Cerebrovasc Dis,1996,6(1):35-40.
[19]朱海兵,温预关,黄河清.盐酸纳美芬的药理作用及临床应用[J].广州医药,2008,39(4):1-4.
[20]Sharma HS,Nyberg F,Gordh T,et al.Topical application of dynorphin A (1-17)antibodies attenuates neuronal nitric oxide synthase up-regulation,edema formation,and cell injury following focal trauma to the rat spinal cord[J].Acta Neurochir Suppl,2006,96:309-315.
[21]张琳,张骅.盐酸纳美芬的临床应用进展[J].临床肺科杂志,2011,16(3):431.

