AMPK激活对大鼠心肌细胞蛋白降解的影响*
陈保林,陈丹丹,马跃东,熊肇军,刘 晨,4,董吁钢,4
(1.贵州省人民医院心内科,贵州贵阳 550002;2.中山大学附属第一医院心血管医学部,广东广州 510080;3.中山大学附属第三医院心内科,广东广州 510630;4.卫生部辅助循环重点实验室,广东广州 510080)
单磷酸腺苷(adenosine monophosphate,AMP)激活蛋白激酶(AMP-activated protein kinase,AMPK)是真核细胞生物中一个重要的丝氨酸/苏氨酸蛋白激酶[1]。在运动、缺血、缺氧等情况下,细胞内AMP/ATP比值显著升高时,AMPKα亚基的Thr172残基发生磷酸化修饰后激活而具有生物活性[2]。AMPK的下游靶蛋白主要与糖、脂以及蛋白质等能量代谢调节有关[3-4]。有研究表明AMPK在平滑肌中参与了蛋白质降解的调控[5],然而,AMPK是否参与心肌细胞蛋白质降解的调控,国内、外尚无相关报道。
3-甲基组氨酸(3-methylhistidine,3-MH)是存在于肌动蛋白和肌球蛋白中的一类转录后修饰的氨基酸[6-7]。由于缺乏特异性的tRNA,肌肉蛋白质在分解代谢时释放的3-MH不能作为tRNA的底物参与新蛋白质的合成,因此,3-MH被认为是肌细胞蛋白质降解的生物学标志[8-9]。通过测定心肌细胞培养基中3-MH的浓度能够反应心肌细胞肌纤维蛋白的降解率。本研究通过观察AMPK激动剂5-氨基咪唑-4-甲酰胺-1-β-D-呋喃核糖苷(5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside,AICAR)对培养心肌细胞3-MH释放率的影响,旨在探讨AMPK在调控心肌细胞蛋白质分解代谢中的可能作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 出生1~3d的Sprague-Dawley(SD)大鼠,清洁级,由中山大学实验动物中心提供。本实验通过动物伦理委员会许可。
1.1.2 主要试剂及仪器 Dulbecco′s改良Eagle培养基(Dulbecco′s modified Eagle′s medium,DMEM)/F12培养基、胎牛血清为美国HyClone公司产品,Ⅰ型胶原酶、胰蛋白酶购自美国 Gibco公司,AICAR、兔抗大鼠p-AMPK-α(Thr172)抗体、兔抗大鼠 AMPK-α抗体购自美国Cell Signaling(CST)公司,AMPK抑制剂Compound C为德国Merck公司产品,小鼠抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)抗体购自上海康成生物工程有限公司,小鼠抗大鼠α-actinin抗体、羊抗小鼠IgG-辣根过氧化物酶(horseradish peroxidase,HRP)以及羊抗兔IgG-HRP购自武汉博士德生物工程有限公司,免疫印迹发光试剂盒为美国Millipore公司产品,3-MH标准品购自美国Sigma公司,色谱纯甲醇为美国TEDIA公司产品。主要仪器包括:显微成像分析系统(日本OLYMPUS公司)、电泳系统(美国BIO-RAD公司)、LC-20A高效液相色谱仪(日本岛津公司)、C18色谱柱(250mm×4.6mm,5μm,日本GL Sciences公司)等。
1.2 方法
1.2.1 原代心肌细胞培养 在超净工作台内,无菌条件下取出乳鼠心脏,洗净后将心室心肌组织剪碎成约1mm3大小,先后用0.05%Ⅰ型胶原酶和0.125% 胰蛋白酶消化,收集心肌细胞悬液至含10% 胎牛血清的培养基中,置于37℃,含5%CO2的培养箱内培养60min,差速贴壁法去除成纤维细胞,重悬的心肌细胞以5×105/mL的密度接种于6孔板,再放入5%CO2的培养箱内培养。待培养后细胞生长融合成片并出现同步收缩,换成无血清的培养基,饥饿24h后进行分组干预[10-11]。
1.2.2 心肌细胞的免疫化学染色鉴定 制作心肌细胞爬片,用4%多聚甲醛固定;再以3%H2O2孵育10min;滴加非免疫动物血清孵育10min;再滴加α-actinin第一抗体(1∶200)4℃过夜。次日加生物素标记的第二抗体,室温下孵育20min后滴加链霉素抗生物素蛋白-过氧化物酶,10min后二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,镜下观察。
1.2.3 心肌细胞的分组及总蛋白质的提取 为观察AMPK特异性激动剂AICAR和AMPK抑制剂Compound C对AMPK蛋白表达以及磷酸化活性的影响,将心肌细胞按处理方式分为:对照组(未进行特殊处理)、AICAR组(培养基含AICAR 1mmol/L)、Compound C组(培养基含 Compound C 1μmol/L)及 AICAR+Compound C 组(培养基含 AICAR 1mmol/L及Compound C 1μmol/L)。干预6h后提取总蛋白,采用Bradford法计算出样品总蛋白浓度(μg/μL)。
1.2.4 Western blot检测 各取50μg样品蛋白进行8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后蛋白转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上(80V,120min),5%脱脂奶粉封闭1h,分别加入第一抗体工作液中,p-AMPK-α兔抗大鼠(1∶1 000)、AMPK-α兔抗大鼠(1∶1 000)、GADPH小鼠抗大鼠 (1∶20 000),4℃孵育过夜;次日PVDF膜再分别与HRP标记的羊抗兔或羊抗小鼠第二抗体室温下孵育1h;免疫印迹用增强化学发光法(enhanced chemiluminecence,ECL)显影、曝光,采用IPP 6.0图像分析软件检测。以GAPDH作为内参,以灰度比值表示所检测蛋白质的相对含量,实验重复4次。
1.2.5 高效液相色谱仪检测心肌细胞3-HT释放量 参照课题组以前介绍的方法[11],取0.5mL心肌细胞培养基加入100μL乙腈萃取。取100uL上清液加入100μL衍生化试剂和1mL硼酸缓冲液中(0.4mol/L),用0.22μm的针头过滤器过滤后立即进样20μL分析。用3-MH标准品准确配成一定浓度的标准液,将5个梯度体积的标准液制作标准曲线。将样品中3-MH的峰面积带入,计算出其含量。
1.3 统计学处理 采用SPSS15.0统计软件包进行统计学处理。计量资料用表示,组间比较采用单因素方差分析(one-way ANOVA),各组两两比较采用Student Newman Keul′s(SNK)检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 心肌细胞的鉴定及纯度 显微镜下观察,体外培养的心肌细胞展开,80%以上融合成片,呈同步收缩。α-actinin免疫细胞化学染色显示,阳性率大于99%,培养48h后的心肌细胞达到实验要求。
2.2 AICAR对心肌细胞AMPK活性的影响 AICAR干预细胞6h后,各组心肌细胞总AMPK的表达无明显差异,对照组、AICAR组、Compound C组及AICAR+Compound C组心肌细胞p-AMPK/AMPK的灰度比值分别为:0.47±0.034、0.83±0.07、0.32±0.03及0.62±0.05。Western blot结果显示,与对照组比较,AICAR组心肌细胞p-AMPK/AMPK灰度比值增高(P<0.05),Compound C组心肌细胞p-AMPK/AMPK灰度比值降低(P<0.05),提示AICAR激活心肌细胞AMPK,而Compound C则抑制AMPK激活;与AICAR组与比较,Compound C+AICAR组p-AMPK/AMPK灰度比值降低(P<0.05),提示Compound C逆转了AICAR对心肌细胞AMPK的激活作用。见图1。
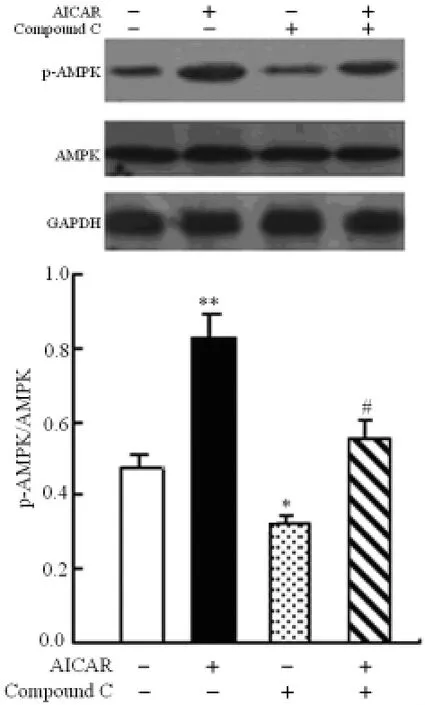
图1 AICAR对AMPK磷酸化激活的影响
2.3 AMPK活性对心肌细胞蛋白降解的影响 以3-MH的色谱峰面积(Y)为纵坐标,浓度(X)为横坐标,利用不同浓度的3-MH标准品与各自对应的峰面积建立回归方程:Y=731 241 X+896.86,相关系数r=0.999 8,在1.6μmo/L至107μmo/L的浓度范围内3-MH浓度与峰面积线性关系良好。本实验中所检测的培养基中,3-MH浓度在4.8~68.3μmo/L范围。研究结果显示,与对照组比较,AICAR明显促进细胞蛋白降解(P<0.01),Compound C能够抑制心肌细胞蛋白降解(P<0.01);Compound C还逆转了AICAR对蛋白降解的促进作用(P<0.01)。见图2。
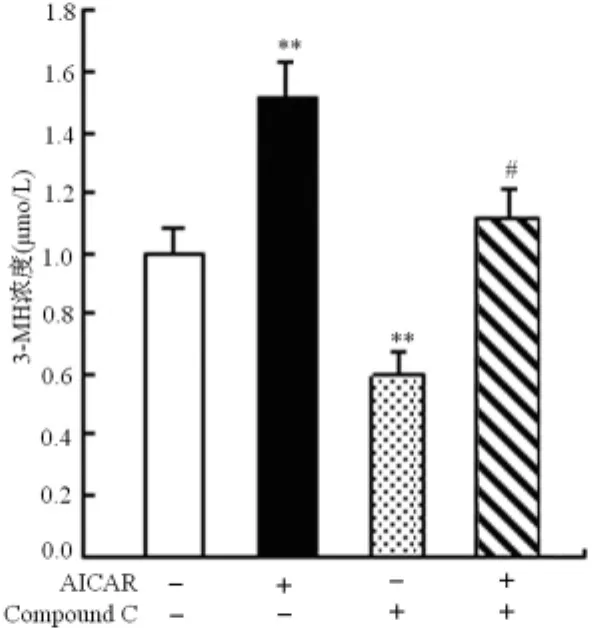
图2 AICAR对心肌细胞3-MH释放量的影响
3 讨 论
AMPK是由一个相对分子质量为63×103的α亚基,一个相对分子质量为43×103的β亚基以及一个相对分子质量为38×103的γ亚基组成的异源三聚体[1],是能量代谢的重要调节酶,对调控细胞的生长,增殖有重要作用[12]。作为机体能量调节器,AMPK能对心肌细胞内AMP/ATP比例变化反应迅速。在缺血、缺氧、葡萄糖缺乏、饥饿等情况下,心肌组织能量缺乏,AMP/ATP比例增加,继而AMPK磷酸化激活。AMPK激活后通过调控代谢相关酶发挥能量代谢的调控作用[13-14],如AMPK磷酸化激活乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)后增加脂肪酸的摄取和氧化;促进葡萄糖转移酶4加速葡萄糖的摄取,刺激糖酵解,增加ATP生成;同时为了保存细胞内ATP水平,抑制蛋白质以及脂质合成,使细胞耗能活动减弱。以上这些调节反应使心肌细胞得以保持ATP的水平,有助于维持心肌细胞的功能。而蛋白质降解也是能量缺乏时机体反应的一部分,AMPK是否参与心肌细胞蛋白质降解的调控尚不清楚。本研究中,通过AMPK激动剂AICAR和抑制剂Compound C干预离体培养的心肌细胞,并应用高效液相色谱法检测心肌细胞培养基中3-MH释放量,发现AMPK激活后3-MH释放明显增加,而抑制AMPK活性后3-MH释放显著减少,以上结果提示AMPK能够促进3-MH释放,参与心肌细胞蛋白质降解的调控。
与其他组织、器官一样,心肌细胞的蛋白质合成与降解之间有序的动态平衡受到严密调控。蛋白转换同时存在于心肌细胞肥大和萎缩这两种不同的病理过程中,只是合成与分解的相对比例不同[15]。心肌肥大和萎缩的本质是细胞内肌纤维蛋白量增减,因此,对心肌细胞肌纤维蛋白降解的检测将有助于寻找有效逆转心肌肥大的药物以及客观评价逆转肥大药物的治疗效果。本研究结果发现,作为心肌细胞能量代谢重要调节酶的AMPK不仅调控心肌细胞葡萄糖和脂肪代谢,还参与蛋白降解的调控,提示其可能是心肌细胞肥大的治疗靶点,为今后AMPK激活逆转心肌细胞肥大的治疗提供理论依据。然而,这需要通过构建心肌细胞肥大模型来进一步论证。此外,AMPK是一个蛋白激酶,并没有水解功能,其如何调控蛋白降解也需要进一步探讨。
[1]Arad M,Seidman CE,Seidman JG.AMP-activated protein kinase in the heart:role during health and disease[J].Circ Res,2007,100(4):474-488.
[2]Heidrich F,Schotola H,Popov AF,et al.AMPK-activated protein kinase and its role in energy metabolism of the heart[J].Curr Cardiol Rev,2010,6(4):337-342.
[3]Kahn BB,Alquier T,Carling D,et al.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metab,2005,1(1):15-25.
[4]Song P,Zou MH.Regulation of NAD(P)H oxidases by AMPK in cardiovascular systems[J].Free Radic Biol Med,2012,52(9):1607-1619.
[5]Tong JF,Yan X,Zhu MJ,et al.AMP-activated protein kinase enhances the expression of muscle-specific ubiquitin ligases despite its activation of IGF-1/Akt signaling in C2C12myotubes[J].J Cell Biochem,2009,108(2):458-468.
[6]Wassner SJ,Schlitzer JL,Li JB.A rapid,sensitive method for the determination of 3-methylhistidine levels in urine and plasma using high-pressure liquid chromatography[J].Anal Biochem,1980,104(2):284-289.
[7]Houweling M,van der Drift SG,Jorritsma R,et al.Technical note:quantification of plasma 1-and 3-methylhistidine in dairy cows by high-performance liquid chromatography-tandem mass spectrometry[J].J Dairy Sci,2012,95(6):3125-3130.
[8]Thompson MG,Thom A,Partridge K,et al.Stimulation of myofibrillar protein degradation and expression of mRNA encoding the ubiquitin-proteasome system in C(2)C(12)myotubes by dexamethasone:effect of the proteasome inhibitor MG-132[J].J Cell Physiol,1999,181(3):455-461.
[9]Aranibar N,Vassallo JD,Rathmacher J,et al.Identification of 1-and 3-methylhistidine as biomarkers of skeletal muscle toxicity by nuclear magnetic resonance-based metabolic profiling[J].Anal Biochem,2011,410(1):84-91.
[10]Chen BL,Ma YD,Meng RS,et al.Activation of AMPK inhibits cardiomyocyte hypertrophy by modulating of the FOXO1/MuRF1signaling pathway in vitro[J].Acta Pharmacol Sin,2010,31(7):798-804.
[11]陈保林,马跃东,熊肇军,等.高效液相色谱法检测心肌细胞蛋白降解率[J].重庆医学,2011,40(22):2234-2235.
[12]Ahluwalia A,Tarnawski AS.Activation of the metabolic sensor-AMP activated protein kinase reverses impairment of angiogenesis in aging myocardial micro-vascular endothelial cells.Implications for the aging heart[J].J Physiol Pharmacol,2011,62(5):583-587.
[13]Wang S,Song P,Zou MH.AMP-activated protein kinase,stress responses and cardiovascular diseases[J].Clin Sci(Lond),2012,122(12):555-573.
[14]Dailey MJ,Kim S.Inositol polyphosphate multikinase:anemerging player for the central action of AMP-activated protein kinase[J].Biochem Biophys Res Commun,2012,421(1):1-3.
[15]Razeghi P,Taegtmeyer H.Cardiac remodeling:UPS lost in transit[J].Circ Res,2005,97(10):964-966.

