伽马射线体外照射对细粒棘球蚴原头节的杀灭作用
袁 庆,李 波,贺 凯,张孟瑜,多 吉,陈 川,李 兴,向证文
棘球蚴病(echinococcosis)即包虫病(hydatidosis),是一种危害严重的人兽共患寄生虫病,由细粒棘球绦虫的幼虫(称棘球蚴或包虫)寄生于人或其他动物体内引起。细粒棘球蚴原头节(echinococcus protosclex)是人类包虫病发病的一个中心环节,它即可在犬类肠道内发育成成虫通过有性繁殖,产生虫卵,经粪-口途径感染人类。又可因棘球蚴病人术中囊液外溢或外伤导致棘球蚴破裂,原头节在腹腔内广泛种植。由于目前没有药物能有效杀灭原头节[1-5],因 此 它 既 是 影 响 手 术 治 疗 预 后 的 重 要 因素[6-8],也 是 囊 性 包 虫 病 预 防 和 研 究 的 重 要 一环[9-10]。本文拟在体外培养的条件下,用不同剂量的γ-射线对其进行照射,探索伽马射线治疗包虫病的可能性。
1 材料与方法
1.1 材料
1.1.1 细粒棘球蚴原头节 细粒棘球蚴原头节在四川省人民医院肝包虫手术中采集完整包虫囊肿,保存于4℃冰盒送入实验室。将肝包虫囊肿置于超净工作台上消毒表面后,用50mL注射器穿刺抽取囊液,采取反复吹打法,确保依附于内囊壁的原头节完全被采集。抽净囊液后剪开囊壁,用生理盐水冲洗内囊表面,将冲洗液与囊液一同收集备用。用离心机以3 000r/min×5min得到黄白色囊砂,倒去上清液后用冲洗液,冲洗3次。向囊砂内滴加20%胰蛋白酶溶液1mL,静置20min以融化其中的组织碎屑,获得的原头节悬液备用。
1.1.2 试剂 ①RPMI-1640培养液:赛默飞世尔生物化学制品(北京)有限公司;②胎牛血清:赛默飞世尔生物化学制品(北京)有限公司;③青-链霉素溶液:赛默飞世尔生物化学制品(北京)有限公司;④美兰溶液:赛默飞世尔生物化学制品(北京)有限公司;⑤胰蛋白酶溶液:赛默飞世尔生物化学制品(北京)有限公司;⑥caspase-3蛋白酶检测试剂盒:⑦广州健仑生物科技有限公司。
1.2 方法
1.2.1 原头节的孵育 原头节悬液内加入10mL RPMI-1640培养液,取0.2mL溶液滴在载玻片上置于倒置显微镜下以计数后,加入20%美兰溶液,观察原头节的存活率。将原头节以2 000个/mL的密度培养于含20%胎牛血清的RPMI-1640培养液中,置于37℃、5%CO2培养箱中进行孵育。
1.2.2 γ-射线照射 孵育的原头节出现头节外翻现象时,进行γ-射线杀伤试验。将原头节培养液混匀后平均分装入11个培养瓶中,随机分组。其中1组作为对照组,另外10组作为实验组,置于钴-60治疗仪下进行照射。实验组γ-射线照射剂量分别为10Gy、20Gy、40Gy、60Gy、80Gy、100Gy、120 Gy、140Gy、160Gy和180Gy。
1.2.3 观察原头节的死亡率 γ-射线照射后每天用倒置显微镜进行观察,选择10个视野,根据其总数计算原头节死亡率,死亡率=(死亡的原头节/原头节总数)×100%,连续观察直到全部实验组中的原头节全部死亡为止。
1.2.4 检测原头节内caspase-3蛋白活性 γ-射线照射后第12h从每组含原头节的培养液中各收集1 mL培养液进行caspase-3蛋白活性的检测,4℃下将各组含原头节的培养液在3 000r/min×5min后,小心吸出上清液,确保没有吸出原头节,用PBS缓冲液洗涤,加入1μL裂解液,0℃下混匀后裂解15min。4℃离心3 000r/min×10min,去除上清液。加入caspase-3底物(Ac-DEVD-pNA)各10μL 混匀,37℃避光孵育2h,转移至96孔酶标板在405 nm波长处用酶标仪测定caspase-3底物被蛋白酶分解产物的吸光值。
1.2.5 观察原头节显微结构的变化 在γ-射线照射原头节后第1天开始利用倒置显微镜动态观察并全程记录原头节从照射到死亡时间段内结构的的变化情况。
1.3 统计分析方法 采用SPSS17.0统计包,应用趋势χ2检验对每日各组原头节死亡率进行分析,检验水准α=0.05;应用Spearman秩相关检验对各组原头节细胞caspase-3蛋白活性检测值进行分析,检验水准α=0.05。
2 结 果
2.1 原头节孵育 共收集到囊液及冲洗液300 mL。经过处理后美篮染色计数确定原头节存活率为96.5%,原头节总数约1.5×105~1.6×105个。在体外孵育过程中原头节活动活跃(图1),到第3d时原头节出现外翻现象。
2.2 γ-射线对原头节的杀灭情况 在经过γ-射线照射后,100Gy~180Gy的剂量导致原头节出现急性杀伤作用,于2~4d内全部死亡,40Gy~80Gy的剂量在第7d全部死亡,10Gy~20Gy的剂量于9~10d全部死亡原头节中位生存时间的分析中可以看到随着照射剂量的增加原头节中位生存时间逐渐缩短(表1,图2)。
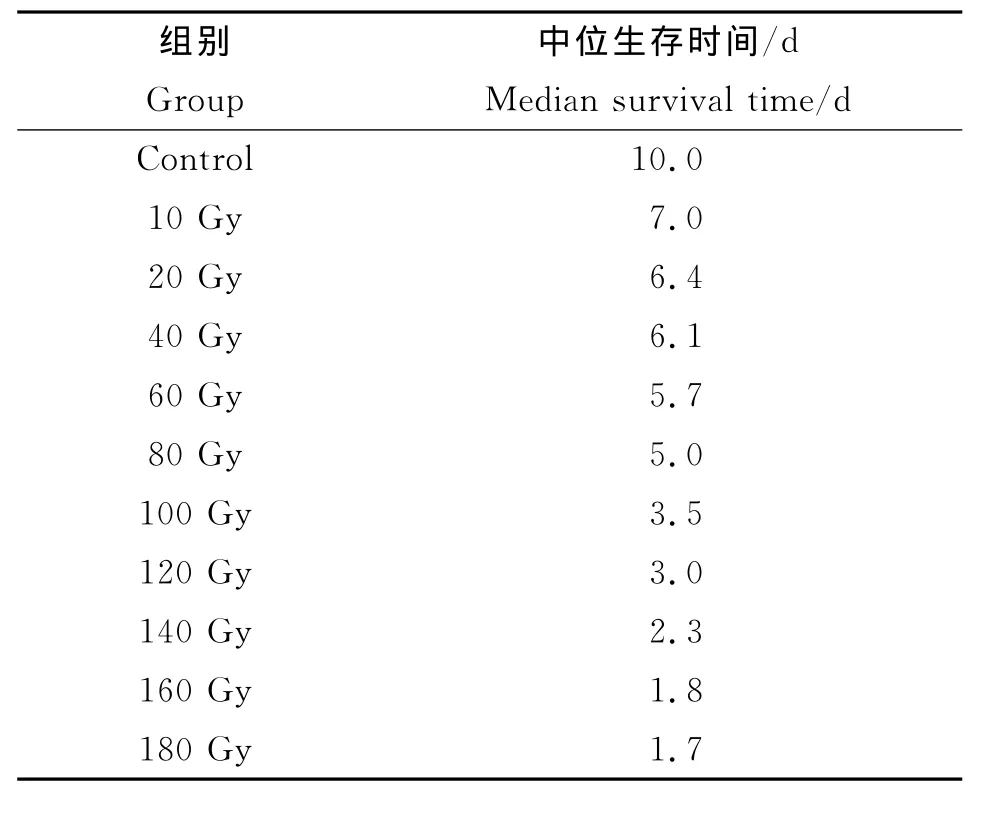
表1 各组原头节中位生存时间Tab.1 Median survival time of protoscoleces in each group
2.3 比较各剂量组之间原头节每日死亡率之间的差别 每日各组原头节死亡率进行趋势χ2检验(表2)发现:随着照射剂量的升高原头节的死亡率增加,其P<0.01。
2.4 原头节细胞内caspase-3蛋白酶活性的变化在对各组原头节细胞内caspase-3蛋白酶值(表3)行spearman秩相关检验发现其相关系数rs=0.986,P<0.001,按α=0.05水准,可以认为原头节细胞内caspase-3蛋白酶值与放射剂量有正相关关系。
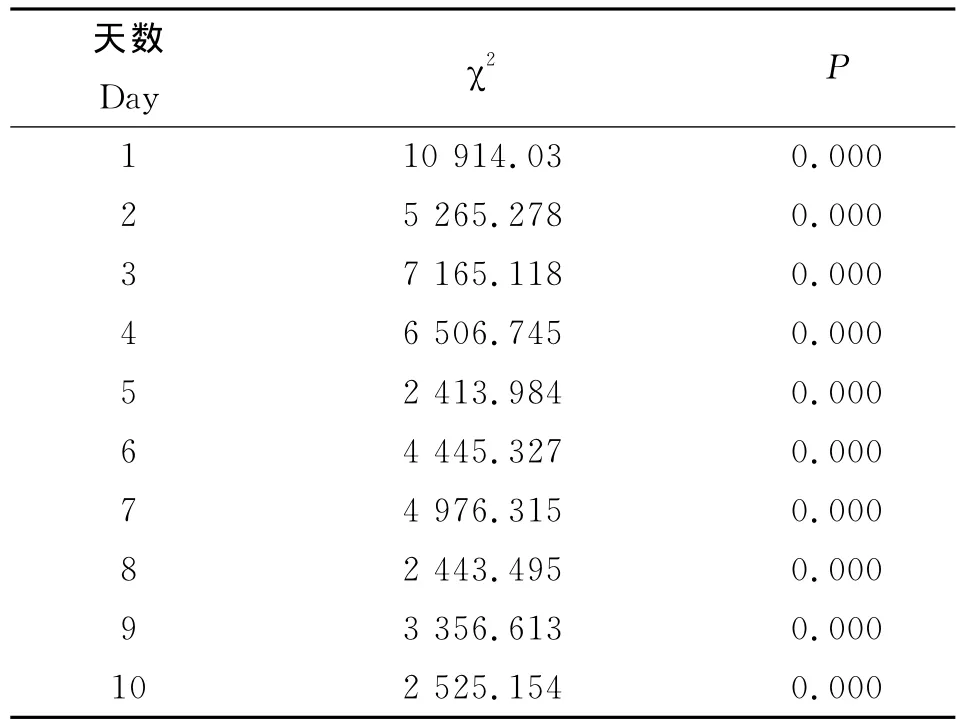
表2 每日各组原头节死亡率趋势χ检验情况Tab.2 Daily tendency of the death incidence of protoscoleces in each group indicated byχ2 test
2.5 照射后原头节形态结构的改变 γ-射线照射后原头节出现3个阶段的变化,第1阶段:原头节整体形态出现肿胀,由最初的椭圆形变化为球形,钙颗粒之间的距离延长,原头节有所增大,活动度明显减弱,头节外翻几乎停止;第2阶段:原头节整体形态出现塌陷,边界出现模糊,小钩脱落,原头节内颜色浑浊,有褐色颗粒样物质沉着,活动度进一步减弱;第3阶段:原头节整体结构破碎(图3)。
图1 原头节活动造成身后形成拖拽痕迹(箭头)(×100)Fig.1 Formation of the drag traces after the protoscoleces activities(indicated by the arrow)(×100)
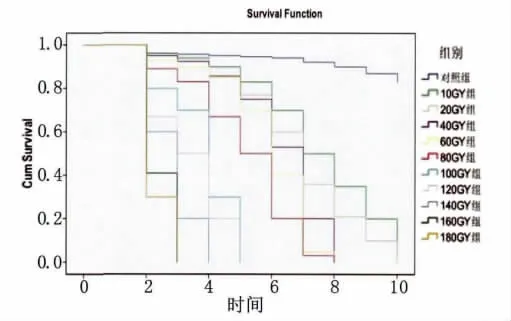
图2 原头节经不同剂量γ-射线照射后的生存曲线Fig.2 Survival curves for protoscoleces treated with different doses of gamma-ray irradiation
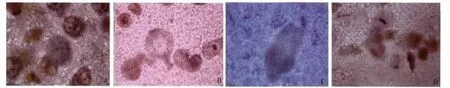
图3 原头节受到γ-射线照射后的变化(×400)A、为照射前原头节结构完整,口器、吸盘结构清晰;B为第一阶段:原头节整体形态出现肿胀,C为第二阶段:原头节整体形态出现塌陷,边界出现模糊,小钩脱落,原头节内颜色浑浊,有褐色颗粒样物质沉着,活动度进一步减弱;D为第三阶段:原头节整体结构破碎。Fig.3 Changes of protoscoleces after the gamma-ray irradiation(× 400)A:Structural integrity of protoscoleces before irradiation,and the clear structure of the mouthparts and the suction cup;B:The first phase-the overall morphology of protoscoleces swells;C:The second stage-the overall morphology of protoscoleces begins to collapse,the border becomes fuzzy,a small hook falls off,the inside color of protoscoleces becomes muddy,brown granular substance appears,and activity further weakens;D:The third stage-the overall structure of protoscoleces breaks up.
3 讨 论
60钴源发射的γ-射线作为一种常用的电离辐射治疗措施具有:穿透力强对皮肤有保护作用骨组织吸收剂量小全身反应小,安全性高、经济可靠的物理特性。已广泛用于颅脑肿瘤、脑血管畸形、肺癌、肝癌等实质脏器及膀胱癌、胃癌、直肠癌等空腔脏器疾病的治疗。其作用机制在于可直接引发生物活性大分子发生电离、激发、化学键断裂,破坏其分子结构,进而影响其功能;并引起水分子的电离和激发,形成高毒、高氧化性的各种自由基,使生物大分子损伤,诱发细胞坏死或凋亡。γ-射线一次窄束大剂量照射后靶组织的损伤与修复可以分为3期:第一期 坏死期 靶点中心呈急性水肿及炎症反应;第二期 吸收期 自坏死后坏死灶的大量细胞碎片已被吸收,胶质细胞修补、填充,形成瘢痕;第三期 一些早期变化如炎症反应已消失,细胞碎片被清除,血管减少,巨核细胞消失,胶质瘢痕形成,提示不可逆性结构性改变。
电离辐射诱发细胞凋亡是一个复杂的生物学网络过程。电离辐射可激活caspase-3,或活化其前体而诱发细胞凋亡[11]。半胱氨酸蛋白酶(Cysteine requiring Aspartate protease;caspase)或称为含半胱氨酸的天冬氨酸蛋白水解酶。是一组存在于细胞质中具有类似结构的蛋白酶。它们的活性位点均包含半胱氨酸残基,能够特异性的切割靶蛋白天冬氨酸残基的肽键。caspase负责选择性的切割某些蛋白质,从而造成细胞凋亡。半胱氨酸蛋白酶-3(caspase-3)是半胱氨酸蛋白酶家族中 CED-3(Cell Death Gene Number 3)分支中的一种,又称半胱氨酸蛋 白 酶-32CPP32(Cysteine Proteinase Protein 32kd)。它在细胞凋亡效应阶段起着核心作用[12-13]。目 前 已 证 实 原 头 节 细 胞 存 在 着 凋 亡 现象[14],而 caspase-3 参 与 了 原 头 节 细 胞 的 凋 亡[15]。在本实验组原头节细胞中caspase-3蛋白酶活性和γ-射线剂量之间存在着量效关系,不仅证明caspase-3参与了原头节细胞的凋亡,也说明原头节细胞是γ-射线诱导凋亡的敏感细胞。
相比细胞凋亡,细胞坏死的机理与之有本质的差别。细胞坏死是在某种强烈刺激条件下发生的一种被动死亡,电离辐射由于基因毒性,在超过一定剂量后可以直接导致细胞坏死。细胞坏死前可发生代谢中止和ATP消耗造成细胞膜钠-钾离子泵抑制[16],细胞的膜通透性增高,致使细胞肿胀,细胞器肿胀变大,最后细胞破裂。薛丽香等[17]认为电离辐射后出现的细胞凋亡与坏死是电离辐射的直接作用所致,即电离辐射通过损伤DNA启动了细胞的凋亡发生;而电离辐射对细胞能量代谢的影响以及细胞膜结构与遗传物质的损伤,加之细胞凋亡后的继发性坏死,则是导致细胞坏死的原因。据此分析,在本实验中γ-射线照射后原头节出现肿胀—塌陷—碎裂,并随照射剂量的增大会更加明显的现象。其原因就在于辐射造成了原头节细胞的坏死,这也与γ-射线照射后靶组织出现的坏死、吸收期表现类似。
综上所述,我们初步判断γ-射线照射可激活原头节细胞caspase-3蛋白酶从而诱发其凋亡,同时由于其基因毒性造成了原头节细胞的坏死。在γ-射线对原头节细胞同时造成的主动死亡和被动死亡的作用下,直接的结果就是原头节的死亡。
目前国内外对于棘球蚴病的治疗方式主要包括手术治疗和药物治疗两种形式,但是手术治疗后出现残腔感染、残腔出血、残腔胆汁漏、钙化残腔不闭合、术后黄疸、过敏性休克、残腔原位复发等并发症,发生率可达到10.8%~65.8%[18]以阿苯达唑为代表的药物治疗中,不论是阿苯达唑还是其脂质体其治愈率仅为30%左右[19]。棘球蚴病治疗中一个重要的难点就在于没有一种确实有效的方法杀灭体内的原头节。在经过本次试验后,可以认为γ-射线体外照射可以诱导原头节细胞凋亡,造成原头节细胞坏死,并杀灭原头节。相信γ-射线将会成为一种治疗细粒棘球蚴的新手段。有关γ-射线治疗棘球蚴病的适合剂量尚需要进一步的研究。
[1]Bao GS.In vitro observation on albendazole sulfoxide and its enantiomers against Echinococcus granulosus protoscolex[J].Chin J Parasitol Parasit Dis,2008,26(6):459-461.(in Chinese)包根书.阿苯达唑亚砜及其对映体体外抗细粒棘球绦虫原头蚴作用[J].中国寄生虫学与寄生虫病杂志,2008,26(6):459-461.
[2]Kang JF,Hu HH,Baishan BK,etal.In vitro observation on the apoptosis induced by hydrogen peroxide in protoscolex of E-chinococcus granulosus[J].Chin J Parasitol Parasit Dis,2008,26(5):332-337.(in Chinese)康金风,胡汉华,白山别克,等.过氧化氢体外诱导细粒棘球蚴原头节细胞凋亡的实验观察[J].中国寄生虫学与寄生虫病杂志,2008,26(5):332-337.
[3]Lv HL,Peng XY,Zhang SJ,etal.Effect of the liposome albendazole and Huai-Er fungus extract on hepatic infestation of Echinococcus granulosus in mice[J].Chin J Parasitol Parasit Dis,2008,26(5):361-365.(in Chinese)吕海龙,彭心宇,张士杰,等.阿苯达唑脂质体及槐耳浸膏对小鼠肝细粒棘球蚴感染率影响的实验观察[J].中国寄生虫学与寄生虫病杂志,2008,26(5):361-365.
[4]Adas G,Arikan S,Kemik O,etal.Use of albendazole sulfoxide,albendazole Sulfone,and combined solutions as scolicidal agents on hydatidcysts (in vitro study)[J].World J Gastroenterol,2009,15(1):112-116.
[5]Jiang S,Jia B,Chen LX,etal.Comparative observation on pathology of albendazole and its liposomes treating hepatic hydatidosis of sheep[J].Heilongjiang Anim Sci Vet Med,2009,10(1):82-83.(in Chinese)蒋松,贾斌,陈玲香.阿苯达唑及其脂质体治疗羊肝包虫病的病理学比较观察[J].黑龙江畜牧兽医,2009,10(1):82-83.
[6]Lv X,Li XS.Current conditions and prospects of laparoscopic treatment of hepatic hydatid cysts[J].Chin J Laparoscopic Surg,2010,3(1):36-37.(in Chinese)吕西,李徐生.腹腔镜治疗肝包虫的现状及展望[J].中华腹腔镜外科杂志,2010,3(1):36-37.
[7]Gollackner B,Langle F,Aner H,etal.Radical surgical therapy of abdominal cystic hydatid disease[J].Factors Recurrence,2000,24(3):717-721.
[8]Uhl WLoftier HZimmer mann Aetal.Surgical treatment of echinococcosis ofthe liver[J].Swiss Surg,1999,5(1):126-132.
[9]Colebrook AL,Jenkins DJ,Jones MK,etal.Effect of cyclosporin A on the survival and ultrastructure of Echinococcus granulosus protoscoleces invitro[J].Parasitology,2004,129(4):497-504.
[10]Puryan K,Karadayi K,Topcu O,et a1.Chlorhexidine gluconate:an ideal seolicidal agent in the treatment of intraperitoneal hydatidosis[J].World J Surg,2005,29(2):227-230.
[11]Yuan J,Shaham S,Le doux S,etal.The C.elegans cell death gene ced-3encodes a protein similar to mammalin interleukin Ibeta converting enzyme[J].Cell,1993,75(4):641-652.
[12]Liu XY,Liu JJ.Caspas and apoptosis[J].Med J Wuhan Univ,2004,25(6):742-744.(in Chinese)刘晓翌,刘建军.Caspase与细胞凋亡[J].武汉大学学报:医学版,2004,25(6):742-744.
[13]Chu GM.Activation routes and regulation mechanism of Caspase[J].Shaanxi Med J,2004,33(9):809-811.(in Chinese)楚广民.Caspase激活途径及调控机制[J].陕西医学杂志,2004,33(9):809-811.
[14]Wang X,Wang XH,Bao GS,etal.Experimental study on radiation therapy for hydatidosis[J].Chin J Zoonoses,2009,25(7):653-656.(in Chinese)王欣,王小虎,包根书,等.放射线治疗包虫病的实验研究[J].中国人兽共患病学报,2009,25(7):653-656.
[15]Hu HHKang JFChen Retal.Effect of cell caspase-3expression and ultrastructure of Echinococcus granulosus protoscolex induced by hydrogen peroxide in vitro[J].Chin J Zoonoses,2009,25(4):318-321.(in Chinese)胡汉华,康金凤,陈蓉,等.过氧化氢体外诱导细粒棘球蚴原头节细胞caspase-3表达及超微结构的影响[J].中国人兽共患病学报,2009,25(4):318-321.
[16]Majno G,Joris I.Apoptosis,oncosis,and necrosis.An overview of cell death[J].Am J Pathol,1995,146(1):3-15.
[17]Xue LX,Jin GH,Fu SB,etal.Effect of ionizing radiation on EL-4apoptosis and necrocytosis[J].Chin J Radiol Med Prot,2001,21(1):24-26.(in Chinese)薛丽香,金光辉,付士波,等.电离辐射对EL-4细胞凋亡与坏死的影响[J].中华放射医学与防护杂志,2001,21(1):24-26.
[18]Peng XY.Surgery complications of hepatic hydatid cysts[M].Beijing:People’s Health Publishing House,2000:439-651.(in Chinese)彭小宇.肝包虫的外科手术并发症[M].北京:人民卫生出版社,2000:439-651.
[19]Li HT,Ke S,Wen H,etal.Observation on efficiency of human hydatidosis treated by liposomal albendazole in 66cases[J].Endem Dis Bull,2004,19(1):16-19.(in Chinese)李海涛,柯山,温浩,等.阿苯达唑脂质体治疗66例人体包虫病的疗效观察[J].地方病通报,2004,19(1):16-19.

