云南大理地区恙虫病血清学诊断及病原体基因序列分析
亚红祥,王静林
恙虫病(tsutsugamushi disease)又称丛林斑疹伤寒(scrub typhus),是由恙虫病东方体(Oreintia tsutsugamushi,Ot)引起的急性传染病,该病常引起多器官损害,临床表现复杂多变,容易误诊[1]。云南为恙虫病的主要流行省份,近年恙虫病病例增多[2]。国际上恙虫病已被认为是威胁旅游健康的重要传染病之一,随着云南生态旅游的日益发展,该病已成为我省一个重要的公共卫生问题。为了明确我省恙虫病病原体的类型,我们应用血清学方法对云南大理地区恙虫病病例进行血清学诊断,并对病原体做基因序列分析。
1 材料与方法
1.1 材料 2010年2月—12月收集到当地各医疗机构送检的云南大理地区不明原因持续发热≥3天的病人血液19份,每份样本取一部分全血进行低速离心分离血清用于血清抗体检测,另一部分全血用于核酸提取。
1.2 方法
1.2.1 间接免疫荧光试验(IFA)用PBS从1∶20开始对被检样本血清作系列稀释至1∶320,将各稀释度血清分别加到Ot Karp型和Kato型抗原片(中国疾病预防控制中心传染病预防控制所提供)孔内,放入湿盒置37℃孵育45min,用PBS洗片3次,每次1~2min,吹干,加入荧光素标记的羊抗人IgG抗体(KPL公司),放入湿盒置37℃孵育30min,用PBS洗片3次,每次1~2min,吹干,用Nikon荧光显微镜观察结果。荧光明亮,呈黄绿色,病原体均匀分布,即可判定该滴度为阳性。
1.2.2 巢式PCR(nPCR)检测 用 QIAGEN 公司DNA提取试剂盒对患者血液提取总DNA,应用文献 中的引物(表1)及条件对Ot groEL 和sta56基因进行扩增,引物由上海生工公司合成。PCR反应总体积为25μL,应用Promega公司 Go-TaqGreen Master Mix试剂盒在Biometra TProfessional PCR仪中进行二次PCR扩增,以无菌水作为阴性对照,无阳性对照。第一次扩增时取6μL被检标本DNA为模板,第二次扩增时取第一次扩增产物1μL作为模板。取二次PCR产物用1.5%琼脂糖凝胶检测,DNA标准为DL2000(Takara公司)。
1.2.3 DNA序列测定及分析 PCR阳性产物送北京博迈德科技发展有限公司进行序列测定。将所得到的序列通过Internet网进入美国国家生物技术信息中心(www.ncbi.nlm.nih.gov)站点后,利用BLAST工具以及采用DNAStar中的MegAlign软件对序列进行同源性比较,运用MEGA5.0软件构建系统进化树。
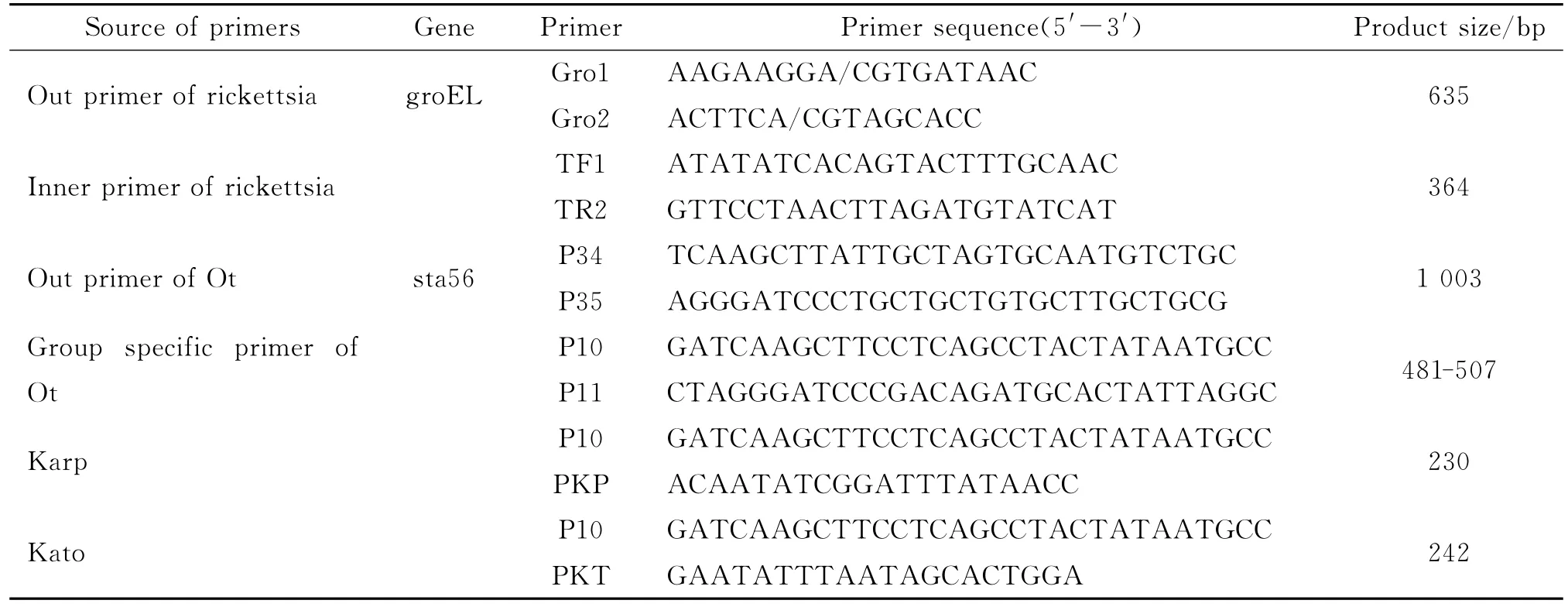
表1 Ot检测所用引物序列Tab.1 Primers’sequences for detection of Ot
2 结 果
2.1 病例资料 收集到病例19份资料(编号DL1-19),均有不明原因发热,发热时间在3~24d,体温在38~41℃,伴有全身酸痛7例、焦痂2例(DL1患者左腿腘窝处焦痂,见图1),有的还伴咳嗽、咳痰、鼻出血、胃出血、尿少等;其中农民15例、学生2例、其他2例,男:女性别为11/8,年龄在8~63岁。
2.2 IFA检测 对19例患者血清进行Ot IgG抗体检测,以效价1∶40作为阳性参考值,结果Karp型阳性7例,效价在1∶160-1∶40;Kato型阳性4例,效价在1∶320-1∶40;两型均阴性11例;两型均阳性3例,其中DL1样本两型效价均达1∶160(表2)。
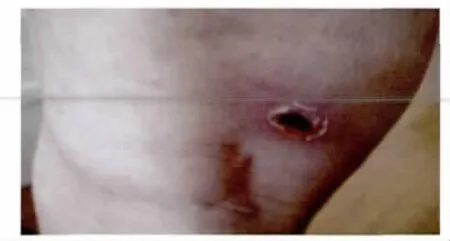
图1 特异性焦痂Fig.1 Specific eschar
2.3 groEL基因检测及序列分析 对19例患者血液进行nPCR Ot groEL 基因检测,结果 DL1、DL4和DL5共3份扩增到364bp大小的目的片断(图2和表2)。

图2 nPCR扩增groEL片断部分结果Fig.2 Partial result of nPCR detection by Ot groELsegment specific primersM:DL2000DNA marker;1:DL1;2:DL2;3:DL3;4:DL4;5:DL5;6:DL6;7:DL7;8:DL8;9:DL9;10:DL10.

表2 Ot抗体及groEL片断检测结果Tab.2 Detection results for Ab and groELsegment of Ot
从DL1、DL4和DL5样本中扩得的Ot groEL基因测序,将其序列进行比较,结果3者之间的同源性为100%。
应用BLAST工具将该测定序列(321bp)与GenBank中已知序列进行同源性比较,结果该序列与 AH-GD-OT-S6(GQ499933)、Karp (M31887)、ZJ-TT-OT-O21(GQ499953)、UT332(EF551306)的同源性均为100%;与Kato(AY191586)的同源性为99%; 与 Kawasaki (AY191587)、 Gilliam(AY191585)的同源性分别为94%、93%。
2.4 sta56基因检测及序列分析 对DL1样本应用群特异引物nPCR检测Ot sta56基因,结果扩增到481-507bp大小的目的片断,应用BLAST工具将测序获得的样本DL1序列(459bp)与GenBank中已知序列进行同源性比较,结果DL1序列与台湾株 KM05(GU120150)、HL04(GU120144)、TW45R(AY222632)、 KM17-2 (GU446600) KM18(GU446601)的同源性最高均为99%;与Karp株(M33004)的同源性为93%;与中国山东Shandong-XDM2(DQ514320)、TWZ(JX202573)株的同源性均为78%,与Kato(M63382)株的同源性为77%。
对DL1样本应用分型引物nPCR检测Ot sta56基因,结果扩增到230bp大小的Karp型sta56基因目的片断(图3),应用BLAST工具将测序获得的样本DL1序列与GenBank中已知序列进行同源性比较,结果 DL1序列(216bp)与台湾株 KM05(GU120150)、HL04(GU120144)、TW45R(AY222632)、KM17-2(GU446600)KM18GU446601的同源性均为100%,与Karp株(M33004)的同源性为91%。
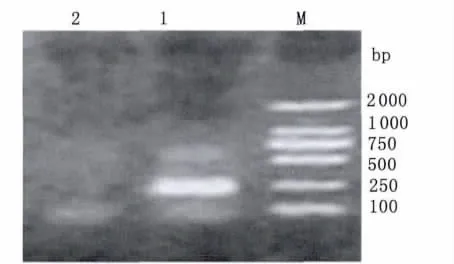
图3 分型引物nPCR检测DL1样本结果Fig.3 Results of DL1by nPCR with Karp and Kato specific primersM:DL2000DNA marker;1:Karp;2:Kato
2.5 系统进化树分析 根据Ot groEL 基因部分序列进行系统进化树分析,结果显示样本DL1序列(321bp)与 AH-GD-OT-S6(GQ499933)、Karp(M31887)、ZJ-TT-OT-O21(GQ499953)、UT332(EF551306)、Kato(AY191586)株在同一个分支上(图4)。
根据Ot sta56基因部分序列进行系统发生树分析,结果显示样本DL1序列(据群特引物检测Ot sta56片断所获得459bp大小的序列)与台湾KM05(GU120150)、HL04(GU120144)、TW45R(AY222632)、 KM17-2 (GU446600)、 KM18(GU446601)株在同一个分支上,见图5。
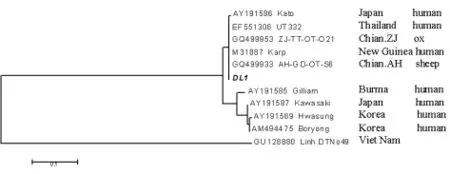
图4 根据Ot groEL基因部分序列构建的系统进化树Fig.4 Phylogenetic tree of partial segments of Ot groELgene
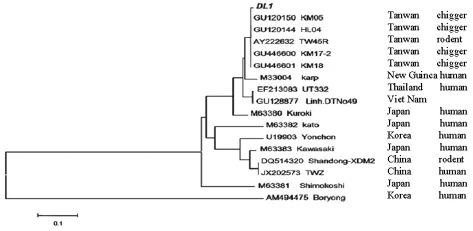
图5 根据Ot sta56基因部分序列构建的系统进化树Fig.5 Phylogenetic tree of partial segments of Ot sta56gene
2.6 恙虫病病例诊断 根据恙虫病预防控制技术指南[7],结合患者临床发病情况和实验室检测结果进行综合分析,恙虫病患者共8例:其中实验室确诊4例(其中2例Ot核酸阳性且抗体效价≥1∶160、1例Ot核酸阳性且抗体效价1∶40、1例Ot抗体效价1∶160)、临床诊断病例4例(Ot抗体效价在1∶80~1∶40);Karp血清型4例、Kato血清型3例、Karp+Kato血清型1例;农民7例、学生1例;春季3例、夏季2例、秋季2例、冬季1例。
3 讨 论
恙虫病是由恙虫病东方体引起的自然疫源性疾病,以鼠类为主要传染源,经恙螨叮咬而传播,临床上以发热、焦痂或溃疡、淋巴结肿大、肝脾肿大及皮疹为特征,全身毒血症状可致多脏器受累,甚至死亡[8]。恙虫病在我国分布广泛,近年全国流行态势呈上升趋势[9]。云南作为恙虫病流行的主要省份之一,其病例也在逐年增多,主要分布于保山、大理、西双版纳等滇西南地区,全年均有发病,以夏秋季为主,农民居多,且高度散发,误诊率高达80%[2]。以往多采用血清学方法对Ot进行鉴定,近年许多省份和地区均有应用RFLP、PCR技术及核苷酸序列分析等技术对Ot进行基因序列鉴定[9],然而云南对Ot的研究较少,特别是型别鉴定及序列分析尤为滞后。本次采用WHO推荐的恙虫病标准诊断方法IFA[10]以及nPCR与序列分析技术进行恙虫病病例诊断,确诊恙虫病8例。其中2例有特异性焦痂,占总病例的25%,低于以往本省恙虫病焦痂发生率30~80%[2];8例确诊恙虫病病例中7例患者为农民,符合该病以农民居多的特点;春季3例、夏季2例、秋季2例、冬季1例,这也符合本省恙虫病全年均有发病的特点。以往研究显示大理地区恙虫病患者以Karp血清型多见、Kato血清型甚少[11],而本次研究发现该地区8例确认的恙虫病中,Karp血清型4例和Kato血清型3例,Karp+Kato混合血清型1例。该结果说明大理地区存在Karp和Kato血清型恙虫病东方体,以及可能某些患者为Karp和Kato血清型恙虫病东方体的混合感染。
Ot 58kD蛋白较为保守,其编码基因groEL常用于Ot的筛查,而56kD蛋白具有型或株特异性,sta56为其编码基因通常应用于Ot的型别鉴定。本次研究通过nPCR检测到groEL基因目的片断3例(检出率15.79%,同时它们的Ot抗体也检测阳性),序列系统进化树分析显示该3株Ot均与Karp、AH-GD-OT-S6 (GQ499933)、ZJ-TT-OTO21、UT332、Kato株在同一个分支上,表明该方法不能区分出Ot的血清型别。从Karp+Kato混合血清型样本扩得sta56基因片断,其序列(216bp)分析结果表明该Ot株的遗传进化关系与台湾KM05、HL04、TW45R、KM17-2、KM18株最为密切,而与Karp株的关系较远;群引物检测到sta56基因片断,其序列(459bp)系统进化树分析显示该Ot株与台湾 KM05、HL04、TW45R、KM17-2、KM18株在同一个分支上,而与Karp株不在同一分支,再次表明该Ot株的遗传进化关系与台湾KM05、HL04、TW45R、KM17-2、KM18株最为密切,与 Karp株关系较远。
云南省大理地区为我国旅游胜地,该地区地形地貌复杂、植被丰富、鼠类和恙螨繁多[12-13],是恙虫病流行较为严重的地区,人们深受该病的危害。随着当地旅游业等人类活动的日益扩张,可致使一些恙虫病疫源地的微环境发生改变,Ot可能发生一定的基因变异而出现新的基因型,使恙虫病的流行可能呈现更为复杂多样化,不仅对旅游健康构成威胁,而且会对当地经济产生明显的负面影响。因此为了加强当地恙虫病的预防与控制,开展Ot的基因型别、毒力及其遗传特征等方面的研究具有重要的现实意义。
[1]Tamura A,Ohashi N,Urakami H,etal.Classification of Rick-ettsia tsutsugamushi in a new genusOreintiagen.nov.as Oreintia tsutsugamushi comb.Nov[J].Int J Syst Bacteriol,1995,45(3):589-591.DOI:10.1099/00207713-45-3-589
[2]Xuan Q,Liu AH,Bao FK.Current progress in research of tsutsugamushi disease in Yunnan Province in China[J].Chin Trop Med,2010,10(10):1278-1280.(in Chinese)宣群,柳爱华,宝福凯.云南恙虫病研究概况[J].中国热带医学,2010,10(10):1278-1280.
[3]Zhang LJ,Li XM,Zhang DR,etal.Molecular epidemic survey on co-prevalence of scrub typhus and marine typhus in Yuxi city,Yunnan province of China[J].Chin Med J(Engl),2007,120(15):1314-1318.
[4]Park HS,Lee JH,Jeong EJ,etal.Rapid and simple identification oforeintia tsutsugamushi from other group rickettsia by duplex PCR assay using groELgene[J].Micro Immunol,2005,49(6):545-549.
[5]Furuya Y,Yoshida Y,Katayama T,etal.Serotye specific amplification of Rickettsia tsutsugamushi DNA by nested polymerase chain reaction[J].J Clin Microbiol,1993,31(6):1637-1640.
[6]Tamura A,Yamamoto N,Koyama S,etal.Epidemiological survey oforeintia tsutsugamushi distribution in filed rodents in Saitama prefecture,Japan,and discovery of a new type[J].Microbial Immunol,2001,45(6):439-446.
[7]Chinese Center for Disease Control and Prevention.Tsutsugamushi disease prevention and control technical manual(Pilot Edition)[Z].2009-1.(in Chinese)中国疾病预防控制中心.恙虫病预防控制技术指南(试行)[Z].中疾控疾发,2009-1.
[8]Koh GC,Maude RJ,Paris DH,etal.Diagnosis of scrub typhus[J].Am J Trop Med Hyg,2010,82(3):368-370.DOI:10.4269/ajtmh.2010.09-0233 9Zhang MWang XJZhao ZT.Current epidemic status and issues on prevention and control of scrub typhus[J].Chin J Epidemiol,201l,32(4):419-423.DOI:10.3760/cma.j.issn.0254-6450.2011.04.021 (in Chinese)张萌,王显军,赵仲堂.中国恙虫病流行态势及预防控制[J].中华流行病学杂志,2011,32(4):419-423.DOI:10.3760/cma.j.issn.0254-6450.2011.04.021
[10]Blacksell SD,Bryant NJ,Paris DH,etal.Scrub typhus serologic testing with the indirect immuno-fluorescence method as a diagnostic gold standard:a lack of consensus leads to a lot of confusion[J].Clin Infect Dis,2007,44(3):391-401.DOI:10.1086/510585
[11]Feng XG,Yuan QH.Detection of antibody against tsutsugamushi disease from sera provided by fever patients and research of it's classification in Dali city of Yunnan Province[J].Chin J Zoonoses,1999,15(3):74.(in Chinese)冯锡光,袁庆虹.大理市发热病人血清恙虫病抗体检测及其分型研究[J].中国人兽共患病杂志,1999,15(3):74.
[12]Niu AQ,Guo XG,Men XY,etal.Community structure of chigger mites on small mammals in the surrounding areas of Erhai Lake in Dali of Yunnan[J].Chin J Vect Bio Ctrl,2005,16(6):434-437.(in Chinese)牛爱琴,郭宪国,门兴元,等.云南省大理洱海周边地带小兽体表恙螨群落结构[J].中国媒介生物学及控制杂志,2005,16(6):434-437.
[13]Gong ZD,Wu HY,Duan XD,etal.The species diversity and distribution trends of small mammals in Hengduan Mountains,Yunnan[J].Biodiversity Sci,2001,9(1):73-79.(in Chinese)龚正达,吴厚永,段兴德,等.云南横断山区小型兽类物种多样性与地理分布趋势[J].生物多样性,2001,9(1):73-79.

