猪源产细菌素肠球菌的分离鉴定
张永红,阮文科,李焕荣,杨 瑞,崔德凤,2*
(1.北京农学院动物科学技术学院,北京102206;2.兽医学(中医药)北京市重点实验室,北京102206;3.农业应用新技术北京市重点实验室,北京102206)
我国是一个畜牧业大国,也是动物产品消费大国。动物性食品抗生素超标而导致的出口损失以及公共卫生安全问题引起了人们的广泛关注。细菌素是某些细菌核糖体合成的初级代谢产物,是一类具有抑菌活性的多肽或蛋白质,抑菌范围不局限于近缘的细菌,细菌素产生菌的免疫蛋白对其细菌素有自身抗性[1]。乳酸链球菌肽Nisin是世界上公认安全的防腐剂,已有52个国家和地区使用Nisin作为食品防腐剂,Nisin抑菌谱窄,仅对革兰阳性菌有抑菌作用,能抑制链球菌属、葡萄球菌属、小球菌属、梭菌属和芽胞杆菌属的细菌等[2-3]。Nisin的商品化促进了其他种类细菌素的研究及其在食品防腐剂之外领域的开发和应用。肠球菌作为动物肠道的优势菌群,具有耐胆盐、耐酸及耐高温等微生物学特征,是一种发酵糖产生大量乳酸的兼性厌氧乳酸菌,与厌氧、培养保存条件苛刻的双歧杆菌等乳酸菌相比,更适合于生产和应用。作为乳酸菌,肠球菌参与了食品发酵,如乳酪、香肠,同样也应用于青贮饲料的发酵,由于肠球菌产生细菌素的多样性和食品保鲜及畜牧业生产中的应用潜力,在过去几年中产细菌素肠球菌激发了人们的研究热情,然而猪源肠球菌细菌素的研究仍较少,更未见替代抗生素作为饲料添加剂的报道。近年来细菌素已被用于病原菌的预防和治疗等研究。Morovsky M等[4]从犊牛和羔羊分离的葡萄球菌产生的细菌素对瘤胃球菌和大肠埃希菌具有抑制活性[3]。
本研究从北京优良地方品种北京黑猪胃肠道分离筛选对大肠埃希菌和金黄色葡萄球菌具有抑菌活性的细菌素产生菌,采用微生物学和分子生物学方法综合鉴定分离菌株,以期获得可应用动物生产和活菌生物制剂的优良菌种,为产细菌素菌株在饲料添加剂中的应用提供理论和实践依据。
1 材料与方法
1.1 材料
1.1.1 菌株、培养基及试剂 大肠埃希菌(E.coli k88)、金黄色葡萄球菌(Staphyloccocus aureus)由北京农学院动物科学技术学院微生物实验室提供,标准菌株粪肠球菌B1和屎肠球菌B2由中科院微生物研究所提供;PYG培养基、MRS培养基自制;胰蛋白酶、蛋白酶为K Sigma公司产品;Taq DNA聚合酶,dNTPs,10×PCR buffer为北京汇天东方有限公司产品;BamHⅠ,HindⅢ,EcoRⅠ和SalⅠ酶为宝生物工程(大连)有限公司产品;Rnasin、Peasy-T克隆载体为北京全式金生物技术有限公司产品;高纯度质粒提取试剂盒为Tiangen公司产品;DNA片段快速胶回收试剂盒为博大泰克生物科技公司产品。
1.1.2 培养材料 无菌采取健康猪的整个消化道包括胃、小肠、大肠和直肠,分别用灭菌药勺刮取各个部位黏膜组织1g于平皿中剪碎,加5mL灭菌生理盐水混悬,取100μL组织悬液至肠球菌增菌培养基,采用烛缸法37℃培养24h。
1.2 方法
1.2.1 分离纯化 选取肠球菌选择培养基,将有细菌生长的增菌液进行分离,37℃培养24h。挑取疑似肠球菌菌落,进行分离、纯化,并分别保存于4℃和-20℃冰箱中备用。
1.2.2 抑菌试验 采用琼脂打孔扩散法,将各指示菌培养到对数生长期,用灭菌生理盐水稀释到107cfu/mL,取100μL涂布PYG培养基平板,打孔。将已分离纯化的细菌接种至MRS培养基中,37℃培养24h,8 000r/min离心10min,取上清液加至已接种指示菌的PYG平板孔中,以MRS培养基为空白对照,4℃冰箱中扩散后,置37℃培养24h观察结果。
1.2.3 过氧化氢检测 将肠球菌分别发酵培养,8 000r/min离心10min,取上清液。采用H2O2酶法进行H2O2的检测。同时将H2O2酶处理前后的上清液进行抑菌试验,比较抑菌活性。
1.2.4 酸排除试验 采用NaOH中和法排除细菌发酵产物中酸性物质,用6mol/L NaOH调节细菌发酵上清液至pH 7.0作用30min,以未调pH发酵原液及pH为4.5的乳酸、盐酸为对照,进行指示菌抑菌试验,37℃培养24h测量抑菌圈直径。
1.2.5 蛋白酶处理 取培养24h细菌发酵上清液,分别加入蛋白酶K、胰蛋白酶和木瓜蛋白酶,使其终浓度为5g/L,37℃水浴2h后取100μL,测定抑菌活性,以未加蛋白酶的细菌上清液作为对照。
1.2.6 生化试验 将分离纯化的细菌进行生化鉴定试验,包括 H2O2酶、pH 9.6营养肉汤、400mL/L胆汁七叶苷生长,45℃营养肉汤生长以及65g/L NaCl营养肉汤生长试验,同时接种各类糖发酵培养基,并进行细菌涂片、染色,镜检。
1.2.7 乳酸菌16SrDNA基因鉴定 引物参照文献Halami的通用引物序列,由上海生工生物工程技术服务有限公司合成。预期扩增片段大小为1 500 bp。正向引物p1加入EcoRⅠ和SalⅠ酶切位点,反向引物p2加入BamHⅠ和HindⅢ酶切位点,引物 序 列 如 下:P1:5′-TCATCTGTCCCACCTTGCGC-3′,P2:5′-GAGTTTGATCCTGGCTCAGG-3′。
采用常规酚/氯仿抽提方法进行基因组DNA提取与检测,建立PCR反应体系50μL其中模板DNA 4μL、Taq DNA 聚 合 酶 1μL、25mmol dNTPs 1μL、10×PCR buffer 5μL、20pmol/μL上下游引物各1μL,加三蒸水至50μL。反应程序如下:95 ℃ 5min;94℃ 30s,54 ℃ 30s,72 ℃ 2 min,共35个循环;最后于72℃延伸10min。用三蒸水作为阴性对照。取10μL PCR产物,10g/L琼脂糖凝胶电泳,采用凝胶成像系统分析扩增片断的长度,用DNA凝胶回收试剂盒收取鉴定正确的PCR产物。
将纯化回收的PCR产物与PGEM-T Easy载体连接,转化大肠埃希菌DH5α载体菌,选取酶切鉴定正确的克隆菌,进行序列测定。利用DNA Star Gentyx等软件对分离株16SrDNA基因序列与GenBank中参考菌株序列进行同源性比对,绘制细菌系统发育进化树。
2 结果
2.1 菌株筛选
利用肠球菌鉴别培养基从健康猪的胃肠道分离到56株细菌,采用纸片扩散法初筛得到对大肠埃希菌与金黄色葡萄球菌均有抑菌作用的30株菌,随后采用双层琼脂扩散法复筛获得12株抑菌活性较强的菌株,命名为E1~E12,添加甘油,在-80℃冰冻保存备用。
2.2 抑菌物质的初步确定
2.2.1 过氧化氢抑菌作用的排除 某些细菌的代谢产物H2O2能够抑制其他细菌的生长繁殖,革兰阴性细菌对其尤为敏感。肠球菌在培养过程中,培养液始终无红色产物形成。说明没有形成H2O2或其含量微乎其微。
采用过氧化氢酶处理后的细菌发酵上清液,进行抑菌试验,与未处理对照组比较,发酵上清液的抑菌活性没有变化,排除了H2O2对指示菌的抑制作用。
2.2.2 酸类抑菌物质的排除 乳酸菌产生的抑菌物质还包括大量酸性代谢产物如乳酸、乙酸和细菌素类物质等,为了排除酸性代谢产物的作用,取培养24h的菌株发酵上清液,用6mol/L NaOH调节pH至7.0后,进行抑菌试验(表1)。结果显示,pH为7.0的细菌上清液仍具有较强的抑菌活性,说明酸被中和后的细菌上清液中仍有抑菌活性物质。

表1 酸排除后的抑菌作用Table 1 The results of antibacterial effects by supernatant without acid mm
2.2.3 蛋白酶降解检测 取细菌培养上清液分别进行胰蛋白酶、蛋白酶K和木瓜蛋白酶处理,以未经酶液处理的原液作对照。结果见图1,经胰蛋白酶、蛋白酶K和木瓜蛋白酶处理后的细菌上清液抑菌活性明显降低,说明培养菌上清液中的抑菌物质中含有蛋白质或多肽成分,可以初步判断细菌发酵产生了一类具有蛋白性质的细菌素类抑菌物质。

图1 蛋白酶处理后的抑菌活性Fig.1 Results of antibacterial activity from treatment with protease
2.3 菌株鉴定
2.3.1 细菌形态与培养特性 分离菌革兰染色呈阳性,圆形或卵圆形,单在、成对或形成短链状排列,无荚膜、无芽孢、无鞭毛的球菌。该菌在肠球菌选择培养基上形成紫红色,表面光滑凸起,周边整齐,直径0.5mm~1.0mm的菌落见图2,在普通营养琼脂培养基上,形成圆形灰白色,针尖状或露滴状的小菌落,湿润、半透明,边缘整齐,无溶血性。
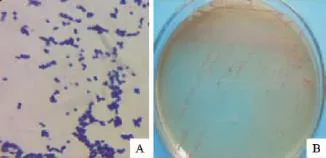
图2 分离菌株特征Fig.2 Gram staining trait and growth trait of isolated bacteria
2.3.2 生化特征 分离菌接触酶阴性,胆汁七叶苷试验阳性,65g/L的NaCl生长阳性、45℃生长阳性,细菌运动力阴性符合肠球菌属的鉴别特征,结合v-p试验、马尿酸、精氨酸、糖发酵等试验结果,表明E1、E9和E12,3株细菌为屎肠球菌(Enterococcus faecium),E2、E3、E4、E5、E6、E7、E8、E10和 E11 9株为粪肠球菌(Enterococcusfaecalis)见表2、表3。2.3.4 PCR扩增及重组质粒鉴定 以12株分离菌和阳性参考菌基因组DNA为模板,进行PCR扩增和琼脂糖凝胶电泳,PCR扩增结果。产物片段大小约1.5kb,与预期目的片段相符。阴性对照未出现特异性条带。对重组质粒酶切鉴定结果(图3)。
形态学和生理生化鉴定结合16SrDNA序列分析结果显示,E2、E3、E4、E5、E6、E7、E8、E10和E11 9株分离菌与参考菌株FJ749378粪肠球菌同源性高达99.6% ~100% (图4);3株分离菌E1、E9、E12与B2、参考菌株FJ749740屎肠球菌组成一个分支(图5),与同源性结果一致。根据肠球菌生化特征及16SrDNA序列鉴定,判定9株菌E2、E3、E4、E5、E6、E7、E8、E10和 E11为粪肠球菌,3株E1、E9和E12为屎肠球菌。

表2 分离菌生理生化鉴定Table 2 Physiological and biochemical characteristics of the strains

表3 分离菌糖发酵试验结果Table 3 The results of carbohydrate fermentation of the strains

图3 12株分离菌及参考菌株16SrDNA基因重组质粒鉴定Fig.3 Identification of 16SrDNA gene recombination plasmid of isolated bacteria and standard bacteria
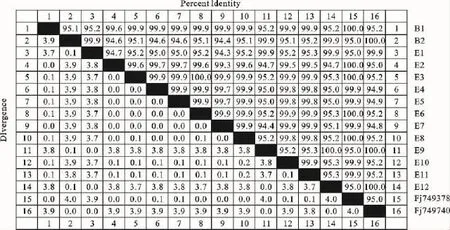
图4 12株分离菌与参考菌株的16SrDNA基因序列同源性Fig.4 The homology of twelve isolated bacteria and standard bacteria

图5 12株肠球菌与参考菌株的16SrDNA基因进化树Fig.5 Phylogenetic tree of 16SrDNA sequences of 12strains
3 讨论
现代细菌学分类一般采用细菌的基因型特征结合生物型特征的方法,比较公认的是依据细菌16S rDNA序列进行分类。目前分类的标准是:99%~100%全序列相似性的细菌判定为同一个种,97%~100%全序列相似性的细菌判定为同一属。
因此,16SrDNA基因序列可作为细菌系统发育分析、鉴定的最合适指标。自从Woese等将16S rDNA序列同源性用于生物的系统发育研究以来,细菌的鉴定手段也从以生物表型特征为依据发展到以系统发育分子为依据的分子生物学鉴定。Reysenbach A L 等[7-8]试 验 证 明16SrDNA 序 列 分 析法是鉴定益生菌株的一种非常有效的方法 。
肠球菌是美国FDA 1989年公布的动物益生菌种之一,肠球菌是一类革兰阳性、兼性厌氧乳酸菌,是人类及动物胃肠道的主要菌群,在调节动物肠道菌群平衡中起着重要的作用,具有恢复感染肠道的菌群平衡,调节机体免疫功能,促进动物健康的作用。
本研究以致病性大肠埃希菌K88、K99、金黄色葡萄球菌作为指示菌,利用鉴别培养基从健康北京黑猪胃肠道分离、筛选肠球菌,以期获得对革兰阳性和革兰阴性病原菌具有抑制作用的广谱菌株。通过形态学、生理生化特征分析结合16SrDNA系统发育进化研究对12株具有较强抑菌活性的菌株进行种属鉴定。结果表明E2、E3、E4、E5、E6、E7、E8、E10、E11和B1与GenBank中收录的粪肠球菌FJ749378同源性在99.3%~100%;3株分离菌E1、E9、E12和B2与屎肠球菌FJ749740组成一个大的分支,生物表型与基因型二种方法的分析鉴定结果相一致,本试验分离菌株E2、E3、E4、E5、E6、E7、E8、E10和E11为粪肠球菌,E1、E9、E12为屎肠球菌。
乳酸菌的抑菌作用由多种因素构成,包括甲酸、乙酸等有机酸、过氧化氢和细菌素等物质。筛选产细菌素乳酸菌,一般采用有机酸和过氧化氢排除抑菌试验后,发酵液仍具有抑菌活性,可以初步确定菌株产生细菌素。本试验采用纸片扩散法从健康猪胃肠道分离到56株细菌,初筛得到对金黄色葡萄球菌及大肠埃希菌(包括了革兰阳性菌和革兰阴性菌)均有抑制作用30株菌,随后采用琼脂扩散法复筛得到12株具有较强抑菌活性的菌株,在排除过氧化氢、有机酸等抑菌物质作用后仍具有较强抑菌活性,说明发酵液中有其他抑菌活性物质的存在,采用蛋白酶处理发酵上清液后抑菌活性明显下降,说明这种活性物质具有蛋白质性质,初步判断为一种细菌素类物质。
能够产生细菌素的细菌包括革兰阳性菌和革兰阴性菌。革兰阳性菌的研究主要集中在乳酸菌,发酵工业中应用的乳酸菌主要包括片球菌(Pediococcus)[9],明串珠菌(Leuconostoc)[10],乳杆菌(Bacterium lacticum),双歧杆菌(Bacillus bifidus),肠球菌(Enterococcus),链球菌(Streptococcus)[11]以及肉食杆菌(Carnobacterium)属等[12]。乳酸菌几乎每个属种,甚至每一株菌都能产生细菌素。Green G等[15]报道了从片球菌属分离的NCFB 1832菌产生的Pediocin PD-1对食物腐败菌和病原菌的抑制作用,对片球菌属其他细菌无活性[13-14]。产生细菌素的口腔优势非致病菌唾液链球菌具有成为益生菌制剂的潜力。
Corvey C等[16]从枯草芽胞杆菌提取出的枯草菌素(subticin),是一种环多肽,能抑制真菌,但对细菌作用很小。Kramer J等[17]鉴定的粪肠球菌(Enterococcus faecalis)所产细菌素能抑制李斯特菌(L.monocytogenes)和酪丁酸梭菌(Clostridium tyroburicum)等病原菌和污染菌,本研究分离获得的肠球菌来自优良地方品种-北京黑猪,并具有益生菌耐热、耐酸、抗胆盐,容易培养等特征[18]。其抗菌活性的特性有待进一步研究,并在动物传染病的防控中具有一定的应用前景。
[1] Abee T.Pore-forming bacteriocins of Gram-positive bacteria and self-protection mechanisms of producer organisms [J].FEMS Microbiol Lett,1995,129(1):1-10.
[2] Gudkov A V,Liubimova L A,Trofimova T I,et al.Determination of nisin activity by the resazurin method[J].Antibiotiki,1973,18(4):346-350.
[3] Laukova A.Enterococci and staphylococci isolates from rumen of fallow deers and their antimicrobial activity.New [J].Microbiol,1993,16(4):351-357.
[4] Morovsky M,Pristas P,Javorsky P,et al.Isolation and characterization of enterocin BC25and occurrence of the entA gene among ruminal gram-positive cocci[J].Microbiol Res,2001,156(2):133-138.
[5] Cornut G,Fortin C,Soulieres D.Antineoplastic properties of bacteriocins:revisiting potential active agents[J].Am J Clin Oncol,2008,31(4):399-404.
[6] Ryan M P,Meaney W J,Ross R P,et al.Evaluation of lacticin 3147and a teat seal containing this bacteriocin for inhibition of mastitis pathogens[J].Appl Environ Microbiol,1998,64(6):2287-2290.
[7] Reysenbach A L,Wickham G S..1994.Phylogenetic analysis of the hyperthermophilic pink filament community in Octopus Spring,Yellowstone National Park[J].Appl Environ Microbiol,1994,60(6):2113-2119.
[8] Gray J P,Herwig R P.Phylogenetic analysis of the bacterial communities in marine sediments[J].Appl Environ Microbiol,1996,62(11):4049-4059.
[9] Marugg J D,Gonzalez C F,Kunka B S,et al.Cloning,expression,and nucleotide sequence of genes involved in production of pediocin PA-1,and bacteriocin fromPediococcus acidilactici PAC1.0[J].Appl Environ Microbiol,1992,58(8):2360-2367.
[10] Choi H J,Lee H S,Her S,et al.Partial characterization and cloning of leuconocin J,a bacteriocin produced by Leuconostoc sp.J2isolated from the Korean fermented vegetable Kimchi[J].J Appl Microbiol,1999,86(2):175-181.
[11] Egorov N S,Baranova I P,Grushina V A.Effect of the initial pH value of the medium on the growth of Streptococcus lactis and the biosynthesis of nisin[J].Antibiotiki,1976,21(6):499-501.
[12] Nilsson L,Nielsen M K,Ng Y,et al.Role of acetate in production of an autoinducible class IIa bacteriocin in Carnobacterium piscicola A9b[J].Appl Environ Microbiol,2002,68(5):2251-2260.
[13] Green G,Dicks L M,Bruggeman G,et al.Pediocin PD-1,a bactericidal antimicrobial peptide from Pediococcus damnosus NCFB 1832[J].J Appl Microbiol,1997,83(1):127-132.
[14] Ennahar S,Assobhel O,Hasselmann C,et al.Inhibition of Listeria monocytogenes in a smear-surface soft cheese by Lactobacillus plantarumWHE 92,apediocin AcH producer[J].J Food Prot,1998,61(2):186-191.
[15] Wescombe P A,Heng N C,Burton J P,et al.Streptococcal bacteriocins and the case for Streptococcus salivarius as model oral probiotics[J]Future Microbiol,2009,4:819-835
[16] Corvey C,Stein T,Dusterhus S,et al.Activation of subtilin precursors by Bacillus subtilis extracellular serine proteases subtilisin AprE,WprA,and Vpr[J].Biochem Biophys Res Commun,2003,304(1):48-54.
[17] Kramer J.Inhibition of different serotypes of Listeria monocytogenes by enterocins in solid and liquid media[J].J Med Microbiol,1977,10(3):367-372.
[18] 杨桂梅,张永红,崔德凤,等.2株猪源益生性肠球菌对酸和胆盐及热的耐受性研究[J].北京农学院学报,2008,23(4):29-32

