水牛IFN-γ在毕赤酵母中的表达及其单克隆抗体的制备
邹新峰,郭爱珍*,陈颖钰,胡长敏,王 冰,刘晓乐,谢 倩,姜 勇,张 策,陈焕春
(1.华中农业大学农业微生物学国家重点实验室,湖北武汉430070;2.华中农业大学动物医学院,湖北武汉430070;3.华中农业大学动物科技学院,湖北武汉430070)
γ干扰素(interferon-γ,IFN-γ)是一种多功能生物活性多肽,具有抗感染、抗肿瘤活性和免疫调节等作用,如活化巨噬细胞、提高 MHCⅠ类和 MHCⅡ类分子的表达、促进抗原提呈等,在机体抗感染与免疫中发挥重要作用[1]。基于IFN-γ与感染之间的密切联系,医学及兽医学上常利用检测IFN-γ进行传染病诊断[2]。该方法灵敏度与特异性较高,显示出很大的应用前景[3-6],其基本原理是曾经感染或发过病的人或动物,其T淋巴细胞被该病原如结核分支杆菌致敏,当在体外再次遇到相同抗原时,T淋巴细胞将在短时间内再激活产生大量IFN-γ,因此,通过检测特异性抗原刺激后T细胞分泌的IFN-γ水平即可判断动物是否感染过该病原。该原理在黄牛或人结核检测上得到应用,如人结核ELISPOT试剂盒、BOVIGAM®牛分支杆菌γ干扰素检测试剂盒等已有商品上市。但水牛尚无类似试剂盒可用。
据联合国粮农组织(FAO)统计,2009年全世界有水牛18 792万头,97%分布在亚洲(18 244万头),水牛数量位于前三位的国家是印度(10 663万头)、巴基斯坦(2 988万头)和中国(2 328万头)。水牛耐粗抗逆,是我国南方宝贵的品种资源,目前正由役、奶、肉兼用向肉或奶专用方向发展,且产业化程度不断提高,因此研发其新型疾病诊断技术具有重要意义。本研究通过克隆和真核表达水牛IFN-γ,制备单克隆抗体和多克隆抗体,建立灵敏度和特异性较高的水牛IFN-γ检测方法,为进一步研发水牛特异性疫病诊断技术奠定良好基础。
1 材料与方法
1.1 材 料
各种限制性内切酶,T4DNA连接酶,DNA分子质量标准品均为宝生物工程(大连)有限公司产品;2×PCR Mix为广州东盛生物科技有限公司产品;逆转录酶ReverTra Ace为ToyoCer公司产品;原核表达的水牛IFN-γ蛋白、奶牛IFN-γ蛋白(BovIFN-γ)、梅 花 鹿 IFN-γ 蛋 白 (CerIFN-γ)、猕 猴IFN-γ蛋白(Macaque IFN-γ,macIFN-γ)、糖蛋白gG、结核分支杆菌特异性融合蛋白CFP10-ESAT6(CE)、Rv3872-CFP10-ESAT6 (RCE)、MPB70-MPB83-CFP10-ESAT6(70-83-CE)、牛无乳链球菌Sip蛋白、牛无乳链球菌和金黄色葡萄球融合蛋白Sip-Clfa、牛无乳链球菌 Gapc蛋白、pET-30a载体、大肠埃希菌(E.coli)感受态菌DH5α、表达菌BL21(DE3)均由本实验室保存;刀豆球蛋白A(Con A)、羊抗鼠IgG-HRP、羊抗兔IgG-HRP均为Sigma公司产品;RPMI-1640培养基为 Hyclone公司产品;DMEM培养基为Gibco公司产品;胎牛血清为美国Gibcol公司产品。
SPF级雌性Balb/c小鼠及雄性日本长耳大白兔,购自湖北省疾病控制中心实验动物中心。
1.2 方法
1.2.1 水牛IFN-γ成熟肽基因的克隆 根据Gen-Bank上发布的水牛IFN-γmRNA全长序列(Gen-Bank登录号:EF567075),用信号肽预测软件SignalP 3.0Server预测信号肽,针对去除信号肽的成熟肽序列设计一对引物,由上海生工生物工程技术服务有限公司合成。引物序列如下:
上 游 引 物:5′-CGCGAATTCCAGGGCCAATTTTTTAGAG-3′(下划线为无关碱基);
下 游 引 物:5′-ATAGCGGCCGCCATTGATGCTCTCCGG-3′(下划线为无关碱基)。
无菌采取本地江汉水牛、摩拉杂交水牛颈静脉肝素抗凝血10mL,加ConA 60μg/mL于37℃体积分数为5%CO2条件下培养16h。提取外周血白细胞总RNA作为RT-PCR的模板,一步法扩增本地水牛与摩拉杂交水牛IFN-γ成熟肽序列429 bp[2]。将本地水牛与摩拉杂交水牛的IFN-γ扩增片段送华大基因公司测序鉴定。
根据测序结果,通过密码子优化网站http://www.jcat.de/Start.jsp,将水牛IFN-γ密码子替换为毕赤酵母最偏爱密码子,命名为BbIFN-γ(优),上游加上EcoRⅠ位点、下游分别加上6×His、终止子TAGTAA、NotⅠ位点,并合成全基因优化后的序列,连于pUC57载体上。通过限制性内切酶EcoRⅠ、NotⅠ双酶切将该基因连接到酵母表达载体pPICZαA中,构建的重组质粒命名为pPICZαA-Bb-IFN-γ(优)。转化感受态细菌DH5α。
1.2.2 毕赤酵母的转化与鉴定 取5μg~10μg重组表达质粒pPICZαA-BbIFN-γ(优),限制性内切酶SacⅠ酶切线性化后,用普通DNA产物纯化试剂盒进行纯化,最后用无菌去离子水洗脱。线性化质粒电击转化毕赤酵母GS115,在500μg/mL Zeocin YPD平板上30℃孵化2d~3d,筛选高拷贝转化子,阳性转化子在平板上应为乳白色酵母菌落。电击参数为电压2 000V,电容25μF,电阻200Ω。
用PCR鉴定阳性转化子,引物为酵母载体通用引物,序 列 为:5′-AOX1(GAC TGG TTC CAA TTG ACA AGC)和 3′-AOX1(GCA AAT GGC ATT CTG ACA TCC。用酵母基因组DNA提取试剂盒提取酵母基因组作为模板,进行PCR鉴定,阳性转化子可获得2 200bp(由酵母染色体DNA扩增而得)和580bp+467bp目的片段 (由插入至酵母基因组DNA中含有目的基因的表达盒DNA扩增而得)的扩增产物。
1.2.3 水牛IFN-γ基因的诱导表达和产物鉴定挑选一单菌落,置于25mL BMGY培养基中,28℃、250r/m培养至 OD600nm=2.0左右(16h~18 h);离心弃上清,用50mL BMMY重悬菌体,使OD600nm=1.0左右(约50mL);用甲醇连续诱导4d,在诱导过程中,每24h加入甲醇至终浓度为10 mL/L,并每隔一段时间取样一次(如0、24、48、60、72、84、96h)。样品经离心收集上清并用TCA(三氯乙酸)浓缩,150g/L SDS-PAGE(分离胶浓度为150g/L)鉴定重组蛋白各个诱导时间的表达量情况[8]。
1.2.4 重组水牛IFN-γ的抗病毒活性鉴定 利用微量细胞病变抑制法[9],采用牛肾细胞系细胞(madin-darby bovine kidney,MDBK)-水疱性口炎病毒(Vesicular stomatitis virus,VSV)系统(MDBKVSV)检测干扰素的抗病毒活性。将MDBK细胞铺于96孔细胞培养板中,待细胞长至孔底的80%左右时,弃原孔培养液,再在每孔中加不同稀释度的酵母表达的重组BbIFN-γ蛋白或原核表达的重组BbIFN-γ蛋白(本实验室保存)100μL(原蛋白浓度0.238mg/mL),孵育24h后,加入100TCID50的VSV。同时设不加重组BbIFN-γ蛋白、不加病毒、不加重组BbIFN-γ蛋白和病毒的3个对照组。2d后在显微镜下观察细胞病变。将能抑制50%细胞病变时干扰素的最大稀释度定义为1个干扰素活性单位(U),比活性为每mg蛋白含有的活性单位数。
1.2.5 水牛IFN-γ单克隆抗体及多克隆抗体制备
重组IFN-γ与等体积弗氏完全佐剂混合乳化完全,选取4周龄~6周龄的雌性Balb/c小鼠5只,按100μg/只皮下多点注射进行免疫,以后每2周免疫一次,从第2次免疫起,抗原蛋白与弗氏不完全佐剂等体积混合乳化,免疫3次~4次,用间接ELISA检测小鼠血液抗体水平,当抗体效价达到1∶10 000以上时,间隔1个月后,选取抗体水平较高的Balb/c小鼠于融合前3d腹腔注射加强免疫,抗原量加倍,不加佐剂。
按传统方法进行脾细胞制备与细胞融合[7]。将加强免疫的Balb/c小鼠,摘除眼球放血,颈椎脱臼法处死,按无菌操作取出脾脏,分离免疫小鼠脾细胞,加入非免疫小鼠的腹腔巨噬细胞作为滋养细胞。将免疫脾细胞与骨髓瘤细胞SP2/0以10∶1比例混匀于50mL尖底离心管中,1 500r/m离心10 min,保留细胞沉淀。于37℃水浴中,在1min内慢慢加入0.8mL预温至37℃的50%PEG4000,边加边轻轻搅拌。加毕,静置1min,然后慢慢加入10 mL预温至37℃的RPMI-1640基础培养基。1 000 r/m离心5min,保留细胞沉淀,37℃ 放置5min~8min。用含有饲养细胞的HAT培养基悬浮细胞沉淀,均匀滴加至4块96孔细胞培养板中,约250 μL/孔。置于体积分数为5%CO2,37℃ 培养箱中培养。第4天补加1滴HAT培养基,第8天到第10天每孔吸去100μL培养基后,添加100μL HT培养基。待细胞集落长至视野1/4~1/2时,即可进行抗体检测。
以BbIFN-γ融合蛋白检测杂交瘤细胞上清抗BbIFN-γ单克隆抗体滴度,筛选阳性克隆孔,进一步用有限稀释法将阳性克隆孔细胞克隆3次后筛选能稳定分泌单克隆抗体的杂交瘤细胞株,通过杂交瘤细胞染色体计数鉴定杂交瘤细胞的特征。按常规方法制备腹水,用辛酸-硫酸铵法进行腹水单克隆抗体的提取与纯化[10]。
同时,将纯化的BbIFN-γ按以上程序免疫两只2.0kg以上体重的雌性日本长耳大白兔,抗原免疫剂量为1 000μg/只,每2周免疫一次,每次免疫前用间接ELISA测定血清抗体效价,当血清效价不再上升时,心脏采血,分离血清,利用辛酸-硫酸铵法纯化多克隆抗体[10]。
1.2.6 水牛IFN-γ体外释放方法的建立
1.2.6.1 水牛IFN-γ单/多克隆抗体最佳工作浓度的确定 利用方阵滴定确定最佳工作浓度,基本程序按照本实验室常规方法。BbIFN-γ单克隆抗体分别以10μg/mL、5μg/mL、2.5μg/mL、1.25μg/mL、625 ng/mL、313ng/mL、156ng/mL、78ng/mL 8个梯度,纵向按每孔100μL包被96孔ELISA板,每稀释度1孔,4℃包被过夜。次日用 PBST(含0.5mL/L Tween-20)充分洗涤后加入50g/L脱脂奶粉37℃封闭1h。固定夹心抗原BbIFN-γ的浓度(本试验设1 000、200、50、1ng/mL 4个浓度),每孔100μL,37℃孵育30min后充分洗涤。BbIFN-γ多克隆抗体分别以5μg/mL、2.5μg/mL、1.25μg/mL、625ng/mL、313ng/mL、156ng/mL 6个梯度横向按每孔100μL量加入ELISA板,每稀释度1孔,37℃孵育30min后充分洗涤。加1∶5 000稀释的羊抗兔IgG-HRP,每孔100μL,37℃孵育30min,充分洗涤后每孔100μL TMB/H2O2底物液,室温避光反应10min后,每孔加入50μL终止液(2.5mL/L氢氟酸)终止反应,读取波长630nm的光密度值(OD)。
1.2.6.2 水牛IFN-γ单克隆抗体敏感度的测定 根据上述方阵滴定方法得到的单抗2C3的最适包被浓度包被96孔酶标板,100μL/孔,4℃包被过夜。次日用PBST充分洗涤后加入50g/L脱脂奶粉37℃封闭1h。PBST充分洗涤后,用洗涤液递增稀释抗原(Bb-IFN-γ标准品),稀释后为2μg/mL、1μg/mL、500 ng/mL、250ng/mL、125ng/mL、62.5ng/mL、31.25 ng/mL、15.6ng/mL、7.8ng/mL、3.9ng/mL、2.0 ng/mL、1.0ng/mL、500pg/mL、250pg/mL、125 pg/mL 15个梯度,37℃孵育30min,重复洗涤。用洗涤液稀释到确定的多克隆抗体工作浓度,每孔100 μL,37℃孵育30min后充分洗涤。加1∶5 000稀释的羊抗兔IgG-HRP,每孔100μL,37℃孵育30min,充分洗涤后每孔100μL TMB/H2O2底物液,室温避光反应10min后,每孔加入50μL终止液 (2.5 mL/L氢氟酸)终止反应,读取波长630nm的光密度值(OD)。
1.2.6.3 水牛IFN-γ单克隆抗体特异性的测定 用确定的水牛IFN-γ单/多克隆抗体最佳工作浓度,分别检测牛IFN-γ(bovine IFN-γ,bov IFN-γ)、鹿IFN-γ(Cervus nippon IFN-γ,CerIFN-γ)、猴IFN-γ(Macaque IFN-γ,mac IFN-γ)、gG、CE、RCE、70-83-CE、Sip、Sip-Clfa、Gapc等抗原,验证单抗的特异性。
2 结 果
2.1 水牛IFN-γ基因的克隆与鉴定
以ConA刺激16h的本地水牛、摩拉杂交水牛全血淋巴细胞中提取的总RNA为模板,通过RTPCR扩增出一条预期大小(429bp)的特异性目的条带(图1)。

图1 BbIFN-γ基因的RT-PCR产物Fig.1 RT-PCR products of BbINF-γgenes
本地江汉水牛与摩拉杂交水牛的IFN-γ成熟肽扩增片段测序结果完全一致,说明本地水牛和摩拉杂交水牛虽然染色体数不同,但其IFN-γ的序列是一致的,测序结果与GenBank中公布的广西沼泽型水牛IFN-γ序列同源性为99%。
将优化后的序列连接于毕赤酵母表达载体pPICZαA,构建了重组表达质粒 pPICZαA-BbIFN-γ(优),经限制性内切酶EcoRⅠ、NotⅠ双酶切,获得一条500bp的条带,与BbIFN-γ基因的大小相符(图2)。

图2 重组质粒pPICZαA-BbIFN-γ的酶切鉴定Fig.2 Identification of pPICZαA-BbIFN-γby enzyme digestion
2.2 重组水牛IFN-γ的酵母表达与鉴定
将重组表达质粒pPICZαA-BbIFN-γ(优)转化毕赤酵母GS115,筛选高拷贝表达株并经甲醇连续诱导4d,将各诱导时间所取的1mL上清经三氯醋酸(Trichloroacetic acid,TCA)浓缩20倍进行SDSPAGE电泳,考马斯亮蓝染色表明,重组BbIFN-γ在毕赤酵母中得到高效表达,并在诱导84h时表达量达到最高(图3),Western blot证实重组BbIFN-γ具有反应原性(图4)。

图3 多拷贝重组酵母表达上清的SDS-PAGEFig.3 SDS-PAGE of supernatants of multicopy recombinant yeast

图4 重组BbIFN-γ酵母表达产物的Western blot检测Fig.4 Detection of recombinant BbIFN-γwith Western blot assay
2.3 水牛IFN-γ抗VSV试验
采用VSV-MDBK系统,利用纯化好的原核表达蛋白和重组酵母表达蛋白BbIFN-γ,检测两种表达系统得到的BbIFN-γ抑制VSV在MDBK细胞增殖的作用并作比较,结果表明原核表达的BbIFN-γ抗VSV病毒效价为2.05×105U/mL,比活性为7.07×105U/mg;酵母表达的BbIFN-γ抗 VSV病毒效价为7.44×105U/mL,比活性为3.13×106U/mg。
2.4 水牛IFN-γ单克隆抗体、多克隆抗体的制备
将纯化的BbIFN-γ蛋白免疫小鼠,4次免疫后,血清中抗BbIFN-γ抗体的ELISA效价高于2.56×104。用纯化的BbIFN-γ蛋白筛选阳性杂交瘤克隆细胞,三次有限稀释克隆后获得5株稳定分泌单克隆抗体的杂交瘤细胞,将其分别命名为1C3、2C3、3E7、4G6和4H4。进一步以杂交瘤细胞诱生小鼠腹水,ELISA 检测1C3、2C3、3E7、4G6和4H4的腹水抗体的效价分别为2.56×104、5.12×104、1.28×104、2.56×104、5.12×104(图5)。染色体计数,SP2/0瘤细胞的染色体平均数为70,脾细胞染色体数为40,而杂交瘤细胞的染色体数目在100~110之间,均高于两亲本细胞的染色体数目,证实这3株细胞均为杂交瘤细胞。通过亚型鉴定,3株单抗均为IgG1型。
同样检测免疫兔的高免血清效价,经过五次免疫的日本大耳白兔,产生的抗BbIFN-γ抗体效价为1.024×105。
2.5 双抗体夹心ELISA方法的建立
2.5.1 单抗最适包被浓度和夹心抗体最适工作浓度的确定 通过固定蛋白浓度,纯化的单抗2C3和纯化后的多抗做方阵滴定,以确定单抗最适包被浓度和夹心抗体最适工作浓度。当蛋白浓度为50 ng/mL时,方阵滴定出现明显的滴定效果。选取OD630nm值大幅下降的孔作为判定孔,将此孔对应的单抗和多抗的前一个稀释浓度,即可判定为它们的工作浓度,确定单抗的包被浓度为125ng/孔,稀释3 816倍(原浓度4.77mg/mL),多抗的工作浓度为125ng/孔,稀释1 680倍(原浓度2.1mg/mL)(表1)。

表1 方阵滴定确定重组水牛IFN-γ抗体的ELISA最佳工作浓度Table 1 Optimization of working concentrations for antibodies to BbIFN-γby crossboard titration with ELISA
2.5.2 双抗体夹心ELISA检测水牛IFN-γ的敏感度 用确定的单抗与多抗的最佳工作浓度做双抗体夹心ELISA,检测BbIFN-γ的敏感度。将单抗稀释3 800倍稀释后按100μL/孔包被(即125ng/孔包被),加入16个浓度梯度的BbIFN-γ,再将多抗1 680倍稀释后按100μL/孔(即125ng/孔)加入,最后加入1∶5 000的羊抗兔的酶标二抗,结果表明,检测BbIFN-γ的敏感度达到125pg/mL。
2.5.3 双抗体夹心ELISA检测水牛IFN-γ的特异性 用确定的水牛IFN-γ单/多克隆抗体最佳工作浓度,分别检测 BovIFN-γ、CerIFN-γ、猴IFN-γ、gG、CE、RCE、70-83-CE、Sip、Sip-Clfa、Gapc等 抗原,结果均为阴性反应,证明五株单抗特异性良好(表2)。
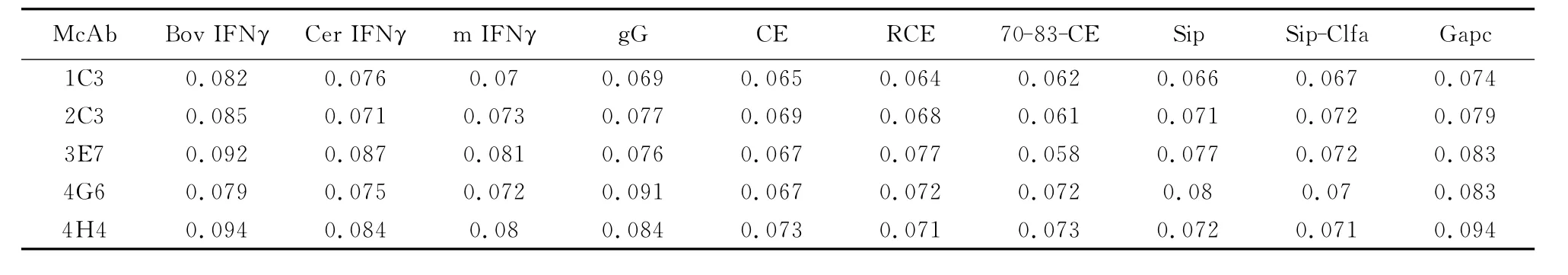
表2 夹心ELISA鉴定重组BbIFN-γ单克隆抗体的特异性Table 2 The specificity of monoclonal antibodies to BbIFN-γdetected by sandwich-ELISA
3 讨 论
酵母表达系统为外源基因在真核细胞中的表达提供了广阔的前景[11]。与原核表达系统相比,酵母能提供更高级的蛋白折叠途径。当使用酵母分泌信号序列时,酵母能直接分泌正确折叠和处理蛋白,表达出来的真核蛋白更加接近天然的蛋白[12]。不过对于酵母表达,许多A+T富含区可作为多腺苷酸或转录终止信号,导致仅产生低水平或截断的mRNA[13],某些稀有密码子也往往成为制约翻译速率的因素。如果基因中存在大量A+T富含区和稀有密码子密集区时,常需要对基因进行偏向于巴斯德毕赤酵母偏爱密码子和有更高的G+C含量的方向进行全基因合成[14]。本试验前期进行诱导表达的是原始序列,在鉴定为正确的转化子的前提下,诱导了几次,发现目的蛋白始终未得到表达,考虑到Bb-IFN-γ的成熟肽序列为富含A+T的基因,且不可避免的含有毕赤酵母稀有密码子,本研究采用了全基因合成,将原始序列改成毕赤酵母偏爱密码子,结果得到高效表达,证明了密码子的偏好性确实对外源蛋白的表达量有很大影响。
本研究采用MDBK-VSV系统分别对大肠埃希菌和毕赤酵母表达的水牛IFN-γ蛋白进行了抗病毒活性比较,发现酵母真核表达产物有很高的抗病毒活性(3.13×106U/mg),高于原核表达产物的活性(7.07×105U/mg),这也与有关报道[15-17]相符合。这很可能是因为原核表达缺乏必要的蛋白折叠修饰和糖基化功能,而酵母经过真核的必要的修饰与加工,表达出来的蛋白更加接近天然IFN-γ的原因。
利用纯化的毕赤酵母表达蛋白免疫小鼠,获得了5株高效价的BbIFN-γ单克隆抗体,建立了检测BbIFN-γ的夹心ELISA,该方法的检测灵敏度达到125pg/mL,灵敏度高且特异性良好。因此,该方法可望进一步用于水牛结核病和其他疫病的诊断,为定量检测水牛IFN-γ试剂盒的研制和水牛结核病的检测和控制奠定了基础。
[1] Mustafa A S,Lundin K E A,Oftung F.Human T cells recognize mycobacterial heat shock proteins in the context of multiple HLA-DR molecules:studies with healthy subjects vaccinated with Mycobacterium bovis BCG and Mycobacterium leprae[J].Infect Immun,1993,61:5294-5301.
[2] Waters W R,Sacco R E,Fach S J,et al.Analysis of mitogenstimulated lymphocyte subaset proliferation and nitric oxide production by periphral blood mononuclear cells of captive elk(Cervus elaphus)[J].J Wildlife Dis,2002,38(2):344-351.[3] Kösters K,Nau R,Bossink A,et al.Rapid diagnosis of CNS tuberculosis by a T-cell interferon-gamma release assay on cerebrospinal fluid mononuclear cells[J].Infection,2008,36(6):597-600.
[4] Brodie D,Lederer D J,Gallardo J S,et al.Use of an interferon-gamma release assay to diagnose latent tuberculosis infection in the foreign-born patients[J].Chest,2008,133(4):869-874.
[5] Ariga H,Kawabe Y,Nagai H,et al.Diagnosis of active tuberculous serositis by antigen-specific interferon-gamma response of cavity fluid cells[J].Clin Infect Dis,2007,45(12):1559-1567.
[6] Beamer G L,Flaherty D K,Vesosky B,et al.Peripheral blood interferon-gamma release assays predict lung responses and Mycobacterium tuberculosis disease outcome in mice[J].Clin Vac Immunol,2008,15(3):474-483.
[7] 李 川,谭亚娣,胡巧云,等.牛IFN-γ原核表达、单克隆抗体制备及其ELISA检测方法的建立[J].生物工程学报,2007,23(1):40-45.
[8] 冯 镇,张兰威.小牛凝乳酶原基因在乳酸克鲁维酵母中的表达及遗传稳定性研究[J].食品科学,2008,29(7):297-302.
[9] 杜 平.医用干扰素学[M].北京:解放军出版社,1985.
[10] 周 玉,李岩松,潘风光,等.小鼠腹水IgG类抗体纯化方法的研究[J].黑龙江畜牧兽医,2006(10):14-16.
[11] 周 鹏,郭安平,沈文涛,等.毕赤氏酵母SMD1168/HuIFNα-2b分泌型表达的研究[J].药物生物技术,2003,10(5):287-291.
[12] 陈利弘.人源化抗CTLA-4单链抗体及其免疫毒素融合蛋白的表达与纯化研究:原核大肠杆菌与真核毕赤酵母表达系统[D].四川雅安:四川大学硕士学位论文,2006.
[13] 赵 翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J].生物工程学报,2000,16(3):308-311.
[14] Cregg J M,Tschopp J F,Stillman C,et al.High level expression and efficient assembly of hepatitis B surface antigen in the methylotrophic yeast,Pichia pastoris[J].Biotechnology,1987,5(4):479-485.
[15] Wedlock D N,Doolin E E,Parlane N A,et al.Effects of yeast expressed recombinant interleukin-2and interferongamma on physiological changes in bovine mammary glands and on bactericidal activity of neutrophils[J].Dairy Res,2000,67(2):189-197.
[16] Raggo C,Habermehl M,Babiuk L A,et al.The in vivo effects of recombinant bovine herpesvirus-1expressing bovine interferon-gamma[J].Gen Virol,2000,81(11):2665-2673.
[17] Murakami K,Uchiyama A,Kokuho T,et al.Production of biologically active recombinant bovine interferon-gamma by two different baculovirus gene expression systems using insect cells and silkworm larvae[J].Cytokine,2001,13(1):18-24.

