牛支原体临床分离株牛体毒力和免疫原性比较
张 瑞,崔 朋,巴晓亮,汪 漫,
韩潇潇1,2,祁晶晶1,2,彭清洁2,陈 曦1,2,胡长敏1,2,陈颖钰3,郭爱珍1,2*
(1.华中农业大学农业微生物国家重点实验室,湖北武汉430070;2.华中农业大学动物医学院,湖北武汉430070;3.华中农业大学动物科技学院,湖北武汉430070)
牛支原体是严重危害肉牛和奶牛养殖业的常见病原体之一。在长途运输后的育肥架子牛,牛支原体主要导致肺炎,常继发关节炎、角结膜炎等多种症状;在奶牛,主要致乳腺炎,也可致犊奶牛肺炎和关节炎等[1-3]。在临床上,牛支原体常与多杀性巴氏杆菌A型、溶血曼氏杆菌等病原混合感染,使临床症状复杂化,加大治疗难度。
牛支原体于1961年在美国首次从乳腺炎牛奶中分离获得[4]。我国直到2008年才受到重视,主要因为该病原导致肉牛运输后暴发牛支原体肺炎[5-6]。2011年和2012年先后完成了2株牛支原体基因组测序[7-9],并建立了一系列临床诊断方法[10-12]。虽然牛支原体感染给全世界肉牛和奶牛养殖业带来了巨大的经济损失,但临床上一直缺乏有效的防控手段。这与牛支原体在牛体持续存在、条件性致病、对常用抗生素不敏感、易产生耐药性、致病机制和免疫机制不清楚、缺少实验动物模型等有关[12]。鉴于疫苗是预防传染病的重要手段,本研究通过牛体感染试验比较4株牛支原体临床分离株的毒力和免疫原性,从中筛选免疫原性良好的菌株作为候选疫苗的备选菌株,为研发牛支原体疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 PPLO培养基为BD公司产品;SABC染色试剂盒、DAB显色剂为武汉博士德生物有限公司产品。
1.1.2 试验菌株和动物 3株牛支原体临床分离株分别 为 ZMD100731(ZMD 株)、EZ080710 (EZ株)、XY090807(XY株),均为华中农业大学-农业微生物国家重点实验室从临床发病牛肺病料中分离获得,并经生化鉴定和16SrRNA序列鉴定。参考菌株 Mycoplasma bovis PG45(ATCC®25523TM)(简称PG45株)为美国微生物菌种保藏中心保存。6月龄左右本地黄牛15头,购自湖北松滋春珍肉牛养殖场,经ELISA检测为血清牛支原体抗体阴性,牛体感染试验在该养殖场进行。
1.2 方法
1.2.1 动物感染试验 15头牛分为5个组,4个感染组分别命名为ZMD、PG45、EZ和XY组,每组3头牛,空白对照组3头牛。感染组每头牛每天气管注射菌液10mL,连续注射3d,每株菌的菌液浓度为109cfu/mL。空白对照组注射等量培养基。观察牛体临床症状,定期采血检测血清免疫反应参数;定期采集鼻拭子,通过分离培养确定牛支原体排出情况;22d后扑杀,观察大体病理变化和肺部组织病理变化,并用免疫组化方法检测肺和肺淋巴结的牛支原体抗原含量。
1.2.1.1 体温变化 感染前和感染后每天上午8:00(进食前)对各组牛的直肠温度进行测量并记录。
1.2.1.2 体重变化 分别在感染前及扑杀前用电子台秤对各组试验动物称重。
1.2.1.3 鼻拭子采集和鼻腔排菌检测 操作方法如下:用已灭菌的棉签插入牛鼻腔深部拭取鼻液,然后将棉签放入含有2mL灭菌PBS离心管中,充分涡旋混匀。之后,使用注射器吸取离心管中的悬液,用0.45μm孔径滤器过滤,取0.1mL滤液置入PPLO培养基中扩大培养,并进行牛支原体uvrC基因的 PCR 检测[10]。
1.2.1.4 血液免疫学指标检测 定期采血,检测血常规和血清免疫学反应。操作方法如下:从试验牛颈静脉采取5mL血,2mL加入EDTA-K2抗凝管内,轻微摇晃,在12h内送入实验室进行血常规检测(poch-100ivd血常规仪,日本Sysmex公司)。同时将另外3mL血液加入不含抗凝剂的试管内,常温下凝固,4℃过夜后,4 000r/min离心10min,收集血清,分装后置于-80℃保存备用。血清免疫学反应检测指标包括IgG、IgA、TNF-α和IFN-β的含量。
1.2.2 病理变化检测
1.2.2.1 大体病理变化观测 感染后22d处死各试验组牛,观察各内脏组织器官、肺淋巴结和扁桃体的大体病理变化情况,并对组织损伤情况、肺组织病变及淋巴结病变等进行评分,评分标准参照文献[11]。
1.2.2.2 病理组织学观测 动物解剖后,采集肺脏、肺淋巴结等器官(约1cm3大小),立即放入100 mL/L中性福尔马林固定液中固定,并送至谷歌生物公司进行病理组织切片的制作和苏木素-伊红(Hematoxylin-eosin,HE)染色,光学显微镜下观察组织病理变化。
1.2.3 免疫组化检测和分析 参照免疫组化试剂盒(SABC)的产品说明书及参考文献[7]进行,简述如下:组织切片脱蜡水化后,用30mL/L H2O2处理以消除切片组织内源性过氧化物酶的活性;之后进行微波修复,50mL/L BSA封闭切片30min,滴加一抗(实验室自制的牛支原体单克隆抗体)[7,14],4℃过夜;取试剂盒中的二抗滴加到组织上孵育30 min;取试剂盒中的B、C、A三种显色液按次序各取1滴于1mL单蒸水中,混匀后滴加到切片上,室温下显色,边显色边观察;再用Harris苏木素复染2s~3s,自来水冲洗10min;最后脱水透明和封片,在光学显微镜下观察和分析结果。
利用Image-Pro Plus 6.0图像分析软件(Media Cybernetics,美国)于光镜下采集40×10放大倍数下的图像,每张切片采集6张图像。用IPP6.0软件对图像进行累计光密度(IOD)计算,用SPSS软件包进行各组间的统计分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 临床症状
感染前,试验各组动物均无明显临床症状,在感染后10d,除对照组外其他各组相继均出现鼻腔黏膜黏液分泌增多、眼部分泌物增多、厌食和精神倦怠,XY组和ZMD组有个别牛出现咳嗽的症状。
2.1.1 体温变化 感染前各组体温均在正常值范围内,感染组大部分牛在感染后第2天即出现体温上升(0.5℃~1℃),维持3d~5d左右后下降至正常水平。对照组体温无明显波动,均在正常范围内(图1)。

图1 感染组和对照组体温变化比较Fig.1 Comparison of temperature fluctuation of the infected groups and control group
2.1.2 体重变化 和对照组比较,感染组牛的体重增长受到不同程度的影响:ZMD组、PG45组和EZ组牛虽然增重有变慢趋势,但都有增长,且体重增加比例与对照组比较均无统计学差异(P>0.05);然而XY组的牛体重却出现了明显的下降,呈现负增重,其增重比例与对照组比较差异极显著(P<0.01),与其他感染组比较差异显著(P<0.05)(图2)。

图2 感染组与对照组体重增加百分比比较Fig.2 Comparison of the weight gain percentage for each group
2.2 血液分析
收集感染前1d和感染后1、3 、5、7、9、15d试验动物血液,进行血常规分析,并对白细胞总数进行统计,将各组中白细胞总数大于1.2×109/L并且中性粒细胞百分率大于48.26%的牛的总数进行了统计,结果表明,XY组的牛在感染后,全部3头牛血液白细胞总数和中性粒细胞百分率都出现了明显的增高,表明本组牛机体的炎症反应最严重;在PG45和EZ两组中,感染牛中都有2头牛的血液中白细胞总数和中性粒细胞百分率出现较明显的增高;ZMD组的牛中只有1头牛的血液中的白细胞总数和中性粒细胞百分率出现明显的增高,表明这组牛的感染程度最轻。此结果表明,XY组的牛炎症反应最为严重,在感染后1d白细胞和中性粒细胞急剧升高,且这种情况一直持续到最后一次检测(表1)。

表1 感染牛白细胞和中性粒细胞变化头数Table 1 The change of leucocytes and neutrophils amount groups of in fected cattle 头
2.3 试验动物排菌情况
在感染前和感染后1、4、7、10、15、18、21d分别采集各组牛鼻拭子进行细菌分离培养和牛支原体的uvrC基因的PCR扩增,每个感染组27个感染后样本。对细菌分离培养和牛支原体的uvrC基因的PCR扩增同时为阳性的记为阳性。检测结果表明,每头感染牛都有阳性样本,但感染牛呈间歇性排菌(表2),对照组和感染组感染前样本检测均为阴性。各感染组的阳性样本检出率由大至小分别为:PG45组47% (10/21),XY 组 38% (10/21),ZMD 组43%(7/21),EZ组28%(6/21)。随着接种时间的延长,各感染牛呈现出间歇性排菌的情况。

表2 各感染组鼻拭子的牛支原体检测结果Table 2 The results of Mycoplasma bovis detection from nasal swabs in all the groups
2.4 病理变化
2.4.1 动物剖检变化 解剖后观察试验动物肺部病变,对照组肺部组织肉眼观察均正常,无明显病理性损伤,感染组肺部组织眼观出现明显的损伤,包括肺部的实变,与胸腔大面积粘连和胸腔积液。同时对肺部眼观病变进行35分制评价,将肺部分为7叶,分别为左尖叶、左心叶、左前叶、右尖叶、右心叶、右膈叶和右附叶,并进行累计。计分标准如下:无肉眼可见的损伤变化,计0分;无表面损伤但切面有明显的损伤,计1分;少于5处直径<10mm的损伤,计2分;多于6处直径<10mm的损伤或1处>10 mm的损伤,计3分;多于1处直径>10mm的损伤,计4分;大量凝固性损伤,计5分。XY组的病理损伤分值最高,为23分;PG45为21分,ZMD组为19分;EZ组为18分;对照组为7分(表3);除EZ组外,其余几组感染牛都不同程度地表现出肺组织与胸腔粘连现象,ZMD组牛有相对较多的胸腔积液。
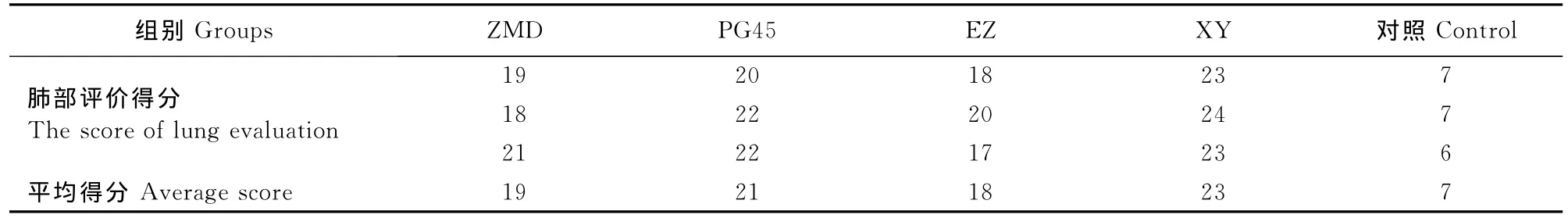
表3 各组肺部评价得分Table 3 The score of lung evaluation in each group
2.4.2 病理组织学检测 通过显微镜下观察各组牛的肺组织病理学切片,发现XY组和PG45组的感染牛的病理切片病变较严重,而ZMD组和EZ组的病变较轻微,其中XY组的病变最严重。XY组牛肺组织肺泡壁增厚,有上皮细胞坏死,中性粒细胞浸润,大量巨噬细胞;PG45组肺组织肺泡腔内有浆液和细胞渗出,有些区域可见坏死及出血;肺淋巴结皮质部呈星空状,布满巨噬细胞,淋巴小结明显,内有核深染细胞,类似凋亡细胞。ZMD组肺间质增厚,肺毛细血管扩张淤血,局部肺泡腔内有坏死细胞,支气管周围淋巴细胞增生;EZ组肺支气管周淋巴细胞增生,局部区域肺泡壁增厚(图3)。
2.5 牛支原体的免疫组化检测结果
各组切片经过DAB显色后,在光学显微镜下可观察到肺组织内阳性信号主要集中在细支气管的上皮细胞及气管黏膜上。淋巴结组织内的阳性信号主要是在巨噬细胞的胞浆内(图4)。对淋巴结组织的免疫组化染色进行半定量分析,比较各组的IOD值,结果显示XY组的IOD值最高,EZ组的次之,ZMD组及PG45组最低。其中XY组与ZMD组的IOD值间具有统计学差异(P<0.05),XY组与PG45组、XY组与EZ组间差异不显著(P>0.05),各感染组与对照组间统计学差异极显著(P<0.01)(图5)。

图3 各试验牛肺部病理组织学切片观察(HE染色)Fig.3 Histopathologic observation of lung sections in each group(HE stain)

图4 肺组织和淋巴结组织切片的免疫组化结果Fig.4 Immunohistochemical staining of lung sections and lymph node sections

图5 淋巴结免疫组化半定量分析(IOD)Fig.5 The half quantitative analysis of lymph node by immunohistochemistry
2.6 免疫反应
检测试验动物感染前、后7、14、21d血液中IgG和IgA抗体的含量,包被抗原为自制牛支原体全菌蛋白(0.5μg/mL,每孔100μL,4℃过夜),二抗为羊抗 HRP标记IgG 和IgA(Southern biotech company),同时检测攻毒前和攻毒后1、5、7d试验动物血液中IFN-β的含量,选用武汉优尔生公司生产的牛IFN-βELISA试剂盒。检测结果发现,感染组血液中IgG抗体水平呈显著上升趋势,其中XY组抗体水平高于其他组,其次EZ组,对照组IgG抗体水平无明显变化。感染组中血液IgA抗体水平在攻毒后有略微的上升。感染组血液中细胞因子IFN-β水平在攻毒后5d和7d显著上升,其中XY组在5d和7d与对照组比较统计学上极显著(P<0.01)(图6)。
TNF-α试剂盒的检测限为100pg/mL,所有样本的TNF-α含量均在检测线以下,未检出。

图6 血液中IgG、IgA和IFN-β水平检测Fig.6 The detection of IgG,IgA and IFN-βlevels in blood in each group
3 讨论
虽然支原体在各种动物体内广泛存在,并且是多种动物的病原体,但该病原的宿主嗜性具有种属特异性。作者将牛支原体感染常见的试验动物,包括小鼠、豚鼠、兔等都未获成功,说明牛支原体具有严格的宿主特异性。缺少试验动物模型可能是阻碍牛支原体相关研究的重要原因之一。
本研究采用连续3d气管内攻菌方式进行牛支原体的牛体人工感染试验,从临床症状、大体病理变化、组织病理变化和免疫组化等证实,通过该途径人工接种牛支原体能成功复制牛支原体肺炎。在连续攻菌后,感染组均相应出现,如体温的升高,鼻液分泌的增多,然而临床症状然而感染牛的肺炎症状较临床病例轻得多,这可能与多种因素有关,如临床病例多发生在长途运输应激后,运输应激起了加强作用;临床病例多呈混合感染,其他病原如多杀性巴氏杆菌A型等对发病起了促进作用[15]等。
对试验动物称重发现,感染组体重的增长均比对照组要偏低,尤其XY组,出现负增长的情况,表明牛支原体会对宿主的生长性能造成明显的影响,这自然潜伏感染牛支原体对生长性能的影响相一致。血液检测发现,攻菌后,白细胞和中性粒细胞值均高于正常值范围,表明两者在抵抗牛支原体的感染中起着相互协同的作用。
通过鼻拭子对感染动物排菌情况发现,各组排菌均呈现间断性排菌,无明显差异。且在21d还能检测到排菌,显示和自然感染牛支原体的牛均可长期间断性排菌,这就为牛支原体的监测与控制带来了很大的困难[16]。
处死后眼观肺部病理变化并对肺部进行打分评价,感染牛支原体后,可以引起肺部实变与胸腔大面积粘连和胸腔积液,其中XY引起肺部眼观病理变化最为明显,其次为PG45组,同时在病理组织学切片中得到了证实,XY组肺组织肺泡壁增厚,有上皮细胞坏死,中性粒细胞浸润,呈典型牛支原体初期肺部病理变化。
通过免疫组化对牛支原体抗原进行定位、定量发现,牛支原体抗原主要集中在细支气管的上皮细胞及气管黏膜上,随着感染时间的推移进入肺泡,造成肺泡的塌陷与坏死[17]。且XY组IOD值最高,说明在肺部定殖的菌量最多,感染能力也就越强。
感染牛支原体初期,IgG和IFN-β上升趋势明显,XY组lgG上升水平最高,且可以诱导高水平的细胞因子IFN-β。而IgA水平各组均上升不明显,可能是在血液中IgA含量偏低。表明体液免疫与细胞免疫在抵抗牛支原体的感染起到共同的作用。
利用牛体感染模型发现,牛支原体临床分离株的毒力具有明显差异。本研究综合各项评价指标,认为XY株毒力最强,其次是ATCC参考株PG45。同时,免疫学检测发现,XY株能在牛体诱导较好的免疫反应,在动物机体内产生较高水平的抗体IgG和细胞抗炎因子IFN-β。因此,XY株有望作为灭活疫苗的候选菌株。动物致病模型对病原体致病免疫机理研究和防控技术研究具有重要意义,本研究建立的牛体感染模型为牛支原体相关研究提供了技术支持。
[1] Nicholas R A.Bovine mycoplasmosis:silent and deadly[J].Vet Rec,2011,168(17):459-62.
[2] Caswell J L,Archambault M.Mycoplasma bovis pneumonia in cattle[J].Anim Health Res Rev,2007,8(2):161-86.
[3] Castillo-Alcala F,Bateman K G,Cai H Y ,et al.Prevalence and genotype of Mycoplasma bovis in beef cattle after arrival at a feedlot[J].Am J Vet Res,2012,73(12):1932-1943
[4] Hale H H,Hemboldt C F,Plastridge W N.Bovine mastitis caused by aMycoplasmaspecies[J].Cornell Vet,1962,(52):582–591.
[5] 石 磊,龚 瑞,郭爱珍,等.肉牛传染性牛支原体肺炎流行的诊断[J].华中农业大学学报,2008(5):629-633.
[6] 胡长敏,彭清洁,郭爱珍,等.一例奶牛发生牛支原体肺炎的诊断[J].中国奶牛,2011(2):1-3
[7] Qi J,Guo A,Cui P,et al.Comparative geno-plasticity analysis of Mycoplasma bovis HB0801 (Chinese isolate)[J].PLoS One,2012,7(5):e38239
[8] Li Y,Zheng H,Song Z.The complete genome sequence of Mycoplasma bovis strain Hubei-1[J].PLoS One,2011,6(6):e20999
[9] Wise K S,Calcutt M J,Foecking M F,et al.Complete ge-nome sequence of Mycoplasma bovis type strain PG45(ATCC 25523)[J].Infect Immun,2011,79(2):982-983
[10] Bai Z D,Shi L,Guo A Z,et al.Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of Mycoplasma bovis[J].Afr J Biotechnol,2011,10(57):12333-12338
[11] Vordermeier H M.Viral booster vaccines improve Mycobacterium bovis BCG-induced protection against bovine tuberculosis[J].Infection immunity,2009,(77):3364-3373
[12] Cai H,Bell-Rogers P,Parker L,et al.Development of a real-time PCR for detection of Mycoplasma bovis in bovine milk and lung samples[J].J Vet Diagn Invest,2005,(17):537-545.
[13] 胡长敏,石 磊,郭爱珍,等.牛支原体病研究进展[J].动物医学进展,2009,30(8):73-77.
[14] 任泽民,姜 勇,郭爱珍,等.牛支原体单克隆抗体的制备与鉴定[J].中国畜牧兽医,2012,39(7):58-61.
[15] 肖淦文,彭清洁,郭爱珍,等.肉牛牛支原体肺炎感染的细菌学研究[J].中国牛业科学,2012(3):22-26.
[16] 郭爱珍.牛呼吸疾病综合征及其防治[J].中国奶牛,2011(24):7-11.
[17] Adegboye D S.Mycoplasma bovis-associated pneumonia and arthritis complicated with pyogranulomatous tenosynovitis in calves[J].J Am Vet Med Assoc,1996,209:647-649.

