肠炎沙门菌fliC蛋白的表达及ELISA 检测方法的建立
邓显文,谢芝勋,刘加波,谢志勤,庞耀珊,谢丽基,范 晴,罗思思
(广西兽医研究所 广西畜禽疫苗新技术重点实验室,广西南宁530001)
肠炎沙门菌是目前引起人类食物中毒的主要病原之一,其感染主要是因食用了被肠炎沙门菌(Salmonella Enteritidis)污染的动物性食品,尤其是家禽的肉蛋食品,近年来,肠炎沙门菌食物中毒和动物感染肠炎沙门菌十分严重,已引起畜禽防疫和公共卫生界的高度重视[1-4]。目前应用PCR技术对SE的检测已有报道[5-7],PCR检测方法虽然快速、敏感性较高,但只是对病原DNA检测。ELISA是当前生产中应用最广泛的血清学检测方法,具有特异、快速、简便、敏感性高等特点[8-10]。本研究利用PCR方法扩增SE的fliC基因主要抗原区,连接于表达载体pGEX-4T-1中,构建成重组质粒pGEX-fliC,融合表达了重组鞭毛蛋白,初步建立了flic-ELISA检测肠炎沙门菌抗体的方法,为给临床检测肠炎沙门菌提供一种敏感度高、特异性强的血清学方法。
1 材料与方法
1.1 材料
1.1.1 菌种 肠炎沙门菌(SE28、SE29、SE30、SE75、SE90、SE221、SE635)、伤 寒 沙 门 菌(S.typhi)、副伤寒沙门菌(S.parutyphi)、鸡沙门菌(S.pullerium)由美国康州大学Khan教授惠赠,马流产沙门菌(CVCC514)、肠炎沙门菌(CVCC2182、CVCC2184)、猪霍乱沙门菌(CVCC2179)、伤寒沙门菌(CVCC2213)、雷丁沙门菌(CVCC2210)、甲型副伤寒沙门菌(CVCC2189)、鼠伤寒沙门菌(CVCC2233)、肠 炎 沙 门 菌 亚 种 (CVCC3374、CVCC3375、CVCC3377、CVCC3378)由中国国家兽医微生物菌种保藏管理中心购买;鸡毒支原体(IC)、传染性鼻炎(IC)、禽流感病毒(AIV)、鸡新城疫病毒(NDV)阳性血清,载体pMD18-T,受体菌DH5α,均由本实验室保存。
1.1.2 主要试剂 96孔酶标板,羊抗鸡IgGHRP,BSA及四甲基联苯胺(TMB)为晶美生物工程有限公司产品。
1.2 方法
1.2.1 肠炎沙门菌鞭毛蛋白的克隆及鉴定 根据肠炎沙门菌fliC基因设计合成了一对引物,引物的5′端分别含有EcoRⅠ和XhoⅠ酶切位点,扩增的目的片段长为285bp。fliC1:5′-CCAGGAATTCACTAAATCTACTGCTGGTACCGC-3′;fliC2:5′-CCGCTCGAGTTATCATCAAAAGTAAACTGACCGT-3′。将纯化后的SE28-filC基因酶切产物克隆到pGEX-4T-1,转化至 DH5α感受态细胞中,经过PCR、双酶切鉴定和测序分析获得阳性重组质粒pGEX-filC。
1.2.2 重组蛋白的表达纯化及 Western blot分析蛋白活性 用IPTG诱导测序正确的重组质粒pGEX-fliC培养表达重组蛋白,用SDS-PAGE分析表达产物。利用谷胱甘肽亲和的方法,纯化重组蛋白,用紫外分光光度计检测重组蛋白质浓度,进行Western blot检测,验证蛋白的反应原性。
1.2.3 重组蛋白ELISA检测方法的建立
1.2.3.1 血清的制备 分别用纯化的pGEX-fliC重组蛋白(最终含量为1mg/只)、甲醛灭活的肠炎沙门菌的13株和其他血清型沙门菌10株(菌含量4×106/mL)与等量的弗氏完全佐剂或弗氏不完全佐剂混合,分别免疫14日龄SPF鸡,0.4mL/只,每个血清型免疫3只,共计SPF鸡72只,2周后将弗氏完全佐剂改为弗氏不完全佐剂进行第2次免疫,免疫后2周采血,分离血清即为免疫血清。
1.2.3.2 抗原最佳包被浓度和血清最佳稀释度的选择 采用双方阵试验:用0.05mol/L碳酸盐缓冲液(pH 9.6)把纯化的重组蛋白(浓度为30mg/mL)作稀释后分别为0.02、0.01、0.008、0.006、0.004、0.002、0.001、0.000 5、0.000 2、0.0mg/mL,包被反应板100μL/孔,37℃孵育0.5h后4℃过夜。将包被好的酶标板倒去孔内液体,PBS-T洗涤3次后,用50g/L的脱脂奶封闭液37℃封闭0.5h,阳性血清及SPF鸡阴性血清分别用10g/L的BSA稀释50、100、200、400倍,与重组蛋白不同稀释度组成方阵,100μL/孔。37℃孵育1h,PBS-T洗涤3次后加入稀释好的酶标抗体HRP-羊抗鸡IgG(3 000倍稀释)100μL/孔,37℃孵育1h,洗涤后加入新鲜配制的显色液100μL/孔,显色10min,加50μL终止液。在酶标仪上读出OD450nm数值,比较阴、阳性血清的OD值,以阳性OD450nm值接近1.0,阴、阳血清光吸收值差最大的血清最高稀释倍数为最适血清稀释度,所对应的抗原稀释度为抗原的最佳稀释度。
1.2.3.3 重组抗原包被条件的确定 以最适抗原浓度包被酶标板,100μL/孔,在37℃分别包被0.5、1.0、1.5、2.0h后4℃过夜;以50g/L脱脂奶封闭进行ELISA,在酶标仪上读出OD450nm值,比较阴阳性血清的OD450nm值,以P/N值最大的包被条件为最佳。
1.2.3.4 血清最适作用时间的选择 以最适抗原浓度包被酶标板,阳性血清做1∶100稀释,分别作用30、60、90、120min,每组各设3个阴性和阳性对照,按间接ELISA程序进行,选取阳性OD450nm值在1.0附近,P/N比值最大的一组作为最适血清作用时间。
1.2.3.5 酶标二抗最适作用时间的选择 以最适抗原浓度包被酶标板,阳性血清做1∶100稀释,作用60min,酶标二抗1∶3 000稀释后,分30、60、90、120min的时间试验组,每组各设3个阴性和阳性对照。按间接ELISA程序进行,选取阳性OD450nm值在1.0附近,P/N比值最大的一组作为最佳的二抗作用时间。
1.2.3.6 确定底物显色时间 用抗原包被好的反应板,按照前面设定的ELISA程序依次包被、封闭、加入阴、阳性血清,再和酶标二抗反应60min之后加底物显色,在室温条件下不同时间(5、8、10、15 min)内测定它们的OD450nm值。选取P/N比值较大,阳性OD450nm值在1.0附近,阴性OD450 nm值较小的一组作为最佳的底物显色时间。
1.2.3.7 阴、阳临界值的确定 用建立的flic-ELISA方法,分别检测SPF鸡阴性血清50份,测定OD450nm值,对结果进行统计学分析。计算平均值(¯X)和标准差(SD),按照公式:¯X+3SD 计算阳性和阴性判定标准。
1.2.3.8 特异性试验 用纯化的重组蛋白包被抗原,分别选用与肠炎沙门菌的13株和其他血清型沙门菌10株及鸡毒支原体(IC)、传染性鼻炎(IC)、禽流感病毒(AIV)、鸡新城疫病毒(NDV)阳性血清反应,按照ELISA程序检测其特异性。
1.2.3.9 敏感性检验 将SE阳性血清分别做1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶640、1∶1 280倍稀释,用建立的flic-ELISA方法进行检测。
1.2.3.10 重复性检验
1.2.3.1 0.1 批内重复试验 在用同批次纯化的重组蛋白作为抗原,加入随机抽取的20份SE阳性血清,用建立的flic-ELISA方法进行检测,隔天检测1次,共检3次,用统计学分析其结果。
1.2.3.1 0.2 批间重复试验 在用3个不同批次纯化的重组蛋白作为包被抗原,加入随机抽取的20份SE阳性血清,用建立的flic-ELISA方法进行检测,其结果用统计学分析。
1.2.4 flic-ELISA 方法的应用 用建立的flic-ELISA方法检测90份广西某鸡场未接种过SE的血清样品。
2 结果
2.1 肠炎沙门菌鞭毛蛋白的克隆及鉴定
本试验用肠炎沙门菌SE28经过PCR扩增的fliC基因片段在285bp左右,用EcoRⅠ、XhoⅠ双酶切纯化后克隆到PGEX-4T-1,经过PCR、双酶切鉴定和测序分析获得重组的表达质粒pGEX-filC,与理论值相符(图1)。
2.2 重组蛋白的表达纯化及 Western blot分析蛋白活性
经1.5mmol/L ITPG诱导后,重组表达质粒的表达产物进行SDS-PAGE电泳分析,结果重组蛋白大小约为37ku,以水溶性形式表达,与预期结果相符合(图2)。采用谷胱甘肽亲和回收纯化后的filc重组蛋白经 Western blot检测,目的条带明显、清晰,能与标准阳性血清反应,说明重组蛋白具有良好的反应原性(图3)。

图1 PCR和酶切鉴定Fig.1 PCR and enzyme digestion identification

图2 pGEX-fliC在大肠埃希菌中的表达Fig.2 pGEX-fliC expressed in E.coli
2.3 重组蛋白ELISA检测方法的建立
2.3.1 间接ELISA反应条件的优化 重组蛋白ELISA方阵试验结果(表1)可知当蛋白浓度为0.01 mg/mL时,其阳性OD450nm值接近1.0且阴、阳数值之比(P/N)比值最大为20.5,此时血清为100倍稀释。因此可以确定重组蛋白ELISA抗原的最佳浓度为0.01mg/mL,血清的最适稀释度为100倍。通过对各反应条件的优化,最终确定抗原的包被条件为37℃作用0.5h后4℃过夜;封闭液为50 g/L脱脂奶,封闭时间为0.5h;血清最佳作用时间为1h,酶标二抗最佳工作浓度1∶3 000倍稀释,作用时间为1h,底物作用时间为10min。

图3 pGEX-fliC Western blot分析Fig.3 Western blot analysis of pGEX-fliC
2.3.2 ELISA 程序确定 pGEX-fliC蛋白以最佳包被浓度包被酶标板,100μL/孔,37℃作用0.5h后4℃过夜,包被液甩干后,PBST洗涤3次,加50 g/L的脱脂奶200μL/孔,37℃封闭0.5h,PBST洗涤3次,各孔加入100μL一抗血清,37℃作用1h,PBST洗涤3次~5次,加入1:3 000倍稀释的酶标二抗羊抗鸡IgG,100μL/孔,37℃作用1h,PBST洗涤3次~5次,以TMB显色10min,最后加入2 mol/L的硫酸终止反应。酶标仪上以OD450nm读数。
2.3.3 间接ELISA阴、阳性临界值的确定 用已建立的flic-ELISA方法检测50份SPF鸡肠炎沙门菌阴性血清,计算50份SPF鸡肠炎沙门菌阴性血清OD450nm值的平均值(X)为0.103,标准差(SD)为0.047,按照公式:X+3SD确定flic-ELISA的阴阳临界值为:0.243,即确定当用flic-ELISA方法检测时,OD450nm>0.243可判断为阳性,OD450nm<0.243则为阴性。
2.3.4 特异性试验 由表7可见肠炎沙门菌13株(SE28~CVCC3378)阳性血清反应的OD450nm值均大于0.243,flic-ELISA试验判定为阳性,而其他菌 (毒 )10 株 (S.typhi-NDV)阳 性 血 清 反 应 的OD450nm值均小于0.243,flic-ELISA 试验判定为阴性,说明该flic-ELISA方法具有较好的特异性。
2.3.5 敏感性试验 用所建立的flic-ELISA方法检测SE阳性血清,结果显示,当阳性血清稀释到1∶160时,OD450nm值高于临界值,稀释到1∶320时,OD450nm值低于临界值。
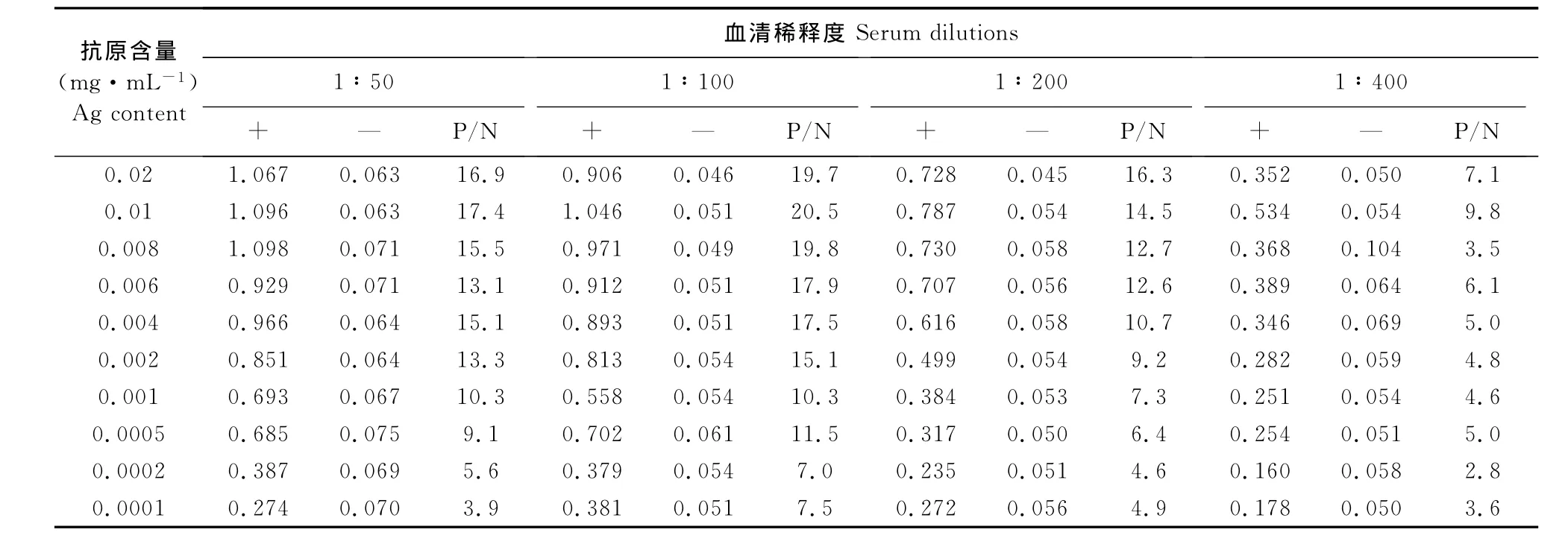
表1 重组抗原最佳包被浓度和最佳血清稀释度的确定Table 1 Determination of the optimum coating concentration of recombinant antigen and optimum serum dilution
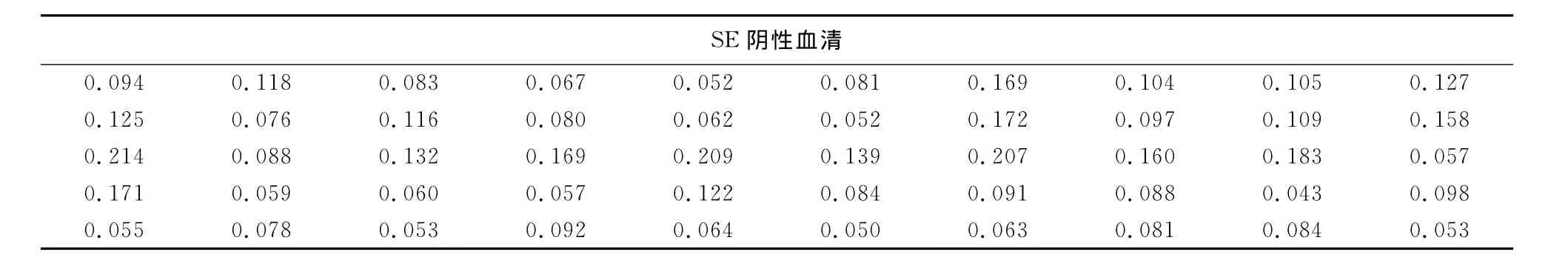
表2 flic-ELISA检测50份SE阴性血清结果(OD450nm)Table 2 The detection results of 50SE negative sera with flic-ELISA methods(OD450nm)
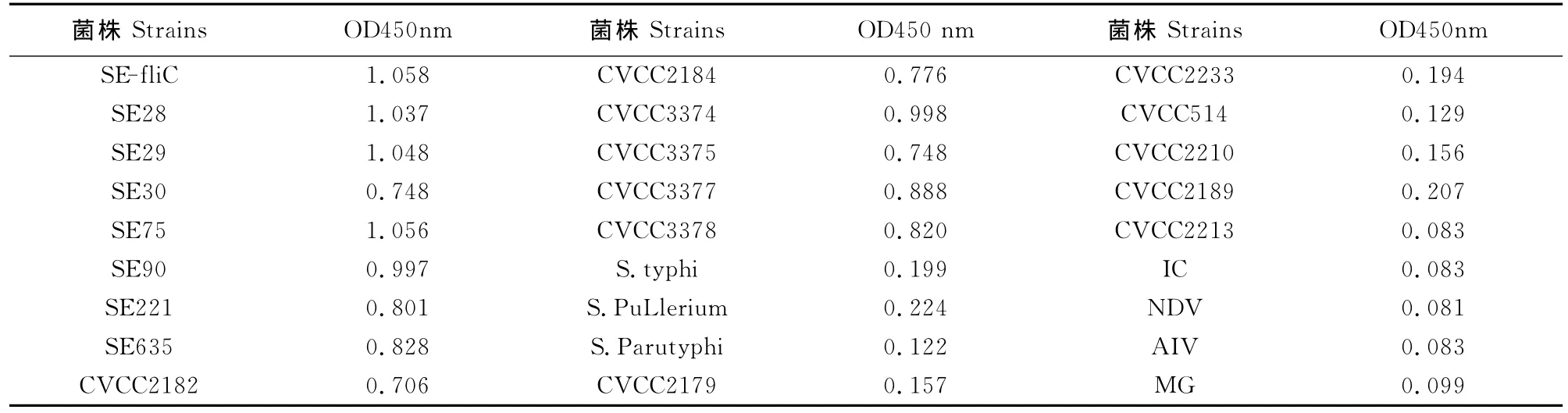
表3 flic-ELISA特异性试验结果Table 3 The specificity test results of flic-ELISA
2.3.6 重复性试验
2.3.6.1 批内重复性试验 用同批次抗原和试剂在3个不同的时间内对20份阳性血清进行重复性检测,变异系数在1.7%~2.5%之间,均小于2.5%。
2.3.6.2 批间重复性试验 用不同批次抗原和试剂对20份阳性血清进行重复性检测,变异系数在2.1%~3.8%之间,均小于3.8%。
2.4 flic-ELISA方法的应用
以flic-ELISA方法检测90份广西某鸡场未接种过SE疫苗的血清样品,结果显示间接ELISA的检出21份阳性,阳性率为23.3%,说明肠炎沙门菌普遍存在于鸡群中。
3 讨论
肠炎沙门菌鞭毛蛋白(flic)是肠炎沙门菌鞭毛的主要结构蛋白,该蛋白是H抗原蛋白,含有大量的抗原表位,能够诱导产生肠炎沙门菌鞭毛蛋白的中和抗体,可以用重组鞭毛蛋白做抗原检测抗体水平,本试验用肠炎沙门菌SE28经过PCR扩增的fliC基因片段在285bp左右,用EcoRⅠ、XhoⅠ双酶切纯化后克隆到PGEX-4T-1,获得重组的表达质粒pGEX-filC,经诱导后重组蛋白大小约为37ku,以水溶性形式表达,纯化后的filc重组蛋白经Western blot检测,验证重组蛋白具有良好的反应原性,可以用作免疫原,本试验采用谷胱甘肽亲和回收纯化方法得到了纯度较高的重组鞭毛蛋白,所纯化的SE重组鞭毛蛋白可用于建立flic-ELISA方法的抗原。
本试验对ELISA方法的抗原包被量、血清和酶标二抗最佳工作浓度和作用时间等进行了优化,确定了flic-ELISA 最佳操作程序,以0.01mg/mL pGEX-fliC蛋白为最佳包被浓度,确定了阴、阳临界值OD450nm值为0.243。本试验中肠炎沙门菌阳性血清反应的 OD450nm 值均大于0.243,flic-ELISA试验判定为阳性,而其他血清型沙门菌13株的血清反应的OD450nm值均小于0.243,flic-ELISA试验判定为阴性,说明该flic-ELISA方法具有较好的特异性、敏感性。以建立的flic-ELISA方法检测临床血清样品,结果显示该间接ELISA的检出率23.3%,说明肠炎沙门菌普遍存在于鸡群中。本试验建立的flic-ELISA敏感度高、特异性强及在短时间内可以检测大量的血清样品,给临床检测肠炎沙门菌提供了一种可行的血清学检测方法。
[1] 王章云.肠炎沙门菌引起的食物中毒细菌学调查[J].中国人兽共患病杂志,1999,15(3):115.
[2] 杜秀珍雏.鸡和鸡蛋肠炎沙门氏菌的检测与控制研究进展[J].中兽医医药杂志,1997(5):17-18.
[3] 李继祥,高继业,唐 妤,等.屠宰场生鸡肉肠炎沙门菌的污染途径[J].食品科学,2010,31(15):208-211.
[4] 王 亮,张元鹏,张荣武,等.鸡源性肠炎沙门菌的流行病学调查[J].中国人兽共患病学报,2011,27(5):455-458.
[5] 蒋 颖,刘 轶,郦晓琼,等.肠炎沙门菌特异性诊断方法的建立[J].扬州人学学报:农业与牛命科学版,2007,28(3):6-7.
[6] 陈弟诗,郭万柱,徐志文,等.猪霍乱沙门氏菌的分离与鉴定以及PCR检测方法的建立[J].安徽农业科学,2007,35(20):6020-6023.
[7] 邓显文,谢芝勋,谢丽基,等.肠炎沙门菌LAMP检测方法的建立[J].动物医学进展,2012,33(5):27-30.
[8] Xie Z X,Qin C X,Xie L J,et al.Recombinant protein-based ELISA for detection and differentiation of antibodies against avian reovirus in vaccinated and non-vaccinated chickens[J].J Virol Meth,2010,165(1):108-111.
[9] 韦 悠,谢芝勋,刘加波,等.禽腺病毒1型抗体间接ELISA检测方法的建立[J].畜牧与兽医,2011,43(10):50-53.
[10] 秦春香,谢芝勋,谢丽基,等.利用σ3和σ2重组蛋白检测禽呼肠孤病毒抗体ELISA的建立[J].西南农业学报,2009,22(2):492-496.
[11] 叶朗光,邓树轩.肠炎沙门菌研究进展。畜牧与饲料科学[J].2011,32(2):121-122.
[12] 朱春红,吴 娟,张伟娟,等.肠炎沙门菌SEFA基因表达和间接ELISA检测方法的初步建立[J].中国预防兽医学报[J].2010,32(1):44-48.

