核苷(酸)类似物治疗对乙型肝炎病毒感染者聚合酶区基因变异的影响
潘洪洋 杨 方 张明香 魏 倪 杨 桦 林 松
我们采用PCR产物直接测序法[1,2]对471例进行了HBV-P-RT区基因序列分析的CHB患者进行横截面分析,以进一步了解与耐药相关的基因变异特点。
资料与方法
一、病例来源 2007年5月~2010年2月在我院住院的CHB患者255例,乙型肝炎肝硬化216例,男性355例,女性116例,中位年龄为46(10~85)岁,诊断符合我国2005年制定的慢性乙型肝炎防治指南[3]。全部患者血清HBV DNA阳性,平均水平为5.57±1.35lg拷贝/毫升,其中HBeAg阳性284例(60.3%)。
二、HBV-RT区基因序列分析 空腹采集静脉血。引物序列为:上游:5'-CTTTCGCAAGATTCCTATGGGA-3',下游:5'-CCCCAACTTCCAATTACATATC-3'。采用巢式PCR法对HBV-RT区基因扩增(四川天泽基因工程有限公司),产物经琼脂糖凝胶电泳鉴定和回收纯化后,进行双向DNA序列测定(美国ABI公司3130全自动DNA测序仪),与GenBank参考序列进行比对,获得样本的突变位点。
三、统计学处理 采用SPSS l3.0软件进行统计分析。符合正态分布的计量资料采用均数±标准差表示,否则采用中位数(四分位间距)表示,组间比较采用方差分析或秩和检验,P<0.05为差异有统计学意义。
结果
一、未治疗患者HBV-P基因RT区变异情况 在292例未接受抗病毒治疗的患者中,检测到与NA耐药相关的错义变异6例(2.0%),包括M204I3例、A181T 1例和V173L 2例。同义变异25例(8.5%),包括180位点14例、181和236位点各3例及169和180联合变异5例。
二、停用NA治疗后患者发生HBV-P基因RT区变异情况 在49例曾经应用过NA治疗患者,在停药至少3月后,9例(18.4%)检测到变异位点,包括经典耐药位点的错义和同义变异(表1)。

表1 停用NA治疗后9例患者发生HBV-P-RT变异及类型
三、应用NA治疗期间发生HBV-P基因RT区变异情况 130例(27.6%)患者在接受NA治疗过程中,在他们中检测到与NA相关的错义变异50例(38.5%,表2),检测到同义变异20例(15.4%,表3)。
四、变异患者血清HBV DNA和ALT水平的变化 见表4。
讨论
我们根据患者应用NA治疗情况将患者分为未抗病毒治疗者、曾经接受过抗病毒治疗者和正在接受抗病毒治疗者,结果均检测到氨基酸置换位点,其变异模式与既往报道一致[4~7]。在未经NA治疗的患者,报道的结果各异。2008年Nguyen[8]分别采用克隆测序法和PCR-直接测序法在未经NA治疗的HBsAg携带者体内均未检出与耐药相关的变异。近来,李晓光等[9]用PCR-直接测序法检测未经NA治疗的CHB患者,亦未发现与耐药相关的变异。相反,2001年Kobayashi等[10]用PCR-克隆测序法检测18例未经抗病毒治疗的慢性HBV感染者,结果5例患者检出了rtM204I耐药变异。我们采用PCR-直接测序法在从未接受抗病毒治疗者及曾经抗病毒者中分别检测到6例(2.0%)和5例(10.2%)与耐药相关的变异。
我们在正在接受抗病毒治疗的患者中发现1例应用LdT初治24个月后出现rtA181T变异,1例在应用ADV初治12个月后发生rtM204I变异;在曾经抗病毒治疗的患者中发现1例ADV单药治疗5个月后停药7个月发生rtM204I+V173L变异,1例ETV单药治疗1年后停药1年发生rtV173L+rtN236同义变异,这些在以前未见类似报道,有待进一步研究。
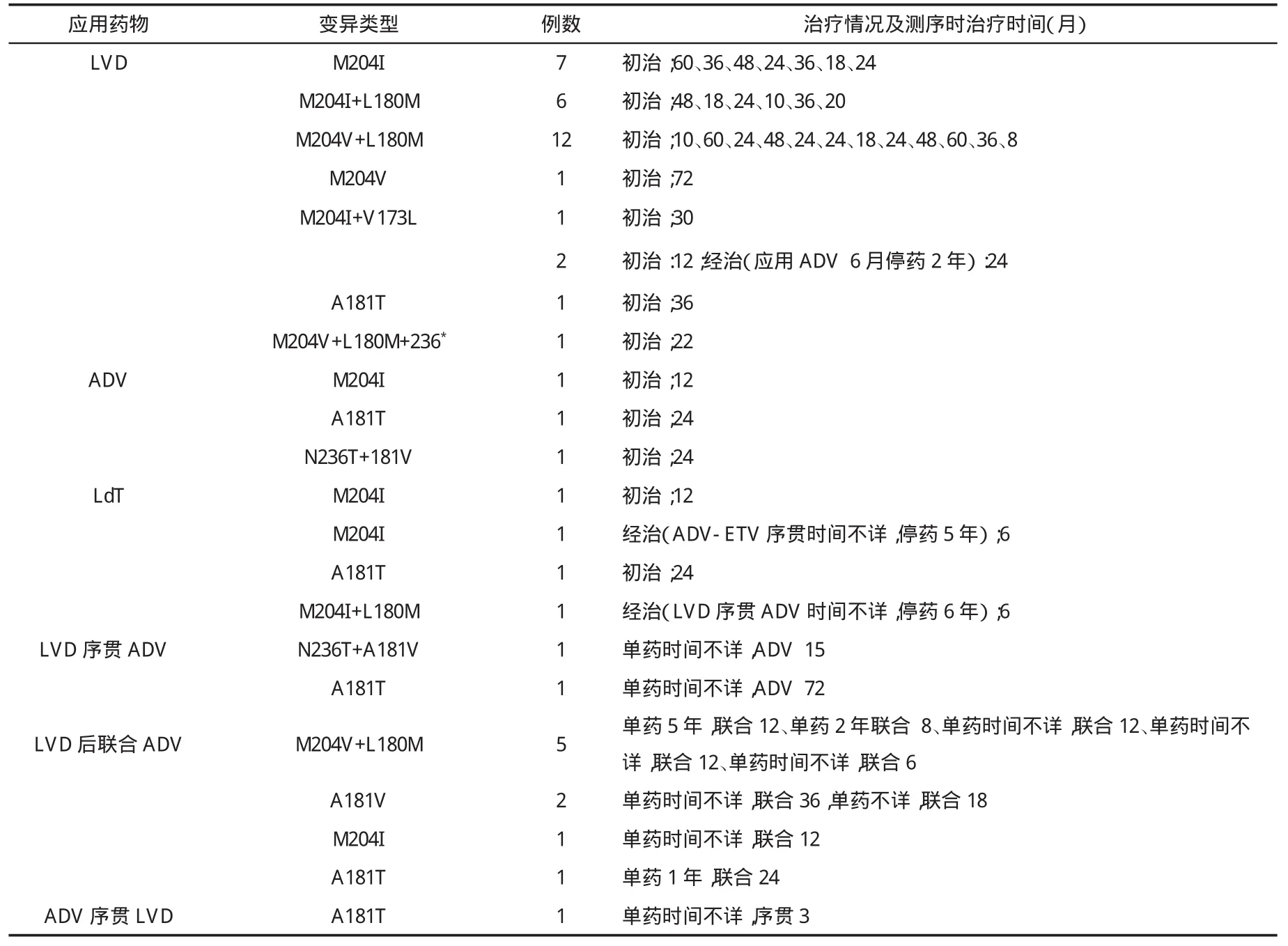
表2 50例患者在应用NA治疗期间发生HBV-P基因RT区错义变异及类型
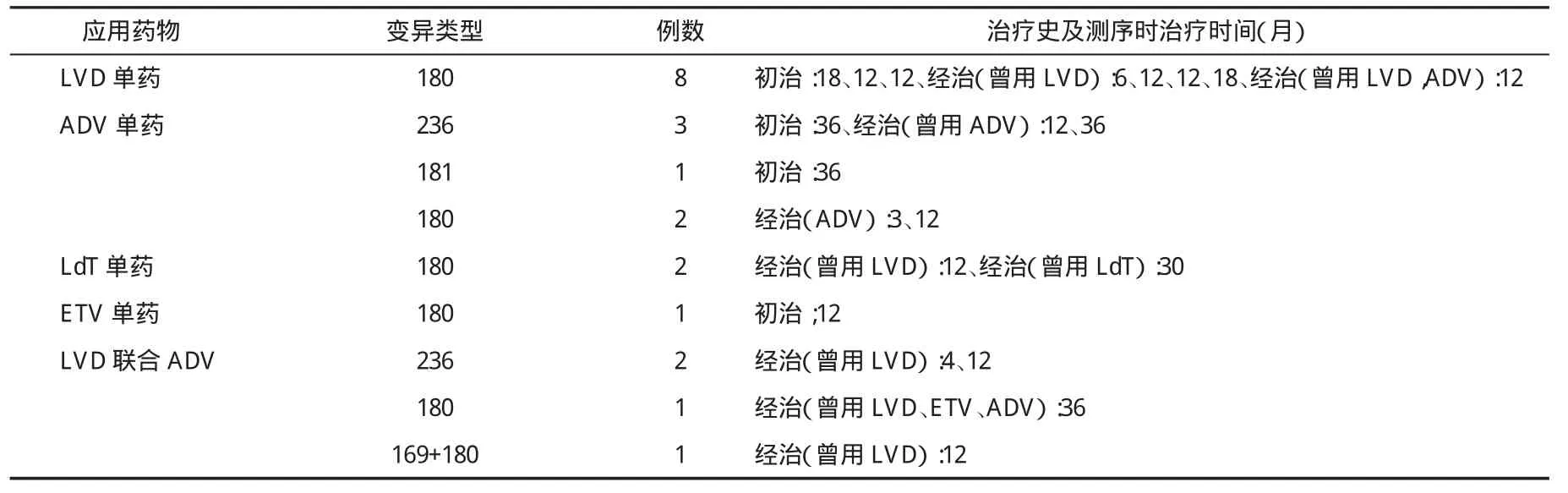
表3 21例应用NA治疗期间患者HBV-P基因RT区同义变异类型及用药史
表4 变异患者血清HBV DNA和ALT水平(±s)的比较

表4 变异患者血清HBV DNA和ALT水平(±s)的比较
例数 HBV DNA(lgcopies/ml)ALT(U/L)错义变异 505.6±1.489±53同义变异 205.3±1.193±67未变异 605.0±1.599±48
遗传密码具有多重性,即决定一个氨基酸的密码子大多不止一个,三联体密码子中一个核苷酸的置换若不改变氨基酸的组成,最终得到的蛋白质的结构和功能也不会发生变化,这样的变异被称为同义变异。但Kimchi-Sarfaty等[11]研究发现多药耐药-1(multidrug resistance-1,MDR-1)基因的同义变异可降低化疗药物的活性。沈银忠等[12]研究发现光滑念珠菌ERG11基因的同义变异导致的光滑念珠菌对氟康唑耐药。本研究在三组患者中均检测到相当数量的同义变异,其中正在抗病毒治疗的患者耐药相关错义变异发生率高于测序时未治疗者,同义变异在从未抗病毒治疗者、曾经抗病毒治疗者及正在抗病毒治疗者中逐渐升高,但同义变异对测序时HBV DNA水平的影响似乎不大。
[1]Malespin M,Wong,S,Siqueira,F,et a1.Barriers to treatment of hepatitis B in an urban Chinatown community.J Clin Gastroenterol,2012,doi:10.1097/MCG.0b013e31824e159c.
[2]Keeffe EB,Dieterich DT,Han SH,et a1.A treatment algorithm for the management of chronic hepatitis B virus infection in the United States:an update.Clin Gastroenterol Hepatol,2006,4:936-962.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[4]Pawlotsky JM.The concept of hepatitis B virus mutant escape.J Clin Virol,2005,3(4Suppl 1):S125-129.
[5]Shaw T,Bartholomeusz A,Locarnini S.HBV drug resistance:mechanisms,detection and interpretation.J Hepatol,2006,44(3):593-606.
[6]Pawlotsky JM,Dusheiko G,Hatzakis A,et al.Virologic monitoring of hepatitis B virus therapy in clinical trials and practice:recommendations for a standardized approach.Gastroenterology,2008,134(2):405-415.
[7]Lok AS,Zoulim F,Locarnini S,et al.Antiviral drug-resistant HBV:standardization of nomenclature and assays and recommendations for management.Hepatology,2007,46(1):254-265.
[8]Nguyen MH,Trinh HN,Garcia RT,et a1.S2075 prevalence of HBV DNA polymerase(B-DNA Pol)mutations in 345 patients with treatment-naive chronic hepatitis B(CHB).Gastroenterology,2008,134(4Suppl 1):A-310.
[9]李晓光,胥婕,刘宝明,等.未经治疗的慢性乙型肝炎患者乙型肝炎病毒耐药变异、基因型和血清型研究.中华肝脏病杂志,2010,18(2):92-99.
[10]Kobayashi S,Ⅰde T,Sata M.Detection of YMDD motif mutations in some lamivudine-untreated asymptomatic hepatitis B virus carriers.J Hepatol,2001,34(4):584-586.
[11]Kimchi-Sarfaty C,Oh JM,Kim ⅠW,et al.A“silent”polymorphism in the MDR1 gene changes substrate specificity.Science,2007,315(5811):525-528.
[12]沈银忠,卢洪洲,张永信.耐氟康唑光滑念珠菌ERG11基因突变分析. 中华传染病杂志,2010,28(6):331-339.

