肝淀粉样变性1例报告并文献复习
邱 华 毛德文 胡振斌
肝淀粉样变性(hepatic amyloidosis,HA)是以淀粉样物质主要沉积于肝脏,进而导致相关临床表现的一类罕见性疾病。该病缺乏特异性的临床及影像学表现,容易漏诊或误诊。现报道我院收治的1例HA患者,并结合文献复习如下。
病例摘要 患者女性,50岁。因乏力、腹胀、上腹部不适5月于2012年4月10日入院。缘于2011年11月10日体检时超声发现肝脏肿大,血清ALT 31U/L、AST 28U/L、碱性磷酸酶(ALP)163U/L、γ-谷氨酰转肽酶(γ-GT)264U/L,无不适症状。患者多家医院诊治,均未能明确病因。2012年4月出现乏力、腹胀,休息不能缓解,肝脏进一步肿大,遂来我院诊治。患者既往有结肠息肉史,否认饮酒史,无心、脑、肺、肾等脏器慢性病史,否认其他家族病史。查体:面色晦暗,皮肤、巩膜无黄染,无肝掌及蜘蛛痣,全身浅表淋巴结未扪及肿大,腹部略饱满,肝下界右肋下4cm,剑突下6cm,质硬,无触痛,脾左肋下未触及,移动性浊音阴性,双下肢无水肿。辅助检查:总胆红素(TBIL)35.1μmol/L、直接胆红素(DBiL)21.7μmol/L、ALT 136U/L、AST 155U/L、ALP 276U/L、γ-GT 378U/L、尿素氮(BUN)6.2mmol/L、肌酐(Cr)91μmol/L、总胆固醇(TC)9.15 mmol/L、甘油三酯(TG)8.32mmol/L、凝血酶原活动度(PTA)63.42%、血沉94mm/h、α1-抗胰蛋白酶3.89g/L、降钙素原 0.517ng/ml、C反应蛋白31mg/L、铜兰蛋白0.63g/L、血清铜24.3μmol/L,血清肿瘤标志物均阴性,病毒性肝炎血清标志物及抗EB病毒(EBV)IgM、抗巨细胞病毒(CMV)IgM抗体均阴性,自身免疫性肝病抗体测定均为阴性。腹部超声提示:肝实质回声增粗;CT提示:肝脏体积增大,表面光滑,门脉期及延迟期肝实质强化不均匀(图1~3)。肝穿刺病理学检查:肝组织窦周隙内大量粉红色细颗粒无结构物质沉积(图4A),肝板受压萎缩变窄,少量肝细胞内色素颗粒沉着(图4B),肝窦内炎细胞浸润不明显;汇管区轻度扩大,纤维组织增生不显著,炎细胞浸润不明显,未见界面炎。诊断为原发性肝淀粉样变性。给予复方甘草酸苷、思美泰等治疗,患者病情迅速恶化,住院20天后出现大量腹水、高黄疸及凝血机制异常化验TBiL/DBIl216.8/171.6μmol/L、ALT 234U/L、AST163U/L,ALP 559U/L、γ-GT 872U/L、PTA 52%,共行2次血浆置换术治疗,病情无好转,自行出院。电话随访于2012年5月16日死亡。
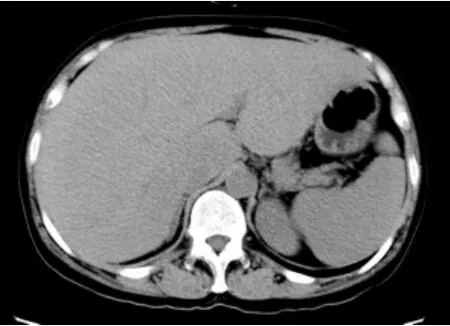
图1 肝脏平扫 肝脏体积增大,形态规整,肝表面光滑,肝实质密度均匀

图2 肝脏增强扫描 门脉期示肝实质强化不均匀,可见多发斑片状强化影

图3 肝脏增强扫描 延迟期示肝实质强化不均匀,可见多发斑片状强化影
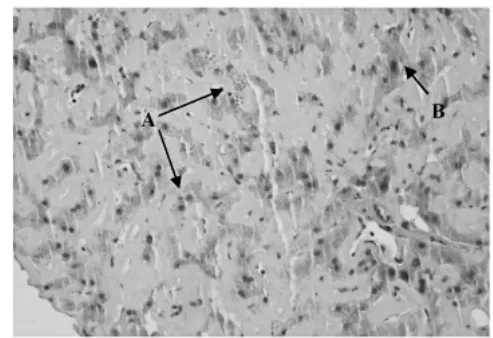
图4 肝组织病理学检查 肝组织窦周隙内大量粉红染细颗粒无结构物质,肝板受压萎缩变窄(A),少量肝细胞内色素颗粒沉着(B),肝窦内炎细胞浸润不明显(刚果红染色 ×200)
讨论 淀粉样变是有可溶性血清淀粉样物质以不溶性纤维形式沉积于细胞外间质中引起的一组疾病。其发病机制目前尚不明确,多认为与抗原/抗体免疫机制紊乱有关[1]。肝淀粉样变是系统性淀粉样变的一部分。目前,根据纤维蛋白前体的种类不同,主要分为3型:(1)淀粉样轻链(amyloid light chain,AL)型,曾称原发性淀粉样变。AL来自免疫刺激下单克隆浆细胞过量产生的免疫球蛋白,常为免疫球蛋白轻链恒区片段;(2)淀粉样A蛋白(amyloid associated protein,AA)型,曾称继发性淀粉样变,其发生与炎症刺激后血清AA浓度升高,并持续处于高水平,AA在组织中沉积有关。因此,AA型常继发于慢性炎症性疾病,如克罗恩病、类风湿性关节炎、强直性脊柱炎、银屑病及结核等;(3)遗传性淀粉样变型,曾称家族性淀粉样变,因遗传基因突变而导致淀粉样蛋白沉积于肝脏而形成,这些淀粉样蛋白包括淀粉样甲状腺素结合蛋白(ATTR)、淀粉样纤维蛋白原Aα 链(AFib)、淀粉样载脂蛋白A1(Apo A1)、淀粉样半胱氨酸蛋白酶抑制剂 C(ACys)等[2]。
肝淀粉样变发病隐匿,缺乏特异性的临床及影像学表现,唯一确诊方法是肝穿刺组织病理学检查,刚果红染色为阳性。根据国内外报道,我们总结了本病的一些共性特征[3~6]:本病好发于40岁以上中老年,男女构成比约为2:1;临床症状主要为乏力、纳差、上腹胀满;体征主要有肝脾肿大、腹水、黄疸、消瘦、双下肢水肿等,而实验室检查大多表现为γ-GT及ALP上升,肝功能、凝血功能大多正常,或轻度异常改变,当出现黄疸及凝血功能障碍时往往提示预后较差;B超、CT、MRI检查有助于发现肝脏病变或作为辅助诊断依据,但缺乏特征性。由于肝穿刺组织活检存在较高出血风险,甚至可能导致死亡,因此临床需慎重进行。近年一些学者在无创性检测技术方面做了一些有益的尝试:如123I放射性同位素标记SAP可无创性测定全身淀粉样物质沉积的类型及程度,其诊断AA型、AL型及ATTR型系统性淀粉样变的敏感度分别为90%、90%和48%,特异性为93%[7]。LovatL等[8]应用123I放射性同位素标记SAP测定了484例系统性淀粉样变患者,最终诊断了AA型肝淀粉样变25例、AL型98例、遗传型1例,SAP诊断结果与肝穿刺组织活检结果完全一致。Youn MS等[9]观察18F-脱氧葡萄糖(FDG)PET/CT鉴别诊断多发性骨髓瘤伴发的AL型肝淀粉样变的价值,结果发现当选择最大标准摄取值(SUVmax)为7.1时,肝脏18F-FDG 弥漫性摄取增加,而其他脏器无改变,具有一定的诊断及鉴别诊断价值。Loustaud-Ratti VR等[10]研究瞬时弹性波扫描对肝淀粉样变的诊断价值,结果表明在排除肝纤维化、肝硬化情况下,肝硬度(liver stiffness)>17.3kPa对AL型肝淀粉样变具有较高的诊断特异度和灵敏度。
目前,主张针对不同类型的淀粉样变采用不同的治疗方法。对于AL型主要有干细胞移植和化疗两种治疗方法。其中早期给予自体干细胞移植可清除能产生淀粉样轻链的浆细胞,控制病情发展;常采用马法兰与泼尼松(MP)联合方案化疗,并可联合长春新碱、卡氮芥、环磷酰胺等。Girnius S等[11]采用大剂量马法兰联合自体干细胞移植治疗能显著延迟AL型肝淀粉样变患者的生存期。AA型肝淀粉样变在控制慢性炎症和感染性原发疾病后,肝淀粉样变可随之减轻。另可给予秋水仙碱、二甲亚砜等抑制淀粉样A蛋白合成、促进降解。Cui D[12]等发现应用雷公藤能通过抑制白细胞介素-6产生,显著降低AA型淀粉样变小鼠血清淀粉样蛋白A(SAA)含量,减少淀粉样A蛋白的组织沉积。在遗传性淀粉样变中,ATTR型和AFib型等肝淀粉样变,建议早期给予肝移植治疗,既可以改善肝脏功能,又能终止淀粉样蛋白前体的供给,控制病情的发展。
本病在确定诊断后中位生存期仅13个月,但个体差异较大,与分型及主要受累器官等有关。与AL型肝淀粉样变比,AA型预后更差。通过减少淀粉样蛋白前体的肝内沉积可以改善所有类型患者的预后[8]。
[1]Shin YM.Hepatic amyloidosis.Korean J Hepatol,2011,17(1):80-83.
[2]Son YM,Choi JY,Bak CH,et al.18F-FDG PET/CT in primary AL hepatic amyloidosis associated with multiple myeloma.Korean J Radio,12(5):634-637.
[3]郭勇,胡瑾华,林伟,等.肝淀粉样变性影像表现2 例报道及文献复习.实用放射学杂志,2010,26(3):376-379.
[4]Son RC,Chang JC,Choi JH.Primary hepatic amyloidosis:report of an unusual case presenting as a mass.Korean J Radiol,2011,12(3):382-385.
[5]高福生,刘宾.原发性肝淀粉样变性临床报告.医师进修杂志,2005,28(3):60-61.
[6]王亚东,赵彩彦,车洪浩,等.肝淀粉样变性12 例临床及病理特点分析.中华内科杂志,2011,50(10):880-881.
[7]Hazenberg BP,van Rijswijk MH,Piers DA,et al.Diagnostic performance of 123I-labeled serum amyloid P component scintigraphy in patients with amyloidosis.Am J Med,2006,119(4):355.e15-355.e24.
[8]Lovat L,Persey M,Madhoo S,et al.The liver in systemic amyloidosis:insights from 123I serum amyloid P component scintigraphy in 484 patients.Gut,1998,42(5):727-734.
[9]Youn MS,Joon YC,Cheol HB,et al.18F-FDG PET/CT in primary AL hepatic amyloidosis associated with multiple myeloma.Korean J Radiol,2011,12(5):634-637.
[10]Loustaud-Ratti VR,Cypierre A,Rousseau A,et al.Non-invasive detection of hepatic amyloidosis:FibroScan,a new tool.Amyloid,2011,18(1):19-24.
[11]Girnius S,Seldin DC,Skinner M,et al.Hepatic response after high-dose melphalan and stem cell transplantation in patients with AL amyloidosis associated liver disease.Haematologica,2009,94(7):1029-1032.
[12]Cui D,Hoshii Y,Kawano H,et al.Experimental AA amyloidosis in mice is inhibited by treatment with triptolide,a purified traditional Chinese medicine.Int Immunopharmacol,2007,7(9):1232-1240.

