全身炎症反应与肝肾综合征关系的研究*
苗 强 聂 鑫 高宝秀 余 霆 李贵星
肝肾综合征(hepatorenal syndrome,HRS)是慢性肝病患者出现进展性肝衰竭和门静脉高压时,以肾功能不全、内源性血管活性物质异常和血液动力学改变为特征的一组临床综合征[1,2]。1型HRS为一种快速、进展性的肾功能损害,48小时内血肌酐增加超过50%或血肌酐水平超过2.5mg/dl;2型HRS为血清肌酐大于1.5mg/dl,常伴顽固性腹水,呈稳定或缓进性肾功能衰竭。HRS的发病机制尚未明了,相关因素包括门脉高压、内脏血管扩张和肾脏血管收缩等因素。最近国外研究发现HRS的发生与感染或炎症反应有关[3,4]。本文探讨了全身炎症反应综合征(systemic inflammatory response,SIRS)与HRS发生的关系,为预防和治疗HRS提供理论依据。
资料与方法
一、研究对象 2010年1月至2012年1月我院住院的肝衰竭患者137例,男性119例,女性18例,平均年龄43.5岁。肝衰竭的诊断以2006年《肝衰竭诊疗指南》为标准[5]。临床分型:急性肝衰竭6例,亚急性肝衰竭17例,慢加亚急性肝衰竭35例,慢性肝衰竭79例。病原学分型:乙型肝炎病毒感染128例,丙型肝炎病毒感染9例。排除原发性肾病、消化道大出血和严重感染者,排除入院时已存在HRS患者。根据患者是否发生HRS分成肝衰竭伴HRS组(HRS组,68例)和单纯肝衰竭组(对照组,69例)。本研究结束时68例HRS患者院内死亡15例,自动出院28例,好转出院25例;对照组好转出院45例,自动出院24例。
二、HRS与SIRS的诊断标准 按照2010年欧洲肝病学会《肝硬化腹水、自发性细菌性腹膜炎及肝肾综合征诊疗指南》[6]的标准诊断HRS。1型HRS的诊断标准为:①慢性重症肝病或肝硬化伴腹水;②48小时内血清肌酐水平>278.0μmol/L或血清水平升高超过50%;③在停用利尿剂和以1.5L等渗盐水扩容后肾功能无持续性改善;④尿蛋白<500mg/dl和无尿路阻塞或肾实质病变的超声检查证据,1型HRS表现为急进性;2型HRS没有明确的标准,当肝硬化患者血清肌酐水平逐渐升高超过1.5mg/dl而没有急进的表现时诊断为此型。本研究中1型HRS30例,2型HRS38例。根据1992年美国胸科医师学会和危重病医学会(ACCP/SCCM)联席会提出的 SIRS评分标准[7],即:(1)体温>38℃或<36℃;(2)心率>90次/分;(3)呼吸频率>20次/分或 PaCO2<413kPa;(4)白细胞<4×109/L或>10×109/L或未成熟粒细胞>10%(除外化疗和白血病),其中每项各为1分,当SIRS分值≥2分时,诊断为SIRS。
三、检测方法 采用ELISA法检测血清HBV标记物及抗甲、丙、戊型肝炎病毒抗体(瑞士罗氏公司cobas e601化学发光仪及配套试剂);采用瑞士罗氏公司Modular-P800全自动生化分析仪检测肝功能、肾功能指标和电解质(试剂及校准品为罗氏公司配套产品);采用发色底物法检测凝血酶原时间(PT,日本SysmexCA-7000全自动血凝分析仪及德国Dade Behring公司试剂);采用日本Sysmex2100全自动血液分析仪检测血常规(试剂和校准品为其配套产品)。终末期肝病模型(MELD)评分采用肌酐(Crea)、总胆红素(TB)及国际标准化比率(INR)进行计算[8]。本实验室通过美国病理学家协会实验室认可,所有分析指标均通过美国病理学家协会的能力验证。
四、统计学处理 采用SPSS16.0软件分析,计数资料采用x2检验,正态分布计量资料采用±s表示,组间比较采用成组资料的t检验,非正态分布计量资料采用中位数(四分位数间距)表示,组间比较采用成组资料的秩和检验,P<0.05为差异有统计学意义。
结 果
一、一般资料比较 见表1。两组患者Child-Pugh分级比较差异有显著性(P<0.05),HRS组MELD评分显著高于对照组(P<0.05)。

表1 两组人群一般资料比较
二、HRS组与对照组SIRS评分分析 见表2。HRS组SIRS评分显著高于对照组(t=2.79,P<0.05)。
表2 两组患者SIRS评分(±s)比较
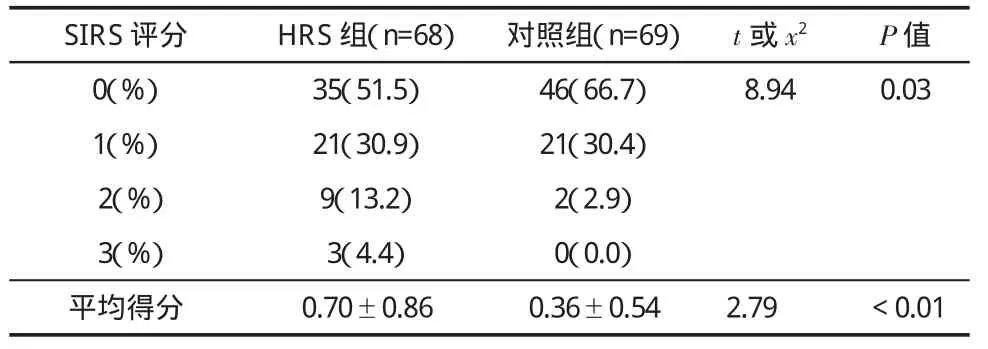
表2 两组患者SIRS评分(±s)比较
SIRS评分 HRS组(n=68)对照组(n=69)t或x2 P值0(%)35(51.5)46(66.7)8.940.031(%)21(30.9)21(30.4)2(%)9(13.2)2(2.9)3(%)3(4.4)0(0.0)平均得分 0.70±0.860.36±0.542.79 <0.01
三、HRS组与对照组实验室指标比较 HRS组TBIL、白细胞计数、INR、PT高于对照组(t值分别为-3.35,5.20,2.55,2.62,P<0.05),钠(Na+)、氯(Cl+)低于对照组(t值分别为 -5.27,2.74,P<0.05,表3)。
表3 两组患者实验室指标(±s)比较
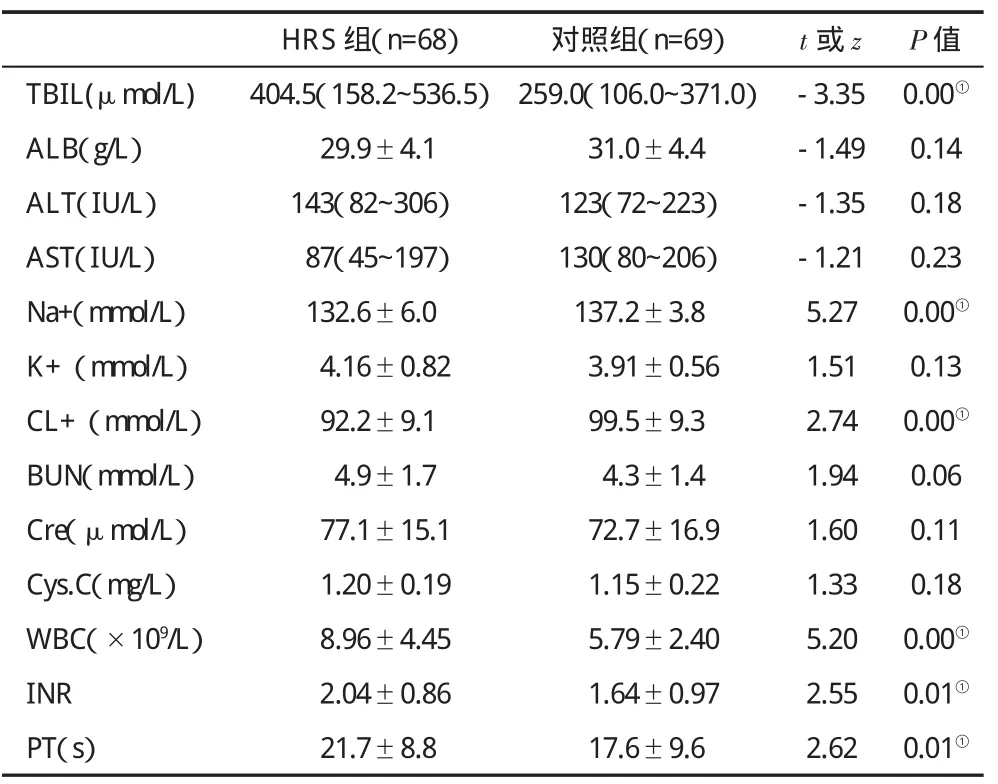
表3 两组患者实验室指标(±s)比较
①P<0.05
HRS组(n=68)对照组(n=69)t或z P值TBIL(μmol/L)404.5(158.2~536.5)259.0(106.0~371.0)-3.350.00①ALB(g/L)29.9±4.131.0±4.4 -1.490.14 ALT(IU/L)143(82~306)123(72~223)-1.350.18 AST(IU/L)87(45~197)130(80~206)-1.210.23 Na+(mmol/L)132.6±6.0137.2±3.85.270.00①K+(mmol/L)4.16±0.823.91±0.561.510.13 CL+(mmol/L)92.2±9.199.5±9.32.740.00①BUN(mmol/L)4.9±1.74.3±1.41.940.06 Cre(μmol/L)77.1±15.172.7±16.91.600.11 Cys.C(mg/L)1.20±0.191.15±0.221.330.18 WBC(×109/L)8.96±4.455.79±2.405.200.00①INR 2.04±0.861.64±0.972.550.01①PT(s)21.7±8.817.6±9.62.620.01①
讨论
由于肝衰竭患者长期的肝功能损害,易发生多种并发症,包括肝性脑病、腹水、HRS、电解质紊乱及消化道出血等[9]。约39%肝硬化腹水患者5年内发生HRS[10],一年发生率约为8%[11]。早期研究表明[12],并发1型和2型HRS患者中位生存时间分别是2周和6个月。特利加压素联合白蛋白作为HRS的一线治疗方法,对60%~70%2型HRS有效,而肝移植或肝肾联合移植是1型HRS的最佳治疗。英国[13]、美国[14]和欧洲[15]有关肝硬化腹水治疗建议中均认为HRS的形成是内脏血管扩张引起有效血容量降低,导致HRS的发生。
近年来,临床发现自发性细菌性腹膜炎(SBP)患者易发生HRS。有研究认为[16,17]:SBP患者发生HRS的可能原因与感染引发细胞因子,如肿瘤坏死因子及白细胞介素等炎性介质释放,从而引起SIRS,导致HRS发生。对合并SIRS的HRS患者分析表明,HRS组 WBC高于对照组(t=5.20,P<0.05),表明 HRS组在肾损伤时有感染或内毒素血症存在。我们认为肝衰竭患者发生全身炎症反应和患者存在感染及内毒素血症相关,其可能机制包括:肝衰竭患者一方面肝脏功能减退及枯否氏细胞数量及功能的降低,使肝脏清除外来的异物(包括病原微生物和毒素)的能力低下,从而易发生感染和内毒素血症;另一方面,肝衰竭患者因门静脉高压,从而使肠道出现淤血、粘膜缺氧,肠上皮细胞变性、坏死、凋亡、上皮再生功能降低,导致肠粘膜屏障损伤,肠粘膜的通透性增加,肠道的细菌和毒素易进入血液引发感染和内毒素血症。SIRS引发HRS的可能机制有两个途径:一是白细胞介素等炎性物质增加,引发内皮细胞合成NO,刺激内脏血管扩张,导致有效循环血容量不足,诱发HRS;另一途径是内皮素、肿瘤坏死因子以及脂类炎性介质如白三烯(LT)C4、D4,血栓素 A2(TXA2)等合成增加,而这些炎性介质均具有强烈的收缩肾血管的作用,引起肾血流灌注不足,从而导致HRS的产生。
HRS患者肝脏衰竭程度高于非HRS组,表现为MELD评分升高和明显的高胆红素血症,MELD分值升高也进一步说明肝功能较差,更容易发生感染和内毒素血症。值得注意是:HRS患者血Na+水平为132.6±6.0mmol/L,明显低于对照组的137.2±3.8mmol/L(t=-5.27,P<0.05)。在我们的前期研究中己发现低钠血症与HRS关系密切[18],其可能的机制是低钠血症激活肾素-血管紧张素-醛固酮系统,致肾动脉收缩,从而引发HRS发生。低钠血症在HRS发生中作用需要进一步的研究。
通过本研究,我们认为肝衰竭患者在发生HRS前有全身炎症反应存在,全身炎症反应与肝衰竭患者并发HRS关系密切。因此,肝衰竭患者应保持大便通畅,预防性使用抗生素,防治感染和内毒素血症,从而减少和降低全身炎症反应的发生和程度,则有利于阻止HRS的发生。
[1]Wong F.Hepatorenal syndrome:Current management.Curr Gastroenterol Rep,2008,10:22-29.
[2]Angeli P,Merkel C.Pathogenesis and management of hepatorenal syndrome in patients with cirrhosis.J Hepatol,2008,42:S93-S103.
[3]Martin R,Alexander L.TⅠPS for the treatment of refractory ascites,hepatorenal syndrome and hepatic hydrothorax:a critical update.Gut,2010,59(7):988-1000.
[4]Arora R,Kathuria S,Jalandhara N.Acute renal dysfunction in patients with alcoholic hepatitis.World J Hepatol,2011,3(5):121-124.
[5]中华医学会感染病学分会肝衰竭与人工肝学组和肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南.实用肝脏病杂志,2006,9(6):321-324.
[6]European Association for the Study of the Liver,Ginès P,Angeli P,et al.EASL clinical practice guidelines on the management of ascites,spontaneous bacterial peritonitis,and hepatorenal syndrome in cirrhosis.J Hepatol,2010,53(3):397-417.
[7]Bone RC,Balk RA,Cerra FB,et al.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis.The ACCP/SCCM Consensus Conference Committee.American College of Chest Physicians/Society of Critical Care Medicine.Chest,1992,101(6):1644-1655.
[8]Angemary B,Ceina M,Karnel F,et a1.Child-Pugh versus MELD score in predicting survival in patients undergoing transjugular intrahepatic portosystemie shunt.Gut,2003,52:879-885.
[9]García-Paqan JC,Caca K,Bureau C,et al.Early use of TⅠPS in patients with cirrhosis and variceal bleeding.N Engl J Med,2010,362(25):2370-2379.
[10]Briglia AE,Aannia FA.Hepatorenal syndrome.Definition,pathophysiology,and intervention.Crit Care Clin,2002,18:345-373.
[11]Arroyo V,Terra C,Gines P.Advances in the pathogenesis and treatment of type-1 and type-2 hepatorenal syndrome.Hepatology,2007,46:935-946.
[12]Moore KP,Aithal GP.Guidelines on the management of ascites in cirrhosis.Gut,2006,55(Suppl.VⅠ):vi1-12.
[13]Bruce AR.Management of adult patients with ascites due to cirrhosis.Hepatology,2010,49:2087-2107.
[14]Ginès P,Angeli P,Lenz K,et al.EASL clinical practice guidelines on the management of ascites,spontaneous bacterial peritonitis,and hepatorenal syndrome in cirrhosis.Hepatology,2010,53:397-417.
[15]Gines P,Robert WS.Renal failure in cirrhosis.N Engl J Med,2009,361:1279-1290.
[16]Turban S,Thuluvath PJ,Atta MG.Hepatorenal syndrome.World J Gastroenterol,2007,13(30):4046-4055.
[17]Thabut D,Massard J,Gangloff A,et al.Model for end-stage liver disease score and systemic inflammatory response are major prognostic factors in patients with cirrhosis and acute functional renal failure.Hepatology,2007,46:1872-1882.
[18]李贵星,贺勇,罗通行,等.一氧化氮水平、低钠血症和心功能对肝肾综合征发病的影响.中华医学杂志,2011,91(36):2534-2537.

