FibroScan ®实施受控衰减参数评价脂肪肝的影响因素及重复性分析*
沈 峰 徐正婕 潘 勤 陈光榆 曹 毅 黄家懿 范建高
瞬时弹性记录仪(FibroScan®)是法国Echosens公司的专利产品,通过对肝实质进行无创弹性测量来评估其硬度,从而间接反映肝纤维化及肝硬化程度[1,2],已被广泛用于慢性肝病的无创诊断。最近,有人利用FibroScan®超声在脂肪组织中传播出现显著衰减的特征,重新设计了新的参数来定量检测肝脏脂肪变程度。这个参数是基于FibroScan®捕获的反向射频信号的超声特性,称之为受控衰减参数(Controlled Attenuation Parameter,CAP),在初期临床试验中展现了良好的诊断价值[3]。
关于FibroScan®实施CAP运用于脂肪肝的无创定量诊断目前仍处于临床试验阶段,国内尚无文献报道,影响新参数操作的因素及其稳定性尚不明确。为此,本文拟通过评价受试者特征及操作者因素,探讨CAP测量成功率及重复性的影响因素,为进一步开展临床试验奠定基础。
资料与方法
一、研究对象 2012年5月至8月在我院脂肪肝专病门诊诊治及随访的成年(>18周岁)NAFLD患者,诊断符合NAFLD诊疗指南(2010年修订版),即:①无饮酒史或饮酒折合乙醇量<140克/周(女性<70克/周);② 除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;③ 肝脏腹部超声符合弥漫性脂肪肝的诊断标准且无其他原因可供解释[4]。同期在我院体检中心行肝功能检查正常且腹部超声未发现肝内脂肪浸润或脂肪肝的非嗜酒者作为对照组。除外未成年人、孕妇、安装心脏起搏器、右上腹有未愈合伤口及存在腹水者。在CAP检查当日,患者空腹禁食,抽取肘静脉血5ml,记录饮酒史、性别、年龄、计算体质量指数(body mass index,BMI)[体重(kg)/身高(m)2]及腰围。入组患者均签署知情同意书。
二、CAP值测定 使用最新FibroScan-502机型(法国Echosens公司)完成肝脂肪变定量测定,以CAP值表示,单位为dB/m。对于CAP的测量目前仅在M型探头实施,其理论探测深度在皮下2.5cm~6.5cm共3cm3的肝组织内,频率固定在3.5MHz。由两名经过专门培训、获得FibroScan®操作者证书的医生参照使用手册定人定机进行操作。测量时患者取仰卧位,右手抱头,最大限度扩展肋间隙,检测区域选择右侧腋前线至腋中线第7、第8、第9肋间。保持探头与肋间隙皮肤表面垂直,压力指示器显示为绿色,显示屏上M波形强度一致且分布均匀、A波形呈线形时即开始检测。要求每例对象成功检测10次以上,以所有有效测量结果的中位数(median)为最终结果。所有测量值的四分位间距(inter quartile range,IQR)与中位数的比值(IQR/med)<30%并且成功率(成功检测次数/总检测次数)≥60%为有效测量。
三、临床测量标准 按照卫生部中国成人超重和肥胖症预防控制指南标准[7]:BMI(kg/m2)<18.5为体重过低,18.5~23.9为体重正常,24.0~27.9为超重,≥28为肥胖;腰围(cm)在男性≥85,女性≥80定义为中心性(腹型)肥胖。
四、统计学分析 应用SPSS19.0统计学软件,正态分布计量资料采用±s表示,两组均数比较采用t检验,多组均数比较采用方差分析,计量资料一致性分析采用组内相关系数(intraclass correlation coefficient,ICC),率的检验采用 x2检验,P<0.05为差异有统计学意义。
结 果
一、BMI和生化指标的比较 本组完成NAFLD 169例(男性89例,年龄51.9±14.3岁,BMI为25.6±3.3kg/m2,腰围为 86.2±9.1cm);对照人群 59例(男性28例,年龄 49.7±15.5岁,BMI为 21.7±2.8kg/m2,腰围为77.9±8.8cm),两组间性别和年龄无显著性差异(P>0.05),而NAFLD组BMI和腰围均高于对照组(P<0.05)。两组生化指标比较见表1。
表1 NAFLD与对照组生化指标(±s)比较
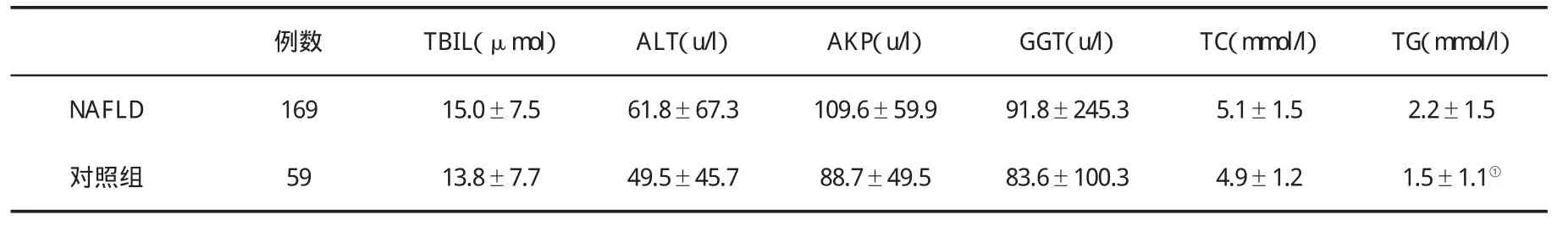
表1 NAFLD与对照组生化指标(±s)比较
①P<0.05
例数 TBIL(μmol)ALT(u/l)AKP(u/l)GGT(u/l)TC(mmol/l)TG(mmol/l)NAFLD 16915.0±7.561.8±67.3109.6±59.991.8±245.35.1±1.52.2±1.5对照组 5913.8±7.749.5±45.788.7±49.583.6±100.34.9±1.21.5±1.1①
二、CAP值的比较 CAP测量结果见表2。随着BMI及腰围的增加,CAP值有增加趋势(P<0.05),而CAP水平与ALT、AST、AKP、GGT、TC和 TG等无相关(资料未列出)。不同性别、年龄和BMI人群CAP测量情况见表3。
表2 NAFLD与对照组测量参数(±s)的比较

表2 NAFLD与对照组测量参数(±s)的比较
单次测量时间(s)检测(次)成功(%)CAP(dB/m)NAFLD 208.8±105.212.5±4.311.1±2.0(90)291.1±54.0对照组 179.5±152.812.0±2.110.8±0.8(90)216.4±43.3
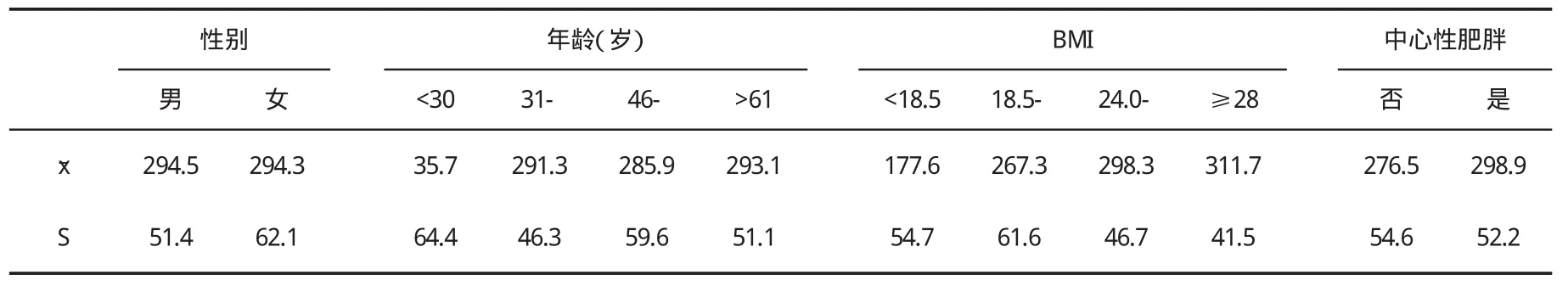
表3 NAFLD患者CAP值与受试者特征分层分析
三、影响CAP有效测量的受试者因素 两组有效测量成功率为87.7%(200/228),其中NAFLD组为87.0%(147/169),对照组为 89.8%(53/59,x2=0.121,P=0.728)。随着BMI升高,检测成功率呈下降趋势,正常体重和肥胖组检测成功率分别为93.9%(77/82)和75.0%(33/44,x2=9.548,P=0.023);中心性(腹型)肥胖组检测成功率为86.2%(150/174),低于对照组的92.6%(50/54),但差异不显著(x2=1.569,P=0.212);女性及老龄组(>61岁)检测成功率均下降,但与各自对照组相比差异也均不显著(P>0.05)。在检测失败的28例中,女性占53.6%(15例),超重或肥胖者占79%(22例),失败主要原因考虑为皮下脂肪厚导致无效测量及肋间隙狭窄,对照组存在1例肋骨畸形也影响了检测。
四、重复性评价 使用ICC对CAP测量的重复性进行评价[8]。对63例成功完成测量的NAFLD患者由同一操作者及不同操作者在相同位置进行复测。其中同一操作者的ICC为0.848(95%可信区间为0.761~0.905,P=0.000);不同操作者的 ICC为 0.718(95%可信区间为 0.607~0.896,P=0.006)。
讨论
通过多项生化指标如脂肪肝指数(Fatty Liver Index,FLI)和肝脂肪变指数(Hepatic Steatosis Index,HSI)的联合运用来诊断脂肪肝的准确性仍有待提高[9~11]。常用的超声、CT和新近发展的磁共振质谱分析技术(MRS)诊断脂肪肝比较常用,但还需大量的临床试验验证。
FibroScan®基于振动控制瞬时弹性成像技术(vibration-controlled transient elastography,VCTE)来测量肝脏的弹性值以评估肝纤维化及肝硬化程度,目前已广泛用于病毒性肝炎、胆汁性淤积性肝病及酒精性肝病等多种慢性肝病的无创评估[12],但仍无法评估肝脂肪变。CAP是利用超声衰减原理重新定义的一个新参数,主要用于定量检测人体内肝脏脂肪变程度,初步临床试验认为可测量并区分出10%以上的脂肪变[6]。目前,新机型FibroScan-502可以同时完成肝硬度值(liver stiffness measure,LSM)及 CAP值的测定,而无须额外操作[3]。
法国Sasso等[3]首先开展一项多中心的CAP试验。共招募各种慢性肝病患者115例(其中NAFLD患者17例),均在一周内完成肝活检及CAP检查。结果提示不同程度脂肪变的CAP值有显著性差异,而且CAP数值与肝脂肪变程度显著正相关(Spearman相关系数=0.81,P<10-16)。通过受试者工作特征曲线(receiver operator characteristic curve,ROC)计算,肝纤维化≥S1、≥S2,≥S3的曲线下面积(AUC)分别为 0.91、0.95和0.85,提示具有较高的准确性。我们研究也发现CAP值在NAFLD组显著高于对照组。我们发现随着BMI及腰围的增加,CAP值有增加趋势,但是BMI及腰围与肝脂肪变有关,可能是混杂因素。同样关于CAP值的诊断价值及阈值,也需要在我国人群进行以“肝活检”为标准的对照研究,并进行多因素分析以进一步明确其意义。
根据既往对于瞬时弹性成像的研究报道,FibroScan的M型探头设计的测量范围在皮下2.5cm~6.5cm的区域内,当皮肤-肝包膜距离(skin-capsule depth,SCD)大于2.5cm时需要更换XL探头。超重或者肥胖者会因为皮下脂肪层过厚导致剪切波改变而使测量值高估,探测区域外移至肝脏包膜或肝外使图像质量不符合标准而软件自动取消弹性图,并且超重或者肥胖者往往存在肋间隙狭窄,也会降低测量的准确性。Foucher J[13]等对2114例慢性肝病患者进行LSM测定,结果失败率为4.5%,其唯一原因是BMI超过28kg/m2,而与操作者、性别和转氨酶水平无关。我们对于CAP测定的总体成功率为87.7%,其影响因素与多数研究结果类似。成功率较低的主要原因可能在于本次研究对象主要为NAFLD患者,该组平均BMI达到25.9kg/m2,在失败者中超重或肥胖者占到了79%,因此导致测量成功率明显下降。Myers RP[14]等对于BMI>28kg/m2的患者进行CAP测量的临床研究,结果34.8%患者(96/276)无法获得硬度值,其中56例无法获得CAP值。另外,女性及老年患者的成功率降低同样可能与皮下脂肪多及肋间隙狭窄有关。理论上,最佳的解决方案是根据SCD值来选择M型或者XL探头,以获得更高的成功率[15]。但是,目前CAP的测定只能在M型探头上进行,存在一定的局限性。在临床实践中,尽量避开脂肪堆积的位置,用手指挤压皮下组织,在靠近腋前线处皮下脂肪较薄,应耐心寻找到距离最近的测量点可使成功率得到提高。
FibroScan®测量少受操作者主观影响,既往对于LSM值的稳定性评价也提示其具有良好的重复性[16]。我们对于CAP稳定性的评价结果显示,同一操作者两次CAP值测定的ICC为0.848,不同操作者为0.718,提示新参数CAP同样具有较高的稳定性。但是CAP值测量可能存在一些尚未发现的未加控制的影响因素,如不同操作者对于弹性图识别存在经验差异,一些存在缺陷的弹性图仍被认为有效等,需要操作者仔细去识别并删除一些无效的数据。
在理论上,CAP测量的体积是肝活检组织条的100倍,可以无创、定量地评价肝脂肪变,对操作者依赖性小,无辐射性,适合人群测定及随访,具有良好的应用前景。FibroScan®新机型可以同时对肝纤维化及脂肪变程度进行评价,可用于肝移植术前供体肝脂肪及纤维化程度的判定以及脂肪肝患者纤维化的筛查等,扩展了临床应用范围。但是,到目前为止,CAP的临床应用仍然处于试验阶段,其诊断价值需要更多的验证。除了NAFLD、酒精性脂肪肝、病毒性肝炎等均可出现肝脂肪变,不同病种CAP的测量值可能有差异,也需纳入更多的患者以评估CAP的准确性。现有的数篇文献报道显示研究对象的样本量还较小,且无中国人群的研究资料,并且病种局限。因此,CAP对大样本的中国患者,尤其是针对NAFLD以及慢性乙型肝炎合并脂肪肝患者的诊断效力仍需进一步验证。
[1]Fan JG,Farrell GC.Epidemiology of non-alcoholic fatty liver disease in China.J Hepatol,2009,50(1):204-210.
[2]Degos F,Perez P,Roche B,et al.Diagnostic accuracy of FibroScan and comparison to liver fibrosis biomarkers in chronic viral hepatitis:a multicenter prospective study (the FⅠBROSTⅠC study).J Hepatol,2010,53(6):1013-1021.
[3]Sasso M,Beaugrand M,de Ledinghen V,et al.Controlled attenuation parameter(CAP):a novel VCTE guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis:preliminary study and validation in a cohort of patients with chronic liver disease from various causes.Ultrasound Med Biol,2010,36(11):1825-1835.
[4]非酒精性脂肪性肝病诊疗指南(2010年修订版).中华肝脏病杂志,2010,(3):163-166.
[5]Kleiner DE,Brunt EM,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease.Hepatology,2005,41(6):1313-1321.
[6]Sasso M,Tengher-Barna Ⅰ,Ziol M,et al.Novel controlled attenuation parameter for noninvasive assessment of steatosis using Fibroscan(R):validation in chronic hepatitis C.J Viral Hepat,2012,19(4):244-253.
[7]中华人民共和国卫生部疾病控制司.中国成人超重和肥胖症预防控制指南.北京:人民卫生出版社,2006:1-4.
[8]Fraquelli M,Rigamonti C,Casazza G,et al.Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease.Gut,2007,56(7):968-973.
[9]Grant A,Neuberger J.Guidelines on the use of liver biopsy in clinical practice.British Society of Gastroenterology.Gut,1999,45(Suppl 4):ⅠV1-ⅠV11.
[10]Bedogni G,Bellentani S,Miglioli L,et al.The Fatty liver index:a simple and accurate predictor of hepatic steatosis in the general population.BMC Gastroenterol,2006,6:33.
[11]Lee JH,Kim D,Kim HJ,et al.Hepatic steatosis index:a simple screening tool reflecting nonalcoholic fatty liver disease.Dig Liver Dis,2010,42(7):503-508.
[12]Andersen ES,Christensen PB,Weis N.Transient elastography for liver fibrosis diagnosis.Eur J Ⅰntern Med,2009,20(4):339-342.
[13]Foucher J,Castera L,Bernard PH,et al.Prevalence and factors associated with failure of liver stiffness measurement using FibroScan in a prospective study of 2114 examinations.Eur J Gastroenterol Hepatol,2006,18(4):411-412.
[14]Myers RP,Pollett A,Kirsch R,et al.Controlled attenuation parameter(CAP):a noninvasive method for the detection of hepatic steatosis based on transient elastography.LⅠD-10.1111/j.1478-3231.2012.02781.x[doi].LiverⅠnt.2012.
[15]Myers RP,Pomier-Layrargues G,Kirsch R,et al.Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients.Hepatology,2012,55(1):199-208.
[16]李林芳,戴琳,张琪,等.瞬时弹性记录仪检测肝纤维化影响因素及稳定性分析.南方医科大学学报,2008,28(4):595-597.

