腹腔镜射频消融治疗乙型肝炎肝硬化并发小肝癌*
刘国岩 荚卫东 葛勇胜 李建生 马金良 许戈良 余继海
原发性肝癌是一种恶性程度极高的肿瘤,传统的手术治疗是最为常见也是最为有效的治疗方法,但肝癌总体切除率只有30%左右[1]应用射频消融(radiofrequency ablation,RFA)治疗小肝癌已被证实是一种微创而又有效的治疗方法[2,3],特别是对于不适合行肝切除术及肝移植的患者[4]。但对于有些位置较为特殊或血液供应较为丰富的病灶,经皮射频消融(percutaneous radiofrequency ablation,PRFA)往往达不到彻底治疗病灶的目的,而且很有可能导致相关并发症的发生[5]。而腹腔镜射频消融(laparoscopic radiofrequency ablation,LRFA)作为一种新的治疗方法已应用于临床。现回顾性分析我科采用LRFA治疗肝癌的临床效果,现报告如下。
资料与方法
一、临床资料 2010年6月至2012年2月我科收治的原发性肝癌患者8例,男6例,女2例,年龄55~74岁,平均年龄64.0±7.4岁。共9个瘤体,其中肿瘤位于胆囊旁3例,左外叶突出表面2例,右叶膈顶3例。平均肿瘤直径2.0±0.6cm。肝功能Child A级6例,Child B级 2例。术前行吲哚菁绿排泄试验(ICG R15)为19.1±11.5%。8例患者均为乙型肝炎肝硬化。术前均行肝脏超声造影及双期增强CT检查诊断。
二、手术方法 使用日本光电株式工业会社DDG-3300k肝脏储备功能分析仪检测术前肝脏储备功能[6]。使用珠海和佳医疗设备有限公司生产的HCGF-3000冷极射频肿瘤治疗机,工作频率为460kHz,最大射频功率为120W,控温范围70℃~90℃,热疗定时时间为12min。使用史塞克(Stryker USA)1088i腹腔镜系统。在患者右侧大腿外侧贴偶合电极,取仰卧位。在全麻成功后,在脐下缘做一小切口,建立CO2气腹(10mmHg),经此孔置入10mm Trocar,放置腹腔镜探头,探查肝脏及腹腔。于剑突下放置5mm Trocar,放置分离钳,分离粘连网膜。根据肿瘤及粘连情况在右或左肋缘下增加置入5mm Trocar。了解肿瘤的数目及位置后,选择合适穿刺点,并根据肿瘤大小、位置以及术中所见,确定治疗方法。射频电极单次热凝最大有效直径约3~5cm,射频热凝的范围超过肿瘤边缘1cm左右,以达到根治效果。对于直径<2.0cm的病灶,射频针放置于肿瘤中央;对于深面或直径大于2.0cm的病灶,则采用“多针穿刺、多点消融”的方法,最大限度覆盖病灶。整个过程在计算机控制下进行。当肿瘤被完全消融,组织固化到一定程度后,即完成一次治疗。为防止肿瘤种植转移,拔针过程中烧灼穿刺针道。
三、随访 采用门诊复查或电话询问方式随访,术后半年内每月、半年后每三个月复查一次肝功能、AFP、胸片及肝脏超声,必要时行肝脏增强CT/MRI及肝脏超声造影检查。
四、统计学方法 采用SPSS 13.0软件进行统计分析,计量资料以均数±标准差表示。组间比较采用独立样本t检验或Mann-Whitney U检验,计数资料采用卡方检验。P<0.05被认为差异有统计学意义。
结果
8例患者顺利完成治疗,无中转开腹情况。术中证实9处病灶均位于肝脏表面,且均伴有不同程度的肝硬化。单个病灶平均布针为4次,平均治疗时间为43.1±9.0min,平均手术时间为1小时19分钟。经LRFA治疗后,肿瘤组织明显凝固坏死,病灶周围存在1.0~2.0cm左右坏死凝固带。所有患者术中均未出现大出血及输血情况。8例患者术后均出现血清转氨酶升高,ALT为 123.5±53.2IU/L,AST为 203.4±60.0IU/L(术前分别为 39.5±13.9IU/L和 68.4±50.9IU/L,P<0.01),峰值出现在术后第一天。术后一月均降至术前水平或恢复正常。未出现术后大出血、胆漏、胃肠道灼伤、膈肌损伤、胸水、腹水、腹腔感染、肝功能衰竭等并发症。8例患者术后平均住院3.8±1.4天。术后一月复查,在超声造影及肝脏双期增强CT检查时,7例8个病灶区呈完全消融状态(图1~4),1例1处病灶呈边缘结节性强化,考虑为病灶不完全坏死,经B超引导下无水乙醇注射治疗一次,再治疗后一月复查超声造影及肝脏双期增强CT,病灶完全消融。随访1~22个月,平均13.5个月,均未出现复发及转移。
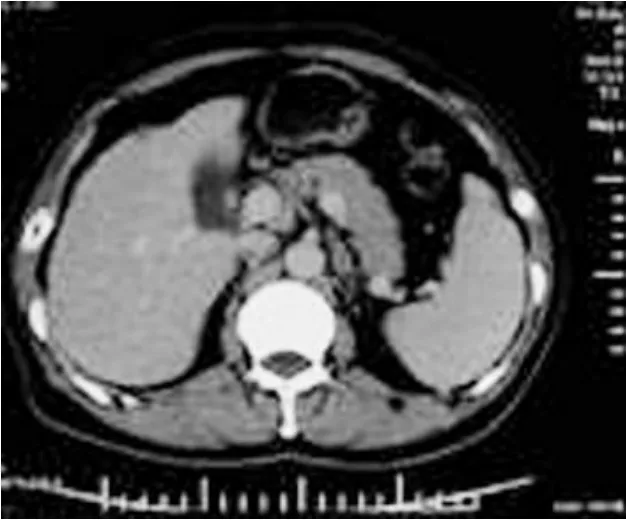
图1 增强CT显示病灶位于肝左叶表面

图2 腹腔镜下观察肿瘤情况

图3 选择穿刺点

图4 射频消融过程中肿瘤及其周围的消融情况
讨论
PRFA作为原发性肝癌有效的治疗方法之一[7],因其创伤小、恢复快、相对安全等特点得到广泛应用。对于乙型肝炎肝硬化患者,肝脏储备功能已严重受损,很大程度地限制了患者的手术治疗。本组8例患者均为不同程度的乙型肝炎肝硬化,术前ICG R15高达19.1±11.5%,肝脏储备功能相对较差。如果行肝切除,术后可能出现相关并发症,甚至出现肝功能衰竭。随着技术的发展,射频消融对小肝癌的疗效达到了几乎与手术切除相当的水平[4]。但在临床应用中,肿瘤的位置及毗邻关系等因素,比如位于肝脏表面、胆囊旁等,极易造成病灶的不完全消融,造成术后病灶残留与复发[8]。近年来,腹腔镜技术在肝脏外科得到广泛应用[9,10]。早在1997年Siperstein等就完成了LRFA治疗肝转移癌并获得成功[11]。近年来,国外学者也在有选择性地开展LRFA治疗肝细胞癌[12,13]。
本研究显示LRFA是一种新颖的微创手术方法,具有定位准确、消融彻底的优点。特别是对于小肝癌,LRFA有如下优点:①LRFA不仅保留了PRFA的微创性,也保留了腹腔镜手术的可视性,使得穿刺进针在直视下进行;②在腹腔镜的辅助下,术中可以对操作区进行游离,充分暴露,提高了射频消融的准确性和消融效果;③避免了邻近组织器官的损伤,最大程度地减少了并发症的发生;④患者处于全麻状态,不受患者耐受程度及呼吸程度的限制,保证了消融程度与范围;⑤利用腹腔镜可以对腹腔进行探查,对腹腔情况进行全面的了解。但是对于有腹部手术史及腹腔粘连严重的患者,或瘤体>5cm,大量腹水、高黄疸等终末期肝硬化患者,肝脏肿瘤无法在腹腔镜下良好暴露,晚期肝癌伴门静脉癌栓形成,严重心肺肾功能障碍等应属于LRFA禁忌症。LRFA扩大了射频消融术的适应证:①肿瘤位于肝脏表面靠近大血管、胆囊或膈肌等;②单个肿瘤直径<5cm或多发直径<3cm;③肝硬化Child A或Child B级;④全身状况较差不能耐受手术切除或不愿意手术者。
总之,LRFA在乙型肝炎肝硬化并发肝癌的治疗中体现了精准、微创的治疗理念,具有良好的临床应用价值。鉴于本研究病例较少,且随访时间较短,远期疗效的判断还有待于进一步观察。
[1]Sotiropoulos GC,Lang H,Frilling A,et a1.Resectability of hepatocellular carcinoma:evaluation of 333 consecutive cases at a single hepatobiliary specialty center and systematic review of the literature.Hepatogastroenterology,2006,53(69):322-329.
[2]Curley SA,Lzzo F,Delrio P,et al.Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies:results in123 patients.Ann Surg,1999,230(1):1-8.
[3]Tateishi R,Shiina S,Teratani T,et a1.Percutaneous radiofrequency ablation for hepatocellular carcinoma:an analysis of 1000 cases.Cancer,2005,103(6):1201-1209.
[4]Lau WY,Lai EC.The current role of radiofrequency ablation in the management of hepatocellular carcinoma:a systematic review.Ann Surg,2009,249(1):20-25.
[5]Livraghi T,Solbiati L,Meloni M F,et a1.Treatment of focal liver tumors with percutaneous radiofrequency ablation:complications encountered in a multicenterstudy.Radiology,2003,226(2):441-451.
[6]杨洁,李建生,荚卫东,等.吲哚青绿排泄实验评估肝储备功能的临床研究. 实用肝脏病杂志,2009,2(12):38-40.
[7]Bruix J,Hessheimer AJ,Forner A,et al.New aspects of diagnosis and therapy of hepatocellular carcinoma.Oncogene,2006,25(27):3848-3856.
[8]Kasugai H,Osaki Y,Oka H,et al.Severe complications of radiofrequency ablation therapy for hepatocellular carcinoma:an analysis of 3,891 ablations in 2,614patients.Oncology,2007,72,(Suppl 1):72-75.
[9]Dagher Ⅰ,Belli G,Fantini C,et al.Laparoscopic hepatectomy for hepatocellular carcinoma:a European experience.Am Coll Surg,2010,211(1):16-23.
[10]Tranchart H,Di Giuro G,Lainas P,et al.Laparoscopic resection for hepatocellular carcinoma:a matched-pair comparative study.Surg Endosc,2010,24(5):1170-1176.
[11]Siperstein AE,Rogers SJ,Hansen PD,et al.Laparoscopic thermal ablation of hepatic neuroendocrine tumor metastases.Surgery,1997,122(6):114-115.
[12]Tesche LJ,Newton KN,Unger J,et al.Efficacy and tolerability of laparoscopic-assisted radiofrequency ablation of hepatocellular carcinoma in patients above 60 years of age.Surg Laparosc Endosc Percutaneous Tech,2010,20(6):404-409.
[13]Kitasato Y,Yasunaga M,Goto Y,et al.Laparoscopic radiofrequency ablation for hepatocellular carcinoma.Cancer,2010,37(12):2662-2663.

