鬼臼毒素衍生物Lg-2对人肝癌细胞系HepG-2凋亡的诱导作用
牛海峰,景鸿恩,惠 玲,闫 蔚,王 君,王宏宾,王晓临,周 通,张国华,谭大勇
原发性肝癌是临床最常见的恶性肿瘤之一,根据最新统计,全世界每年新发肝癌患者约60万,肝癌居恶性肿瘤的第5位。除手术治疗外,诱导肿瘤细胞凋亡是目前肿瘤治疗研究的热点,并有可能成为肿瘤治疗的新途径,因而寻找高效低毒的诱导肿瘤细胞凋亡的药物非常重要。鬼臼毒素主要来源于小檗科的鬼臼属、八角莲属和山荷叶属等,具有显著的细胞毒性和抗肿瘤作用,目前临床应用较为广泛的依托泊苷(VP-16)和替尼泊苷(VM-26)均为半合成鬼臼毒素衍生物[1],它们对小细胞肺癌、睾丸癌、急性白血病以及恶性淋巴肿瘤等均有良好的疗效[2]。由于晚期肿瘤患者对现有鬼臼毒素衍生物普遍耐药,同时该类药物水溶性差、抗瘤谱窄、具有较严重的骨髓抑制,其应用逐渐受到限制,为克服VP-16和VM-26的不良反应,研究者对其进行了大量结构修饰工作[3-4]。N-(1-烃氧基-2,2,6,6-四甲基-4-哌啶基氧羰基)-L丙氨酸-4'-去甲-4-脱氧鬼臼酯(Lg-2)为本课题组新合成的一种鬼臼毒素衍生物,是以丙氨酸作为Linker连接氮氧自由基生成一个新型的去甲表鬼臼酯化合物。前期研究表明,Lg-2有较好的抗肿瘤活性[5-6]。由于现有的鬼臼类衍生物对肝癌的抗肿瘤活性较差,本研究以肝癌HepG-2细胞为研究对象,研究Lg-2对HepG-2细胞的抗肿瘤效果,并对其作用机制进行初步探讨。
1 材料与方法
1.1 材料 Lg-2由兰州大学化学化工学院提供,相对分子量287.16,纯度达95%以上,其结构式见图1。DMSO配置成0.001 mol/L原液,置-20℃冻存备用。HepG-2肝癌细胞株由兰州军区总医院医学实验科提供。RPMI 1640、DMSO、噻唑蓝(MTT)均购自美国Sigma公司,胎牛血清购于杭州四季青公司,Hoechst33258染色试剂盒购自碧云天公司,逆转录试剂盒为大连Takara公司产品。RT-PCR引物由大连宝生物工程有限公司合成:p53引物上游序列:5'-CGTGTGGAGTATTTGGATGACAGA-3',下 游序 列:5'-TGTAGTGGATGGTGGTACAGTCAGA-3'。Bax引物上游序列:5'-GCCAGCAAACTGGTGCTCAA-3',下游序列:5'-ATGTCCAGCCCATGATGGTTC-3'。Bc1-2引物上游序列:5'-TGTGTGTGGAGAGCGTCAACC-3',下游序列:5'-TTCAGAGACAGCCAGGAGAAATC-3'。p21引物上游序列:5'-CAGGGGACAGCAGAGGAAGA-3',下 游 序 列:5'-TTAGGGCTTCCTCTTGGAGAA-3'。Caspase3引物上游序列:5'-GACTCTGGAATATCCCTGGACAACA-3',下 游 序 列:5'-AGGTTTGCTGCATCGACATCTG-3'。β-actin引物上游序列:5'-GAAGGTGAAGGTCGGAGTC-3',下游序列:5'-GAAGATGGTGATGGGATTC-3'。
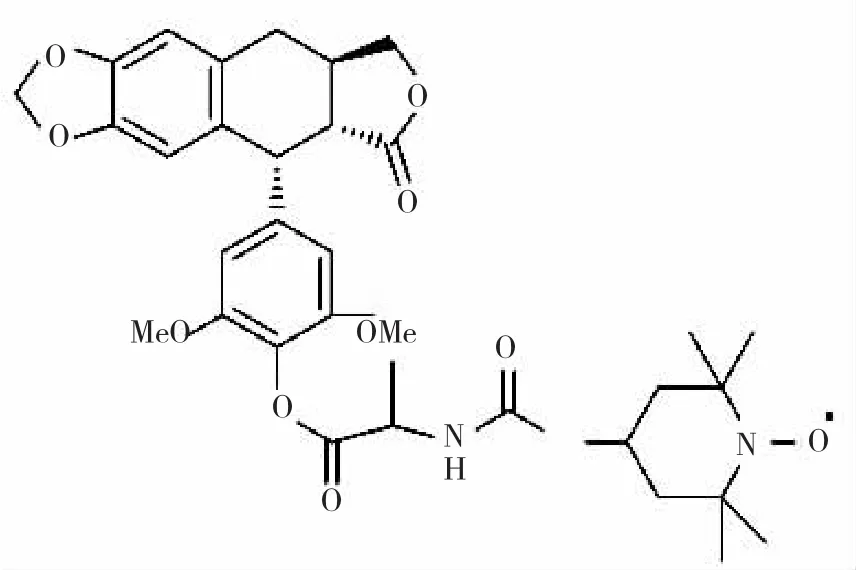
图1 N-(1-烃氧基-2,2,6,6-四甲基-4-哌啶基氧羰基)-L 丙氨酸-4'-去甲-4-脱氧鬼臼酯(Lg-2)结构式
1.2 方法
1.2.1 细胞培养:HepG-2细胞培养于含10%的胎牛血清、100 U/ml青霉素、100 U/ml链霉素的RPMI 1640培养基中,置37℃、5%CO2培养箱常规培养,取对数生长期细胞进行试验。
1.2.2 MTT法检测Lg-2对HepG-2细胞体外增殖的抑制作用:分别设阴性对照组(只加HepG-2细胞)、VP-16处理组及Lg-2处理组3组。在96孔培养板内每孔接种6000个单细胞悬液100 μl培养过夜,次日分别加入终浓度为 0.001、0.01、0.1、1、10 μmol/L的VP-16(VP-16处理组)与Lg-2(Lg-2处理组)。另设调零孔(只加培养液)。每组3个复孔,继续培养48 h;同上接种细胞于96孔板,加入终浓度为10 μmol/L的 VP-16及 Lg-2,分别培养12、24、36、48、60 h,在上述时间点吸去培养基,加入含5 mg/ml的 MTT 的培养基 100 μl,37℃ 孵育 4 h,弃上清,加入 150 μl的 DMSO,轻微震荡 10 min,于490 nm波长处用酶标仪测定各孔吸光度值(A),计算增殖抑制率。该实验重复3遍,结果取平均值。增殖抑制率的计算公式为:
1.2.3 流式细胞仪检测细胞周期和肿瘤细胞凋亡:分别设阴性对照组(只加HepG-2细胞)、VP-16处理组及Lg-2处理组3组。接种HepG-2细胞于培养瓶,每瓶1×109个,贴壁后加入终浓度为10 μmol/L的VP-16(VP-16处理组)与Lg-2(Lg-2处理组),阴性对照组加入等量RPMI 1640,分别培养24、48 h,胰酶消化收集细胞,离心5 min(800 r/min),PBS洗一次,加入预冷的70%乙醇4℃固定1 h;离心5 min(800 r/min),弃上清,1 ml PBS重悬细胞,400目筛网过滤,离心弃上清,加入50 μg/ml的PI染色液,混匀,4℃避光染色30 min,流式细胞仪检测。
1.2.4 Hoech33258染色检测细胞凋亡:分别设阴性对照组(只加HepG-2细胞)及Lg-2处理组。取洁净盖玻片置于6孔板内,接种2×104个HepG-2细胞培养过夜,使细胞达到50% ~80%融合。加入终浓度为10 μmol/L的 Lg-2(Lg-2处理组)培养24 h,阴性对照组加入等量 RPMI 1640,取出盖玻片,PBS洗2次,加入0.5 ml固定液固定,弃固定液,PBS洗2遍(可轻微震荡),每次 3 min,加入0.5 ml的 Hoechst33258 染色液,染色5 min,PBS 洗2遍,每次3 min。加抗荧光淬灭封片液于荧光显微镜下观察。
1.2.5 p53、bax、bc1-2、p21、Caspase3 基因转录水平的RT-PCR检测:分组同“1.2.3”。①总 RNA 的提取:分别接种2×105个HepG-2细胞于培养瓶中,加入终浓度为10 μmol/L的VP-16(VP-16处理组)与Lg-2(Lg-2处理组),阴性对照组加入等量 RPMI 1640,培养 48 h,胰酶消化后收集,按 Invitrogen TRIZOL Reagent说明书提取总RNA,紫外分光光度计测定RNA纯度和浓度并定量。②逆转录反应:参照Takara逆转录试剂盒说明书进行,总RNA 6 μl,DEPC 水 4.5 μl,Oligo(dT)3 μl,5 × buffer 5 μl,dNTP5 μl,逆转录酶 1 μl,RNase inhibitor 0.5 μl。反应条件为70℃保温10 min,冰上2 min,42℃保温1 h,70℃保温15 min后冰上冷却。③PCR:β-肌动蛋白(β-actin)作为内参,反应体系为 20 μl,其中cDNA 2 μl,上下游引物各 0.8 μl,SYBR Premix Ex Taq Ⅱ(2 × )10 μl,ROX Reference Dye(50 × )0.4 μl,ddH2O 6 μl。扩增条件为 95℃ 预变性 30 s,95℃ 5 s,60℃ 31 s,共进行40个循环。通过 qPCR检测细胞样品中的目的基因和内参基因的表达量,根据qPCR反应曲线得到各样品目的基因和内参基因的Ct值,采用ΔΔCt的方法进行相对定量。
ΔΔCt=(待测样本的目的基因的Ct平均值-待测样本的内参基因的Ct平均值)-(对照样本的目的基因的Ct平均值-对照样本的内参基因的Ct平均值)。
基因的表达量用F=2-ΔΔCt来表示,内参基因Ct值及目的基因Ct值均取3次实验的平均值。
1.3 统计学方法 应用SPSS 17.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。α=0.05为检验水准。
2 结果
2.1 Lg-2对HepG-2细胞生长的抑制作用 MTT检测结果显示,Lg-2对HepG-2细胞增殖有明显的抑制作用。药物处理48 h,随药物浓度增加抑制效应增强,Lg-2处理组各浓度HepG-2抑制率均高于VP-16处理组(P<0.05),见表1。随药物作用时间的延长抑制效应增强,Lg-2处理组各作用时间HepG-2抑制率均高于VP-16处理组(P<0.05),见表2。
表1 不同浓度VP-16、Lg-2对HepG-2细胞抑制率比较(±s,%)
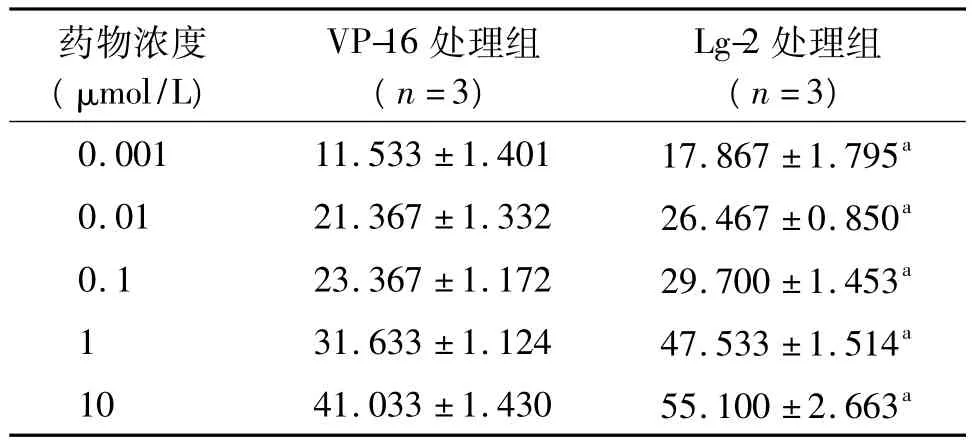
表1 不同浓度VP-16、Lg-2对HepG-2细胞抑制率比较(±s,%)
注:VP-16:依托泊苷,Lg-2:N-(1-烃氧基-2,2,6,6-四甲基-4-哌啶基氧羰基)-L丙氨酸-4'-去甲-4-脱氧鬼臼酯;与VP-16处理组相同药物浓度比较,aP<0.05
药物浓度(μmol/L)VP-16处理组(n=3)Lg-2处理组(n=3)0.001 11.533 ±1.401 17.867 ±1.795a 0.01 21.367 ±1.332 26.467 ±0.850a 0.1 23.367 ±1.172 29.700 ±1.453a 1 31.633 ±1.124 47.533 ±1.514a 10 41.033 ±1.430 55.100 ±2.663a
表2 VP-16、Lg-2不同作用时间对HepG-2抑制率的影响(±s,%)
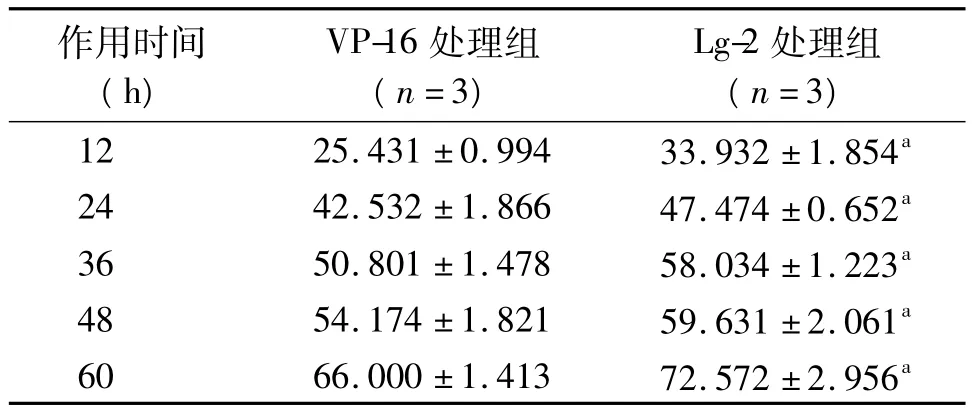
表2 VP-16、Lg-2不同作用时间对HepG-2抑制率的影响(±s,%)
注:VP-16:依托泊苷,Lg-2:N-(1-烃氧基-2,2,6,6-四甲基-4-哌啶基氧羰基)-L丙氨酸-4'-去甲-4-脱氧鬼臼酯;与VP-16处理组相同作用时间比较,aP<0.05
作用时间(h)VP-16处理组(n=3)Lg-2处理组(n=3)12 25.431 ±0.994 33.932 ±1.854a 24 42.532 ±1.866 47.474 ±0.652a 36 50.801 ±1.478 58.034 ±1.223a 48 54.174 ±1.821 59.631 ±2.061a 60 66.000 ±1.413 72.572 ±2.956a
2.2 Lg-2对HepG-2细胞周期的影响 流式细胞仪检测显示,在24及48 h时,Lg-2处理组S期细胞所占比例与阴性对照组及VP-16处理组比较均明显增加,而G2/M期细胞显著减少,提示Lg-2可使细胞阻滞在G2/M期,见表3。
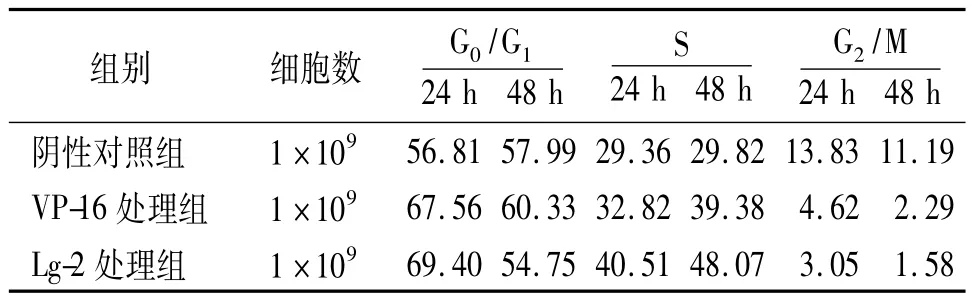
表3 Lg-2对HepG-2细胞周期分布的影响(%)
2.3 细胞凋亡的形态学变化 Hoechst33258染色显示,Lg-2处理组细胞核呈现不同程度的早期凋亡特征,如染色质致密浓缩,胞核体积变小,形状变为肾型核,或细胞核裂解为碎块,产生凋亡小体,典型的呈梅花瓣状;而阴性对照组细胞细胞核完整,染色质均匀,无凋亡特征。见图2。
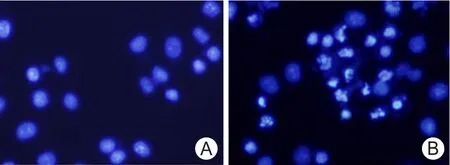
图2 Hoechst33258检测Lg-2对HepG-2细胞凋亡的影响
2.4 Lg-2对HepG-2细胞凋亡相关基因表达的影响 qRT-PCR检测结果显示,与VP-16处理组比较,Lg-2处理组Bc1-2 mRNA的表达显著降低(P<0.05),而 p53、Bax、p21、Caspase-3 mRNA 的表达显著增高(P<0.05),见表4。
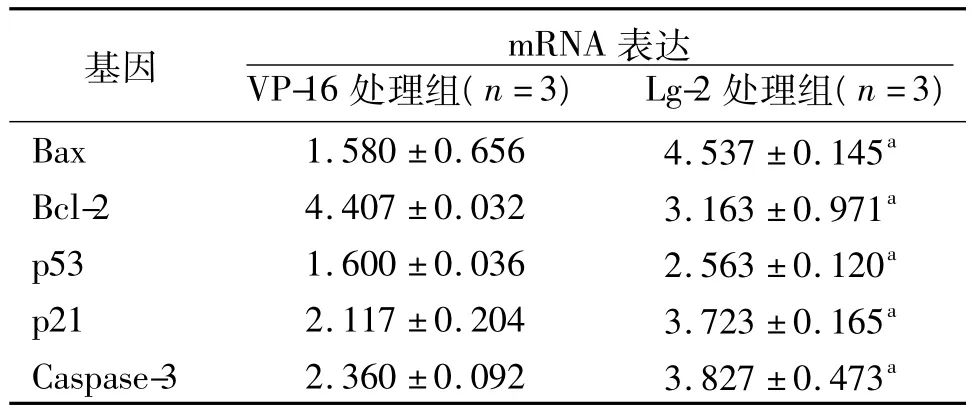
表4 Lg-2对HepG-2细胞凋亡相关基因表达的影响
3 讨论
鬼臼毒素类药物如VP-16是细胞周期依赖性和特异性抗肿瘤药物,主要通过作用于DNA拓扑异构酶Ⅱ(topoisomeraseⅡ)使DNA断链而产生抗肿瘤作用[7]。笔者所在课题组以鬼臼毒素为基础,合成了一系列结构新颖且具有较好抗肿瘤活性的鬼臼毒素衍生物。其中Lg-2是以丙氨酸作为Linker连接氮氧自由基生成一个新型的去甲表鬼臼酯化合物,有文献报道,该基团本身具有一定抗肿瘤作用,并可作为抗肿瘤药物载体使其优先聚积在肿瘤组织中[8]。本研究结果显示,Lg-2能够有效抑制人肝癌细胞系HepG-2的增殖,MTT检测结果显示Lg-2对HepG-2的作用呈时间依赖及剂量依赖性。Lg-2处理的HepG-2细胞,应用流式细胞仪分析其周期变化,G2/M期细胞比例显著减少,提示Lg-2可使细胞阻滞在G2/M期,这与VP-16引起细胞周期S期阻滞有所不同,提示Lg-2可能具有其他的作用靶点。qRT-PCR结果显示,与VP-16处理组比较,Lg-2处理组 Bc1-2 mRNA的表达显著降低,而 p53、Bax、p21、Caspase-3 mRNA的表达显著增高。
细胞凋亡受多种凋亡相关基因调控[9],目前研究较为深入的与肿瘤发生发展密切相关的凋亡相关基因主要有p53基因、Caspase基因、Bcl-2基因家族等。近年来的研究表明,许多抗癌药物通过诱导凋亡基因(如p53、Bax等)的表达,以及影响凋亡抑制基因(如 Bcl-2)的表达,达到抑制肿瘤增殖的作用[10]。p53 基因是一种肿瘤抑制基因[11],分为野生型(wtp53)和突变型(mtp53)两种[12]。野生型 p53基因可抑制细胞的异常增殖,能在细胞发生DNA损伤时使细胞停滞于G1/S期,使细胞有足够时间修复损伤的DNA,恢复正常状态;若损伤的DNA无法修复,则野生型p53基因可启动细胞凋亡机制。p53可以上调Bax的表达、下调Bc1-2的表达共同完成促进细胞凋亡的作用。Bcl-2基因是重要的抗细胞凋亡的调控因子,是Bcl基因家族的一个重要成员,是一种调控细胞死亡的“存活基因”[13]。Bcl-2可抑制细胞的程序性死亡,并提供了一个选择性的生存优势。Bc1-2蛋白具有离子通道和停靠蛋白的双重作用,主要定位于内质网、核膜、线粒体膜上,它可以嵌入到膜中,将Bcl-2固定在膜上。目前认为,Bcl-2抑制细胞凋亡的机制可能与凋亡促进基因Bax拮抗,抑制细胞色素C自线粒体释放到胞质,阻止细胞色素C对Caspase蛋白酶激活有关。Bcl-2还能促进谷胱甘肽进入细胞核,从而改变核内的氧化还原反应,阻止Caspase蛋白酶的活动和其他核改变,抑制细胞凋亡发生[14]。p21基因是野生型p53基因的下游基因,在p21基因上游有2个p53蛋白特殊序列结合位点,分别位于2400和8000 bp处。大量研究报道显示p21有促进细胞凋亡的作用,当DNA受到损伤时,p21通过p53依赖性途径修复受损的DNA,当修复失败时,p53则介导受损细胞凋亡[15]。因此p21基因通过p53依赖性途径间接参与了细胞凋亡。本实验发现,HepG-2细胞经Lg-2处理后,p53转录水平增加,Bc1-2基因表达降低,Bax基因表达增强,使得Bax/Bcl-2上调,诱导凋亡。此外,Lg-2激活p21的表达促进细胞凋亡。在细胞内所发生的与凋亡有关的一系列有序的级联反应中,Caspase蛋白水解酶的激活是关键步骤,Caspase-3是Caspase家族成员中执行凋亡的关键酶之一,在各种类型的细胞中广泛分布,处于凋亡有序级联反应的下游,在细胞内以无活性的前体(酶原)形式存在,被细胞外凋亡信号激活后,负责对全部或部分关键性蛋白的酶切(激活或灭活),导致细胞凋亡[16]。本实验发现,用HepG-2细胞经 Lg-2后 Caspase-3 mRNA的水平上升,说明 Lg-2可能通过上调Caspase-3 mRNA水平来诱导肿瘤细胞凋亡[17]。
综上所述,Lg-2可能通过使细胞周期阻滞在G2/M期抑制细胞增殖,并通过p53、p21、Caspase-3信号途径诱导其凋亡达到抑制肿瘤生长的目的。本研究为开发新的肝癌辅助用药提供了理论依据,将有利于指导相关临床前研究的开展。
[1]Brene S,Bjonebekk A,Aberg E,et al.Running is rewarding and antidepressive[J].Physiol Behav,2007,92(1/2):136.
[2]吕晶晶,张予阳,陈虹,等.鬼臼毒素衍生物CIP-36诱导KBV200细胞凋亡[J].中国药理学通报,2010,26(5):607.
[3]许重远,贾江滨.4'-去甲表鬼白毒素衍生物4β-取代结构修饰研究进展[J].中草药,2000,31(5):389-392.
[4]万宗明,陈虹,曹鸿,等.黄酸鬼白毒素酯对人骨肉瘤细胞作用机制的研究[J].中草药,2008,39(1):67-71.
[5]Dinsdale D,Lee J C,Dewson G,et al.Intermediate filaments control the intracellular distribution of caspases during apoptosis[J].Am J Pathol,2004(164):395-407.
[6]扬桦,田暄,张辅民.4-β-卢代芳香酸4'去甲表鬼臼酯类的合成及抗肿瘤活性[J].兰州大学学报(自然科学版),2004,38(2):101-105.
[7]Chen M C,Pan S L,Shi Q,et al.QS-ZYX-1-61 induces apoptosis through topoisomeraseⅡin human non-smallcell lung cancer A549 cells[J].Cancer Sci,2012,103(1):80-87.
[8]张晓文,贾正平,孟富敏,等.4-[4"(2",2",6",6"-四甲基哌啶氮氧自由基)氨基]4'-去甲表鬼臼毒与其自由基还原物的抗肿瘤作用比较[J].中国药理学通报,1997,13(1):28-30.
[9]宋娜,金波,刘云鹏,等.非小细胞肺癌组织COX-2和p53表达及临床意义的研究[J].中华肿瘤防治杂志,2008,15(16):1247-1250.
[10]Heath Engel H M,Wang B,Shore G C,et al.Bcl2 at the endoplasmic reticulum protects against a Bax/Bak-independent paraptosis like cell death pathway initiated via p20Bap31[J].Biochim Biophys Acta,2012,1823(2):335-347.
[11]Kim J S,Kim J W,Han J,et al.Cohypemethylation of p16 and FHIT promoters as a prognostic factor of recurrence in surgically resected stageⅠnon small cell lung cancer[J].Cancer Res,2006,66(8):4049-4054.
[12]何静华,李胜水,许华,等.结肠癌中ILK及p53的表达情况及其预后意义[J].中国当代医药,2013,20(7):9-10.
[13]Gonzalez Rodilla I,Verna V,Muoz A B,et al.Expression of the apoptosis-related genes Bcl-2 and P53 in clinical samples from endometrial carcinoma patients[J].Anticancer Res,2011,31(12):4191-4193.
[14]程向东,杜义安,黄灵,等.苦参碱在调节Bax和Bcl-2蛋白表达诱导HepG2细胞凋亡中的作用[J].中国肿瘤临床,2008,35(12):711-713.
[15]Spierings D C J,de Vries E G E,Stel A J,et al.Low P21(Wafl/Cipl)protein level sensitizes testicular germ cell tumor cells to Fas-mediated apoptosis[J].Oncogene,2004,23(28):4862-4872.
[16]Lakhani S,Masud A,Kuida K,et al.Caspases3 and 7:key mediators of mitochondrial events of apoptosis[J].Science,2006,311(5762):847-851.
[17]Lavrik I N.Systems biology of apoptosis signaling networks[J].Curt Opin Biotechnol,2010,21(4):551-555.

