丹参化学成分及丹参提取物对脂多糖刺激大鼠肝脏枯否细胞内P38和NF-κB信号通路蛋白表达的影响
李俊杰,沈 敏,李 霄,岳树强
枯否细胞(kupffer cell,KC)是肝内单核/巨噬细胞系统的主要成员,其生物功能具有两面性,一方面能清除细菌及毒素发挥抗感染作用,另一方面通过释放各种炎症介质放大炎症反应而造成组织损伤[1]。此外,KC还可影响肝细胞、星状细胞、内皮细胞等肝内主要组成细胞的生物学功能。因此,KC在慢性炎性肝损伤过程中发挥重要的作用[2]。KC内的核转录因子-κB(nuclear factor-κB,NF-κB) 和P38是介导内毒素等多种致炎因子所致肝损害的重要分子通路,而阻断NF-κB和P38信号通路可抑制IL-1、TNF-α等促炎因子介导的炎症正反馈环,减轻炎症程度[3-4]。丹参是唇形科鼠尾草属植物丹参(Salvia Miltiorrhiza Bge.)的干燥根茎,为传统活血化瘀中药,具有抗缺氧、改善微循环、降血压、抗心肌缺血等作用。目前研究表明,丹参对慢性肝损伤也有较好疗效,但因丹参成分复杂,其具体机制尚不清楚。已有研究报道,丹参可增强KC的吞噬功能,降低其分泌功能。但丹参的化学成分对KC内P38和NF-κB信号通路相关蛋白表达的影响未见报道。本研究以脂多糖(lipopolysaccharide,LPS)激活的大鼠肝脏KC为模型,观察丹参各成分及丹参提取物对P38和NF-κB信号通路蛋白表达的影响,为临床应用丹参治疗慢性肝病提供理论支持和实验证据。
1 材料与方法
1.1 动物与主要试剂 SD大鼠购自第四军医大学实验动物中心。LPS、吡咯烷二硫代氨基甲酸(PDTC)和SB239063均购自Sigma公司。鼠抗人NF-κB65、磷酸化 NF-κB65(p-NF-κB65)、NF-κB 抑制蛋白(inhibitory-κB,I κB)、P38 丝裂原活化蛋白激酶(mitogen activated protein kinase,P38MAPK)、磷酸化P38MAPK(Phosphorylation mitogen activated protein kinase,p-P38MAPK)和c-fos等单克隆抗体以及羊抗小鼠HRP标记IgG均购自武汉博士德生物工程有限公司。丹参新醌乙(批号:070706)、丹参新酮(批号:070625)、丹参醇A(批号:070120)、丹参酮Ⅰ(批号:070315)、异丹参酮Ⅰ(批号:070315)、丹参新醌甲(批号:070605)、隐丹参酮(批号:030806)、丹参酮Ⅱ A(批号:040616)、丹参酚酸B(批号:060328)及丹参药材均购自西安鸿生生物技术有限公司。
1.2 受试药物的制备 精确称取以上丹参成分及丹参药材各1 g,加95%乙醇回流提取60 min,蒸干乙醇备用。分别取上述受试药物用DMSO溶解制成1 mg/ml的储备液。取0.1 ml储备液加0.9 ml不含血清的 DMEM/F12培养液,混匀,即得100 μg/ml工作液。对照溶液为每 L培养液含DMSO 100 ml。各受试药物临用前在无菌条件下进行配制。
1.3 原代KC分离、培养与传代 参照冯俊明等[5]介绍的方法。无菌切取SD大鼠肝脏,以0.05%的Ⅳ型胶原酶灌注肝脏,待肝脏变软后剥离肝包膜并制成细胞悬液,过150目筛网;收集细胞悬液以500 r/min的速度离心2 min,收集上清,再重复离心3次,每次取上清;将上清再以1500 r/min的速度离心3 min,弃沉淀;加 20 ml Hank's液,混匀后500 r/min的速度离心2 min,取上清,重复离心1次。将所获上清以1500 r/min的速度离心3 min,取沉淀细胞,重复洗涤1次。沉淀细胞用含200 ml/L小牛血清的DMEM/F12培养液以3000 r/min的速度离心洗涤2次,每次10 min。4 g/L台盼蓝拒染检测细胞活力后,调整细胞密度为1×1011/L,接种于75 cm2培养瓶内,置于37℃、50 ml/L CO2孵箱内培养,经消化法反复传代纯化后用于试验。
1.4 免疫印记法(Western blot)检测KC内P38、NF-κB信号通路蛋白及c-fos蛋白 取传3代以上的KC接种于25 cm2培养瓶。待细胞生长融合至60%~70%时,将其分为以下14组:对照组、LPS组、PDTC组、SB239063组、丹参新醌乙组、丹参新酮组、丹参醇A组、丹参酮Ⅰ组、异丹参酮Ⅰ组、丹参新醌甲组、隐丹参酮组、丹参酮ⅡA组、丹参酚酸B组和丹参提取物组。除对照组外,其余各组均加入60 ng/ml LPS作用12 h。培养结束后,除LPS组外,其余各组均弃除培养上清并按照上述分组分别加入相应的丹参成分或提取物100 μg/ml、PDTC 10 mmol/L和SB239063 10 mmol/L,再培养12 h。培养结束后,收集上述各组KC,用预冷的PBS洗涤2次;吸尽水分后加入RAPI组织细胞裂解液适量,用刮勺将蛋白收集至1.5 ml EP管内;4℃静置30 min、离心、BCA定量后调整蛋白量30 μg/泳道,经10%SDS-PAGE电泳,半干转膜、封闭;4℃条件下分别与NF-κB65、p-NF-κB65、I κB、p-I κB、P38MAPK、p-P38MAPK、c-fos的单抗孵育(1∶500~1000)过夜,加入辣根过氧化物酶标记的二抗(1∶5000),化学发光、显影、压片,灰度扫描。以各组目的蛋白表达灰度值与阴性对照组目的蛋白表达灰度值的比值为最终结果。以β-肌动蛋白(β-actin)作为内参照物。
1.5 统计学处理 应用SPSS 14.0软件进行统计学分析,数据以±s表示。两样本均数比较采用两样本t检验,多样本均数比较采用完全随机设计方差分析,组间比较采用SNK-q检验。α=0.05为检验水准。
2 结果
2.1 丹参化学成分及丹参提取物对KC内P38信号通路蛋白表达的影响 与LPS组比较,PDTC显著下调 p-P38MAPK表达(P<0.05),而不下调P38MAPK;SB239063显著下调P38MAPK表达(P<0.05),而不下调p-P38MAPK;丹参新醌乙、丹参酮ⅡA与丹参酚酸B对P38MAPK的表达无影响;所有丹参成分和丹参提取物均能不同程度下调p-P38MAPK的表达(P<0.05)。见表1、图1。
表1 丹参化学成分及丹参提取物对KC内P38信号通路蛋白表达的影响(±s)

表1 丹参化学成分及丹参提取物对KC内P38信号通路蛋白表达的影响(±s)
注:KC:枯否细胞,LPS:内毒素,PDTC:吡咯烷二硫代氨基甲酸,P38MAPK:P38丝裂原活化蛋白激酶,p-P38MAPK:磷酸化P38丝裂原活化蛋白激酶;-:未检测到;与LPS组比较,aP<0.05
组别P38MAPK p-P38MAPK阴性对照组1.00 ±0.00 1.00 ±0.00 LPS 组 1.68 ±0.04 1.33 ±0.01 PDTC 组 1.61 ±0.02 0.63 ±0.04a SB239063 组 0.71 ±0.01a 1.11 ±0.03丹参新醌乙组 1.75 ±0.01 0.57 ±0.01a丹参新酮组 0.64±0.01a -丹参醇A组 0.55±0.03a -丹参酮Ⅰ组 0.82±0.04a -异丹参酮Ⅰ组 0.29±0.01a -丹参新醌甲组 0.56±0.01a -隐丹参酮组 0.79±0.03a -丹参酮ⅡA组 1.48±0.04 -丹参酚酸 B 组 1.52 ±0.05 0.90 ±0.01a丹参提取物组 1.06 ±0.01a 0.93 ±0.03a

图1 丹参化学成分及丹参提取物对枯否细胞内P38信号通路蛋白表达的影响
2.2 丹参化学成分及丹参提取物对KC内NF-κB信号通路蛋白表达的影响 与LPS组比较,PDTC和SB239063显著上调 KC内NF-κB65和 IκB的表达,并下调p-NF-κB65蛋白的表达(P<0.05);隐丹参酮对NF-κB65的表达无影响;丹参酮ⅡA与丹参酚酸B对NF-κB65表达无影响,但显著上调IκB的表达;其余受试丹参成分和丹参提取物均显著下调NF-κB65和 IκB 表达(P <0.05);所有受试丹参成分和丹参提取物均明显下调p-NF-κB65蛋白表达(P <0.05)。见表2、图2。
表2 丹参化学成分及丹参提取物对KC内NF-κB信号通路蛋白表达的影响(±s)
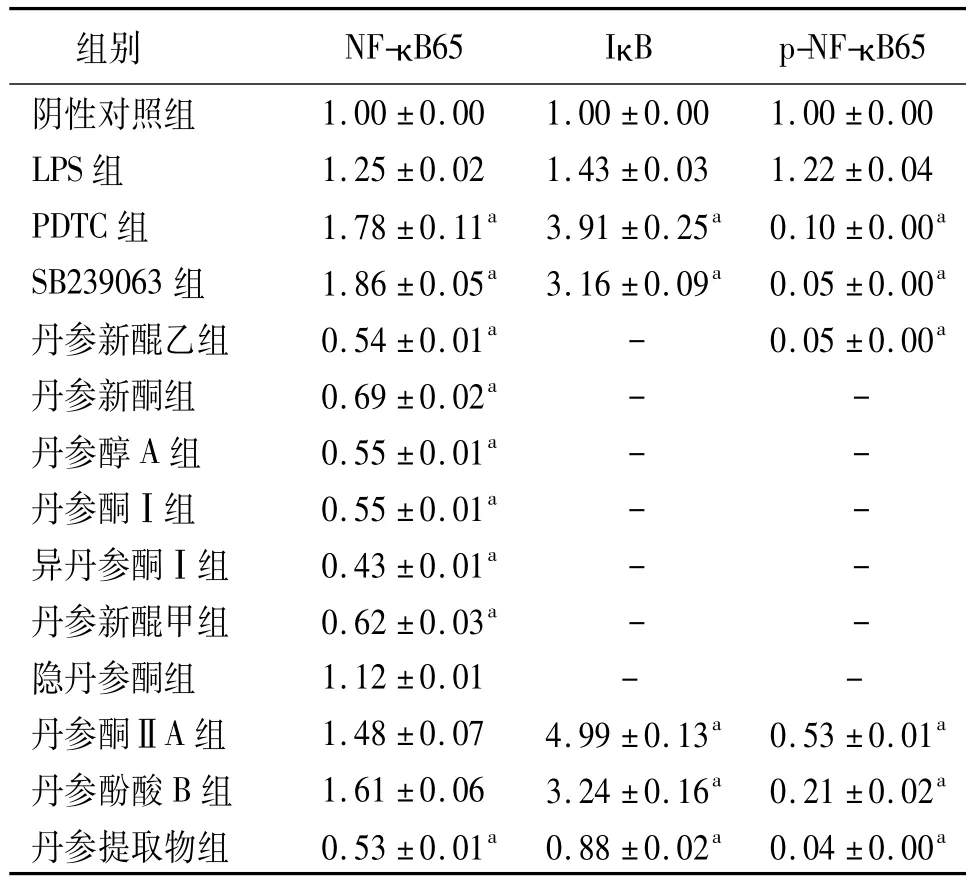
表2 丹参化学成分及丹参提取物对KC内NF-κB信号通路蛋白表达的影响(±s)
注:KC:枯否细胞,LPS:内毒素,PDTC:吡咯烷二硫代氨基甲酸,NF-κB65:核转录因子-κB65,I κB:核转录因子-κB 抑制蛋白,p-NF-κB65:磷酸化核转录因子-κBp65;-:未检测到;与LPS组比较,aP<0.05
组别 NF-κB65 IκB p-NF-κ 1.00 ±0.00 1.00 ±0.00 1.00 ±0.00 LPS 组 1.25 ±0.02 1.43 ±0.03 1.22 ±0.04 PDTC 组 1.78 ±0.11a 3.91 ±0.25a 0.10 ±0.00a SB239063 组 1.86 ±0.05a 3.16 ±0.09a 0.05 ±0.00a丹参新醌乙组 0.54±0.01a - 0.05±0.00a丹参新酮组 0.69±0.02a - -丹参醇A组 0.55±0.01a - -丹参酮Ⅰ组 0.55±0.01a - -异丹参酮Ⅰ组 0.43±0.01a - -丹参新醌甲组 0.62±0.03a - -隐丹参酮组 1.12±0.01 - -丹参酮ⅡA 组 1.48 ±0.07 4.99 ±0.13a 0.53 ±0.01a丹参酚酸 B 组 1.61 ±0.06 3.24 ±0.16a 0.21 ±0.02a丹参提取物组 0.53 ±0.01a 0.88 ±0.02a 0.04 ±0.00 B65阴性对照组a
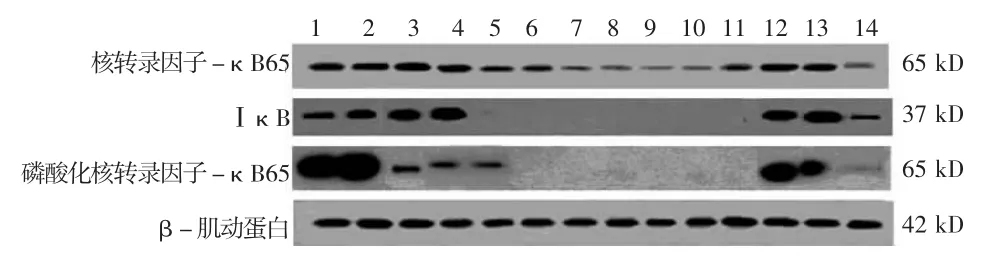
图2 丹参化学成分及丹参提取物对枯否细胞内核转录因子-κB信号通路蛋白表达的影响
2.3 丹参化学成分及丹参提取物对KC内c-fos信号通路蛋白表达的影响 与LPS组比较,SB239063显著下调c-fos蛋白的表达(P<0.05),而PDTC对c-fos蛋白的表达无影响。受试丹参化学成分和丹参提取物均能不同程度下调c-fos蛋白的表达(P<0.05)。见表3、图3。
表3 丹参化学成分及丹参提取物对KC内c-fos信号通路蛋白表达的影响(±s)
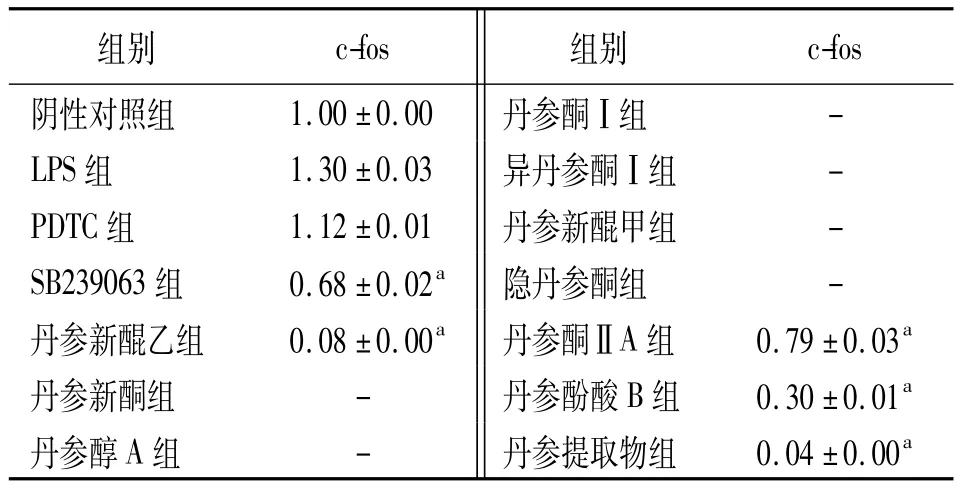
表3 丹参化学成分及丹参提取物对KC内c-fos信号通路蛋白表达的影响(±s)
注:KC:枯否细胞,LPS:内毒素,PDTC:吡咯烷二硫代氨基甲酸;-:未检测到;与LPS组比较,aP<0.05;
组别 c-fos 组别c-fos阴性对照组 1.00±0.00 丹参酮Ⅰ组 -LPS组 1.30±0.03 异丹参酮Ⅰ组 -PDTC组 1.12±0.01 丹参新醌甲组 -SB239063组 0.68±0.02a 隐丹参酮组 -丹参新醌乙组 0.08±0.00a 丹参酮ⅡA组 0.79±0.03a丹参新酮组 - 丹参酚酸B组 0.30±0.01a丹参醇A组 - 丹参提取物组 0.04±0.00a
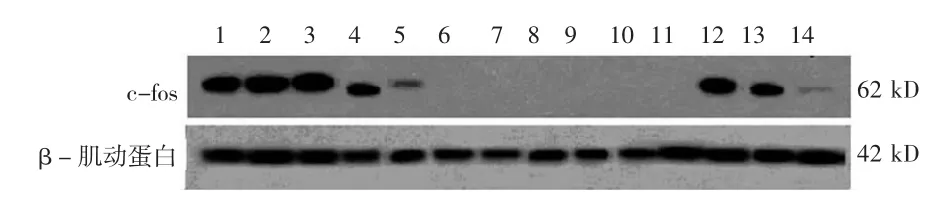
图3 丹参化学成分及丹参提取物对枯否细胞内c-fos信号通路蛋白表达的影响
3 讨论
3.1 丹参提取物及各化学成分对P38信号通路蛋白表达的影响 P38是介导炎症反应的重要通路蛋白,激活的P38可促进许多炎性细胞因子的表达,参与应激条件下细胞炎症反应和细胞凋亡过程[6]。活化的P38MAPK和NF-κB信号转导通路是LPS介导的炎症细胞因子如TNF-α、IL-6和IL-8等分泌的重要分子机制。Carl等[7]应用Northern blot分析发现,对细胞用SB203580进行预处理,可降低细胞中IL-1α mRNA水平的表达,而且这种抑制作用显著减少单核细胞的TNF-α产量。这充分说明P38在LPS诱导TNF-α生成中的重要性。P38家族包含有P38α、P38β、P38γ 和 p38δ 4 种亚型,但只有 P38α和P38β能被SB203580所抑制。本研究采用一致剂量水平、平行操作方法研究了丹参提取物和丹参化学成分对LPS激活KC内P38通路蛋白表达的影响。结果显示,丹参新醌乙、丹参酮ⅡA与丹参酚酸B对P38MAPK的表达无影响,但所有丹参成分和丹参提取物均能不同程度下调p-P38MAPK的表达,其抑制 P38信号通路蛋白作用强于 SB239063。SB239063对LPS激活的KC内p-P38MAPK无明显抑制作用,而显著抑制下游蛋白c-fos。c-fos在细胞生产调节和胞内信号传递分泌中具有极为重要的作用,藕联细胞外信息与细胞内靶基因的转录[8],抑制c-fos入核可使炎性细胞因子转录与蛋白合成受阻从而使炎症减轻。丹参提取物和丹参化学成分明显下调c-fos表达,作用强度与SB239063相似,但丹参酚酸B和丹参酮IIA要弱一些。
3.2 丹参提取物及各化学成分对NF-κB信号通路蛋白的影响 NF-κB是一类能与多种基因启动子部位的B位点发生特异结合并促进转录的核蛋白,通过对许多重要的细胞因子、黏附分子和趋化因子表达的调控,从而参与机体的炎症反应的调节[9]。大量的研究证实,NF-κB的过度活化是炎症介质产生的关键环节[10]。因此,抑制 NF-κB的过度活化可减少炎症介质的表达、释放,减轻严重创伤后组织器官的病理性损害,有利于创伤组织的修复。以NF-κB通路为潜在的治疗位点,寻找增强机体防御功能、遏制细胞因子过度产生的措施,可能在以后的临床实践中为解决失控性炎症反应而采用丹参提供了理论依据。本研究表明,丹参提取物和丹参化学成分对LPS激活KC内NF-κB信号通路蛋白表达有差异性调控作用。丹参酮ⅡA和丹酸酚酸B上调亚单位 I κB 表达,下调 p-NF-κB65的表达,结果与PDTC相似。其余丹参成分和丹参提取物可下调NF-κB65、I κB 和 p-NF-κB65 的表达,调节炎性细胞因子相关蛋白和黏附分子的表达,影响细胞的状态和功能[11]。
3.3 P38与NF-κB信号通路蛋白之间的调控关系本研究结果显示,当用LPS激活KC后,细胞信号通路蛋白阻断剂PDTC和SB239063上调NF-κB65和I κB表达,下 调p-NF-κB65表达,说明两者抑制NF-κB通路的主要效应是阻断亚单位p-NF-κB65。PDTC对p-P38MAPK表达有抑制作用,而SB239063对p-P38MAPK无明显抑制作用,其主要作用是抑制下游蛋白c-fos。PDTC对KC内的c-fos却无抑制作用,其主要抑制作用位点在 p-NF-κB65;SB239063和PDTC在P38和NF-κB两信号通路蛋白中产生协同作用。
综上所述,丹参可抑制LPS对KC的激活作用,限制KC介导的炎症反应,其主要机制可能是下调P38MAPK-NF-κB65-c-fos通路蛋白的活性,但不同的丹参化学成分作用的靶分子不同。值得注意的是,有报道SB203580可以抑制NF-κB依赖的转录过程,但本实验发现NF-κB65信号通路蛋白阻断剂PDTC对p-P38MAPK也有强烈的抑制作用,且作用强度明显高于SB239063。按推论P38是NF-κB65的上游蛋白,那为何抑制了下游蛋白,上游蛋白也要减少,是否PDTC在抑制NF-κB65的同时,p-P38MAPK也是其作用位点,这些疑问尚需实验证实。
[1]Kolios G,Valatas V,Kouroumalis E.Role of Kupffer cells in the pathogenesis of liver disease[J].World J Gastroenterol,2006,12(46):7413-7420.
[2]Luckey S W,Petersen D R.Activation of Kupffer cells during the course of carbon tetrachloride-induced liver injury and fibrosis in rats[J].Exp Mol Pathol,2001,1(3):226-240.
[3]Li S,Wu C,Shi Y.Lipopolysaccharide up regulates expression of CD14 gene and CD14 protein of hepatocytes in rats[J].Zhonghua Gan Zang Bing Za Zhi,2001,9(2):103-104.
[4]Yang L,Magness S T,Bataller R,et al.NF-κB activation in Kupffer cells after partial hepatectomy[J].AMJ Physiol Gastrointest Liver Physiol,2005,289(3):530-538.
[5]冯俊明,史景泉,刘友生,等.大鼠肝脏枯否细胞分离、培养与鉴定[J].第三军医大学学报,2002,24(2):223-224.
[6]Segal R A,Greenberg M E.Intracellular signaling pathways activated by neurotrophic factors[J].Annu Rev Neurosci,1996,19(3):463-489.
[7]Carl V S,Brown Steinke K,Nicklin M J,et al.Toll-like receptor 2 and 4(TLR2 and TLR4)agonists differentially regulate secretory Interleukin-1 receptor antagonist gene expression in macrophages[J].J Biol Chem,2002,277(20):17448-17456.
[8]Schneider A,Martin Villalba A,Weih F,et al.NF kappa B is activated and promotes cell death in focal cerebral ischemia[J].Nat Med,1999,5(5):554-559.
[9]Takeda K,Ichijo H.Neuronal p38 MAPK signaling:an emerging regulator of cell fate and function in the nervous system[J].Genes Cells,2002,7(11):1099-1111.
[10]潘曙明,陈德昌,杨兴易.核因子-κB研究与脓毒症[J].中华急诊医学杂志,2002,11(1):62-63.
[11]Berti R,Williams A J,Moffett J R,et al.Quantiative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia-reperfusion brain injury[J].Cereb Blood Flow Metab,2002,22(9):1068-1079.

