抗坏血酸与神经退行性疾病
徐 丹 刘晓莉 乔德才 康道峰(北京师范大学体育与运动学院,北京 00875)
维生素C作为一种重要的水溶性维生素,具有防治坏血病的功效,故又名为抗坏血酸(ascorbic acid,AA)。人们对AA的研究已有260多年的历史,早期主要集中于AA的抗氧化作用〔1〕,近年来研究发现AA还可作为神经调质,参与多种神经元信息传递和电活动的调节〔2〕,由此引起学者们对AA与脑功能及神经退行性疾病治疗作用的关注。本文就中枢神经系统(central nervous system,CNS)内AA的生理功能进行综述,分析其在疾病中的治疗意义,探讨其对神经元保护作用的机制。
1 AA的分子结构与代谢特征
AA是由6个碳原子、8个氢原子和6个氧原子构成的酸性多羟基化合物,由于它具有2个可电离的氢离子,所以在生理条件下是一种带负电荷的离子〔3〕;分子中2、3号碳原子上相邻的两个烯醇式羟基容易解离释放氢离子,因此AA虽然没有羧基,但其水溶液略显酸性,仍具有有机酸的性质。
AA在哺乳类动物的肝脏内合成,以右旋葡萄糖为底物,经过一系列的反应步骤(右旋葡萄糖→葡萄糖醛酸内酯→古洛糖酸→古洛糖酸内酯→AA),在古洛糖酸内酯氧化酶的催化作用下合成AA进入血液。人体肝脏中缺乏古洛糖酸内酯氧化酶,自身不能合成AA,只能从食物中摄取经小肠上段吸收进入血液,又经血液运送到各个组织和器官〔4〕。
体内AA的代谢是一个循环过程,首先失去一个电子生成AA自由基(AFR),两分子的AFR经歧化反应生成一分子AA和一分子脱氢抗坏血酸(DHA);DHA可通过体内的一些还原机制〔如:还原型谷胱甘肽(GSH)直接还原、硫醇转移酶和NADPH依赖型还原酶〕被还原成AA〔9〕。DHA的化学性质很不稳定,容易水解生成二酮古洛糖酸,且这一过程是不可逆的。如果DHA的生成速度超过了其还原为AA或水解为二酮古洛糖酸的速度,两个分子的DHA便可聚合生成一分子的脱氢抗坏血酸半缩酮,通过易化葡萄糖转运载体进行跨膜运输;最终被分解成草酸或与硫酸结合生成抗坏血酸-2-硫酸由尿排出体外,也有少部分直接由尿液排出体外〔5〕。
2 脑内AA的分布与转运
2.1 脑内AA的分布 大鼠不同组织中AA分布存在明显差异。血浆中AA浓度约为40~60 μmol,脑脊液(CSF)中约为200~400 μmol,脑神经元内的浓度可达2~10 mmol;从外周到中枢AA浓度呈现逐级递减的趋势〔5〕。AA在脑区的分布也不均匀,存在明显的区室效应,且与神经元密度呈线性相关。脑前部区域如皮层和海马中浓度较高,而脑后部区域如脑干和脊髓中浓度最低;从前脑到后脑 AA浓度呈现逐级递减的趋势〔6〕。
2.2 脑内AA的转运 外周AA进入CSF主要通过以下两种途径〔2〕:(1)在脉络丛(choroid plexus)处,AA借助抗坏血酸转运体(SVCT2),以Na+依赖性的主动转运方式进入CSF,并以此方式进入神经元内。(2)在血脑屏障(blood brain barrier)处,AA以DHA的方式,经易化葡萄糖转运体(GLUT)进入CSF,并以此种方式进入神经元和星型胶质细胞(astrocyte)内。当脑内AA浓度减少时,神经胶质细胞内的DHA还原为AA,移出细胞,进入神经元,由此构成了神经元与神经胶质细胞之间的AA循环,使脑内的AA浓度始终处于动态平衡(图1)〔7〕。
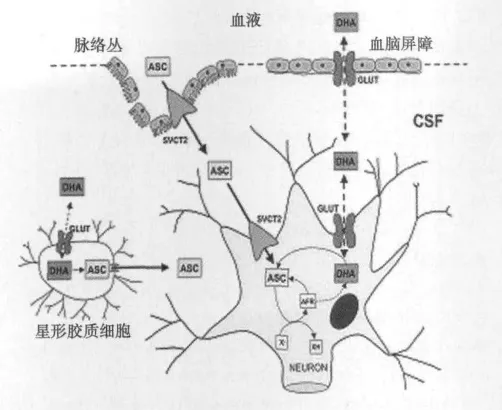
图1 AA进入CNS的主要途径
3 AA对神经元的保护作用
3.1 AA与抗氧化 AA是目前公认的具有抗氧化作用的物质〔8〕。在生理条件下,它以烯二醇结构存在,这种结构具有电子供体特征;脑内物质代谢产生大量的自由基,获得AA失去的电子后形成稳定的结构,避免CNS遭受过量自由基的氧化损伤,保护了神经元结构和功能的完整性〔1〕。
Brahma等〔9〕通过给脑水肿的大鼠脑片培养基中添加400 μmol AA,34℃培养3 h,发现 H2O2含量减少,水肿程度减小;说明神经元胞内AA含量的增大可以减轻氧化应激引起的水肿,保护神经组织。Li等〔10〕采用SY5Y神经母细胞作为研究对象,向细胞培养基中添加50 μmol的AA,采用高相色谱与电化学结合的方法检测细胞内外GSH及丙二醛(MDA)和AA含量;发现向培养基中添加50 μmol浓度的AA后,神经细胞中GSH和MDA含量与对照组相比显著降低,说明AA可以避免减轻神经细胞的氧化损伤。
3.2 AA与神经元的电活动 Sandstrom等〔11〕采用剔除神经细胞SVCT2转运体的方法,阻止胞外AA转运入胞内,进行离体培养这些细胞时发现,细胞之间有树突形成,且微型兴奋性突触后电流也有增加趋势,说明低浓度的AA能促进神经元成熟。Cortright等〔12〕采用外源性注射AA的方法研究其对纹状体神经元电活动的影响,结果发现腹腔注射浓度为500 mg/kg的AA可抑制纹状体神经元放电活动;注射浓度为1000 mg/kg的AA后纹状体神经元放电活动被明显抑制,且神经元电活动的抑制效应与外源性注射AA的浓度呈正相关。Rebec等〔13〕的研究发现,皮层-纹状体谷氨酸(Glutamic acid,Glu)能神经投射对纹状体胞外 AA浓度非常敏感,向纹状体透析200~500 μmol AA后能明显增大经皮层诱导的纹状体Glu能神经元放电活动的幅度和时程。
3.3 AA与神经递质的释放 Glu是CNS中最为重要的内源性氨基酸,也是哺乳动物脑内含量最高的一种兴奋性神经递质〔14〕。研究表明,在缺血缺氧等病理条件下,脑内Glu过量释放并堆积到胞外,使NMDA受体过度激活,引起Ca2+大量流入胞内,会导致“钙超载效应”和神经元死亡〔15〕。AA具有调节Glu释放的作用,主要通过AA与Glu之间的异型交换机制;当胞外Glu浓度增高时,AA从胞内溢出,使胞外的Glu进入胞内,减轻Glu对神经元的毒作用(图2)〔16〕。在体研究发现,当大鼠行为活动增多时,纹状体神经元对Glu的释放增加〔17〕,同时胞外AA浓度也明显增大,进一步说明AA可促进Glu的转运,增加纹状体神经元对Glu的敏感性。离体研究也发现,高浓度AA能够调节NMDA受体的氧化还原位点并占据该位点,抑制NMDA受体的活性,阻止Glu与NMDA受体结合,从而避免神经元因Glu过度堆积引起的神经毒性作用,保护神经元发挥正常的生理功能〔18〕。
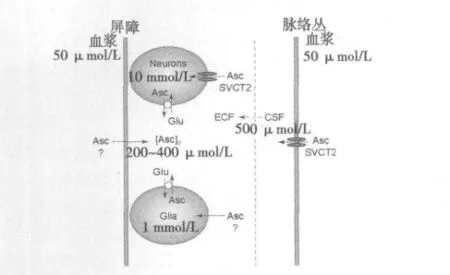
ECF:脑细胞外液;CSF:脑脊液;neurons:神经元细胞;Glia:神经胶质
AA还参与调节多巴胺(dopamine,DA)能神经元介导的突触传递过程〔16〕。AA对DA能神经元的调节主要表现为类似DA拮抗剂的作用,抑制DA与其受体结合,减轻药物引发的纹状体和伏隔核DA的释放〔19〕。同时,AA还可以降低DA转运体以及与DA转运有关的Na+-K+-ATP酶的活性〔20〕。
3.4 AA与中枢能量代谢的调节 Giove等〔21〕采用功能磁共振成像技术、放射自显影技术和正电子断层扫描技术研究发现,当神经元活动增强时局部葡萄糖消耗也明显增加。Quirstoff等〔22〕研究发现,在长时间运动的条件下,单羧乳酸能够作为脑外源性重要的能量来源。Pellerin等〔23〕论证了“乳酸穿梭”假说,并指出在安静状态下神经元优先以葡萄糖作为能源物质,但是在突触活动时,神经元倾向于优先利用乳酸供能。
近年来学者在研究脑能量代谢与AA之间的关系时发现,AA以类似代谢调节开关的作用参与脑能量代谢的调节〔24〕。Glu能突触活动时释放大量的Glu进入突触间隙,突触间隙的Glu在发挥作用后被星形胶质细胞(Astrocyte)摄取,刺激胶质细胞内葡萄糖的转运、糖酵解和乳酸溢出〔25〕。另外,Glu的摄取还可刺激AA从星形胶质细胞释放,并通过SVCT2转运体进入神经细胞内,胞内的AA可抑制葡萄糖消耗,并促进乳酸的转运,从而发挥其对能量代谢的调节作用(图3)〔26,27〕。Kemppainen等〔28〕发现,随着运动强度的增加,大脑皮层的葡萄糖代谢率降低,提示运动过程中脑对于葡萄糖的摄取会随着运动强度的增加而减少,这一研究结果与AA的代谢调节效应相类似。
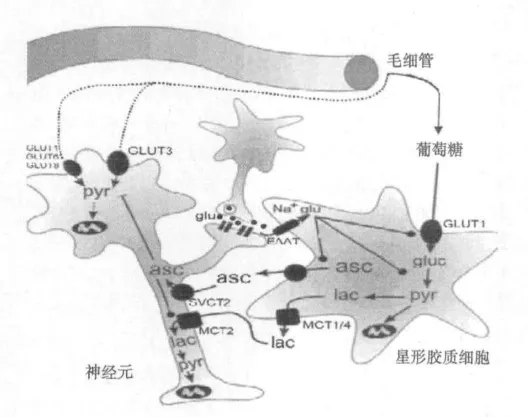
图3 AA调节中枢能量代谢示意图
4 AA与神经退行性疾病
AA作为脑中一种重要的小分子抗氧化物质,除具有重要的抗氧化作用外〔29〕,还能够作为一种类似神经调质参与调节谷氨酸能、多巴胺能、胆碱能以及GABA能神经元的信息传递,参与神经元电活动的调节。神经变性疾病主要病因与高水平的氧化应激有关,因此AA对于亨廷顿病(HD)、阿尔茨海默病(AD)、帕金森病(PD)及脑缺血等病有潜在的治疗作用〔30〕。
4.1 AA与AD AD是一种遗传及生活方式等多种因素引发的疾病,文献报道,氧化应激在此病发生机制中起主要作用,该病会导致基底-前脑胆碱能系统衰退及广泛的细胞死亡〔31〕。AD病人的血浆及CSF中AA有较低水平,尽管病人摄入足够的营养物质。AA补充和此病发病率及于此病相关的氧化应激性物质成正相关。已经证实,AA是治疗AD的常用药〔32〕。
4.2 AA与PD PD病人有严重的CNS多巴胺能信号减少现象出现,运动皮质的多巴胺能信号的减少更为明显。关于AA和多巴胺功能上关系目前研究显示,AA具有潜在治疗意义。尽管大量的研究表明,AA的摄入对PD发展不能产生保护作用,仍有不少实验证明AA作为治疗PD的药物或许更为有效。有学者报道,用VE及VC混合服用对PD模型大鼠具有较好治疗效果,并能降低患病风险〔33〕。
4.3 AA与HD HD是一种由于纹状体神经元缺失而导致的严重运动和认知功能障碍性疾病,其发病机制与神经递质的毒作用及自由基的氧化损伤等因素有关〔34〕。病人CSF内兴奋性神经递质Glu与抑制性神经递质γ-氨基丁酸(gamma-amino butyric acid,GABA)的比例失衡,GABA明显减少,神经元放电频率增加〔35〕。Rebec等〔25〕研究发现,纹状体AA的释放异常会引发HD基因表达。通过腹腔注射有效剂量的AA提高纹状体胞外AA浓度,可改善大鼠运动能力,降低神经元单细胞放电频率〔36〕,使“舞蹈”症状缓解。
HD病理特征表现为纹状体神经元放电活动增强、神经递质变化导致神经毒作用等〔37〕,与运动性中枢疲劳是具有相似中枢表征的。康道峰等〔38〕对AA与运动疲劳的关系进行研究,发现随着大鼠行为活动的增加,纹状体AA浓度逐渐升高;采用腹腔注射AA的干预方法,可有效增加运动大鼠纹状体神经元的兴奋性,改善大鼠行为能力,延长运动至力竭的时间。初步证实AA具有一定的抗疲劳作用。
AA作为一种重要的小分子抗氧化物质已经被人们所认识,但关于脑内AA生理和病理机制的研究尚处于起步阶段。目前的研究初步证实AA可参与神经递质的释放,神经元电活动及能量代谢的调节,对神经元具有保护作用;AA已被用于HD等神经退行性疾病的治疗中,其潜在的治疗作用机制还有待于进一步研究。
1 Rice ME.Ascorbate regulation and its neuroprotective role in the brain〔J〕.Trends Neurosci,2000;23(5):209-16.
2 Morales I,Fuentes A,Ballaz S,et al.Striatal interaction among dopamine,glutamate and ascorbate〔J〕.Neuropharmacology,2012;8:3-25.
3 Nishikimi M,Fukuyama R,Minoshima S,et al.Cloning and chromosomal mapping of the human nonfunctional gene for L-gulono-gamma-lactone oxidase,the enzyme for L-ascorbic acid biosynthesis missing in man〔J〕.J Biol Chem,1994;269(18):13685-8.
4 Harrison FE,May JM.Vitamin C function in the brain:vital role of the ascorbate transporter SVCT2〔J〕.Free Radic Biol Med,2009;46(6):719-30.
5 Frei B,Birlouez-Aragon I,Lykkesfeldt J.Authors'perspective:what is the optimum intake of vitamin C in humans?〔J〕.Crit Rev Food Sci Nutr,2012;52(9):815-29.
6 Miura S,Ishida-Nakajima W,Ishida A,et al.Ascorbic acid protects the newborn rat brain from hypoxic-ischemia〔J〕.Brain Dev,2009;31(4):307-17.
7 Huang J,Agus DB,Winfree CJ,et al.Dehydroascorbic acid,a blood-brain barrier transportable form of vitamin C,mediates potent cerebroprotection in experimental stroke〔J〕.Proc Natl Acad Sci U S A,2001;98(20):11720-4.
8 Arrigoni O,De Tullio MC.Ascorbic acid:much more than just an antioxidant〔J〕.Biochim Biophys Acta,2002;1569(1-3):1-9.
9 Brahma B,Forman RE,Stewart EE,et al.Ascorbate inhibits edema in brain slices〔J〕.J Neurochem,2000;74(3):1263-70.
10 Li X,Huang J,May JM.Ascorbic acid spares alpha-tocopherol and decreases lipid peroxidation in neuronal cells〔J〕.Biochem Biophys Res Commun,2003;305(3):656-61.
11 Sandstorm MI,Rebec GV.Extracellular ascorbic acid modulates glutamate dynamics role of behavioral activation〔J〕.BMC Neurosci,2007;8:32-8.
12 Cortright JJ,Rebec GV.Ascorbate modulation of sensorimotor processing in striatum of freely moving rats〔J〕.Brain Res,2006;1092(1):108-16.
13 Rebec GV,Witowski SR,Sandstrom MI,et al.Extracellular ascorbate modulates cortically evoked glutamate dynamics in rat striatum〔J〕.Neurosci Lett,2005;378(3):166-70.
14 Ruediger T,Bolz J.Neurotransmitters and the development of neuronal circuits〔J〕.Adv Exp Med Biol,2007;621:104-15.
15 Kaufman AM,Milnerwood AJ,Sepers MD,et al.Opposing roles of synaptic and extrasynaptic NMDA receptor signaling in cocultured striatal and cortical neurons〔J〕.J Neurosci,2012;32(12):3992-4003.
16 Castro MA,Beltrán FA,Brauchi S,et al.A metabolic switch in brain:glucose and lactate metabolism modulation by ascorbic acid〔J〕.J Neurochem,2009;110(2):423-40.
17 Criswell HE,Ming Z,Griffith BL,et al.Comparison of effect of ethanol on N-methyl-D-aspartate-and GABA-gated currents from acutely dissociated neurons:absence of regional differences in sensitivity to ethanol〔J〕.J Pharmacol Exp Ther,2003;4(1):192-9.
18 Monnerie H,Hsu FC,Coulter DA,et al.Role of the NR2A/2B subunits of the N-methyl-D-aspartate receptor in glutamate-induced glutamic acid decarboxylase alteration in cortical GABAergic neurons in vitro〔J〕.Neuroscience,2010;171(4):1075-90.
19 Scimemi A,Tian H,Diamond JS.Neuronal transporters regulate glutamate clearance,NMDA receptor activation,and synaptic plasticity in the hippocampus〔J〕.J Neurosci,2009;29(46):14581-95.
20 Bavaresco CS,Zugno AI,Tagliari B,et al.Inhibition of Na+-K+-ATPase activity in rat striatum by the metabolites accumulated in Lesch-Nyhan disease〔J〕.Int J Dev Neurosci,2004;22(1):11-7.
21 Giove F,Mangia S,Bianciardi M,et al.The physiology and metabolism of neuronal activation:in vivo studies by NMR and other methods〔J〕.Magn Reson Imaging,2003;21(10):1283-93.
22 Quirstoff B,Secher NH,Van Lieshout JJ.Lactate fuels the human brain during exercise〔J〕.FASEB J,2008;22(10):3443-9.
23 Pellerin L,Magistretti PJ.Glutamate uptake into astrocytes stimulates aerobic glycolysis:a mechanism coupling neuronal activity to glucose utilization〔J〕.Proc Natl Acad Sci,1994;91(22):10625-9.
24 杨东升,刘晓莉,乔德才.“乳酸穿梭”背景下的运动性疲劳中枢机制研究新进展〔J〕.中国康复医学杂志,2012;27(3):285-8.
25 Rebec GV,Barton SJ,Marseilles AM,et al.Ascorbate treatment attenuates the Huntington behavioral phenotype in mice〔J〕.Neuroreport,2003;14(9):1263-5.
26 Castro MA,Pozo M,Cortés C,et al.Intracellular ascorbic acid inhibits transport of glucose by neurons,but not by astrocytes〔J〕.J Neurochem,2007;102(3):773-82.
27 Castro MA,Angulo C,Brauchi S,et al.Ascorbic acid participates in a general mechanism for concerted glucose transport inhibition and lactate transport stimulation〔J〕.Pflugers Arch,2008;457(2):519-28.
28 Kemppainen J,Aalto S,Fujimoto T,et al.High intensity exercise decreases global brain glucose uptake in humans〔J〕.J Physiol,2005;568(1):323-32.
29 Mendiratta S,Qu ZC,May JM.Erythrocyte ascorbate recycling:antioxidant effects in blood〔J〕.Free Radic Biol Med,1998;24:789-97.
30 Arrigoni Ode,Tullio MC.Ascorbic acid:much more than just an antioxidant〔J〕.Biochim Biopsy's Acta Gen Sub,2002;1569:1-9.
31 Montine T,Neely M,Quinn J,et al.Lipid peroxidation in aging brain and Alzheimer's disease〔J〕.Free Radic Biol Med,2002;33:620-6.
32 Schippling S,Kontush A,Arlt S,et al.Increased lipoprotein oxidation in Alzheimer's disease〔J〕.Free Radic Biol Med,2000;28:351-60.
33 Zhang SM,Hernan MA,Chen H,et al.Intakes of vitamins E and C,carotenoids,vitamin supplements,and PD risk〔J〕.Neurology,2002;59:1161-9.
34 Rebec GV,Barton SJ,Ennis MD.Dysregulation of ascorbate release in the striatum of behaving mice expressing the Huntington's disease gene〔J〕.J Neurosci,2002;22(2):202.
35 Benn CL,Slow EJ,Farrell LA,et al.Glutamate receptor abnormalities in the YAC128 transgenic mouse model of Huntington's disease〔J〕.Neuroscience,2007;147(2):354-72.
36 Rebec GV,Conroy SK,Barton SJ.Hyperactive striatal neurons in symptomatic Huntington R6/2 mice:variations with behavioral state and repeated ascorbate treatment〔J〕.Neuroscience,2006;137(1):327-36.
37 Chaudhuri A,Behan PO.Fatigue and basal ganglia〔J〕.J Neurol Sci,2000;179(2):34-42.
38 康道峰.抗坏血酸对力竭运动大鼠纹状体神经元电活动的影响研究〔D〕.北京:北京师范大学,2011.

