响应面法优化紫甘薯花色苷水解条件
代 凤,毛建霏
1中国石油化工股份有限公司贵州石油分公司,贵阳 550002;2四川省农业科学院分析测试中心农业部食品质量监督检验测试中心,成都 610066
近年来的研究表明,除作为天然色素外,花青素具有多种对人体有益的生理功能,引起人们广泛的关注。花青素在自然界以糖苷化的花色苷形式广泛存在,已鉴定出上千余种。花青素苷元已发现二十余种,常见的仅有六种。紫甘薯富含花青素类色素,主要为酰基化的矢车菊和芍药素糖苷,已鉴定出二十余种花色苷,具有优异的稳定性和有益的生理功能[1]。使用紫外分光光度法可方便地对总花青素含量进行测定,但影响因素较多[2]。采用高效液相色谱法大多是定性分析,直接定量测定需要液质联用等复杂仪器和多种标准品,难以应用于实际检测工作[3]。通过水解多种花色苷为少数花青素苷元,可方便地使用高效液相色谱法对花青素进行准确定性和定量分析[1]。目前仅有通过一次改变一个变量(one variable at a time,OVAT)的方法优化紫甘薯花色苷水解条件的报道,主要影响因素为温度、盐酸浓度和水解时间[1,4]。OVAT优化不仅耗时,并且当影响因素之间有交互作用时,得到的结果往往是局部最优,具有一定的局限性[5]。响应面法同时改变多个变量,以回归方程作为函数估算的工具,考察各因素及其交互作用对响应值的影响,更加准确方便[5]。本文首次使用响应面法对影响紫甘薯花色苷水解的因素进行了考察,采用3因素3水平Box-Behnken中心组合设计,优化了水解时间、盐酸浓度和水解温度对响应值(矢车菊素和芍药素峰面积之和)的综合影响,从而可以使用高效液相色谱法更加准确快速地测定紫甘薯花青素苷元含量。
1 材料与方法
1.1 材料与仪器
1.1.1 供试材料
紫甘薯干粉购于当地市场。
1.1.2 试剂
矢车菊素(Chromadex,标准品,纯度95.7%);芍药素(Chromadex,标准品,纯度92.5%);浓盐酸(西陇化工,优级纯,36% ~38%);乙腈(Fisher Scientific,HPLC 纯);甲酸(TEDIA,HPLC 纯);试验用水均为去离子水。
1.1.3 仪器
Agilent1200高效液相色谱仪,Agilent G1314B多波长紫外检测器;电子天平(Mettler,AE240);试验室超纯化水机(艾科浦,ACD1-2005-U);高速冷冻离心机(湖南星科科学仪器有限公司,TGL-16LM);电子恒温水浴锅(北京中兴伟业仪器有限公司,DZKW);旋涡混合器(上海青浦沪西仪器厂,XW-80A)。
1.2 紫甘薯花色苷水解条件
取紫甘薯干粉样品10 g于250 mL磨口锥形瓶,加入0.1 mol/L盐酸水溶液200 mL,超声提取半小时后8000 rpm离心5 min后取上清液备用。取1.00 mL紫甘薯花色苷提取液于25 mL磨口具刻度比色管,加入一定体积的浓盐酸后用水定容至10.0 mL,涡旋混匀。垂直置于水浴锅中加热,液面高于10mL刻度线。水解一定时间后立即流水冷却,定容至25.0 mL并摇匀。在4℃,8000 rpm离心5 min后,直接取上清液用高效液相色谱仪进行分析。整个水解和冷却过程在室内弱光条件下进行。

图1 矢车菊和芍药素标准溶液(a)及紫甘薯样品(b)的高效液相色谱图Fig.1 HPLC chromatograms of standard solution of cyanidin and peonidin(A)and purple sweet potato sample(B)
1.3 液相色谱条件
色谱柱:waters SunFire C18,5 μm,4.6 × 250 mm;柱温:30℃;检测器及波长:525 nm;流动相条件:1%甲酸/水溶液+1%甲酸/乙腈溶液=82+18(体积比),流速 0.8 mL/min,等度洗脱 10 min。该条件下典型标样和样品色谱图见图1。
1.4 试验设计与数据分析
使用统计软件(Design-Expert 8.0.6)对响应面法优化紫甘薯花色苷水解条件进行试验设计和数据分析。
2 结果与分析
2.1 紫甘薯花色苷水解影响因素及水平选择
已有一些报道证明花青素苷元在强酸条件下能够耐受高温水解[6-8]。国内外少数关于紫甘薯花青素水解条件的报道均为 OVAT 优化[1,4],影响花色苷水解的条件主要因素有水解温度、时间和盐酸浓度[9]。Van-Den Truong等使用 3.6 mol/L 的盐酸,100℃在液相色谱进样瓶中水解60 min[1];毛建霏等使用3 mol/L的盐酸,100℃在磨口锥形瓶中水浴水解60 min[4];在前期的工作中,我们发现盐酸浓度、水解时间和水解温度具有显著地相关性。水解时间随着盐酸浓度和水浴温度的提高缩短。当水浴温度低于100℃时或者需要水解时间小于60 min时,盐酸浓度需要进一步加大。为节约试剂并提高处理通量,使用25 mL比色管而不使用磨口锥形瓶。采用Box-Behnken中心组合设计,选择水解温度、水解时间和浓盐酸浓度3个因素,每个因素3个水平,试验因素及水平见表1。

表1 试验因素及水平设计表Table 1 Independent Variables and Levels for Optimization
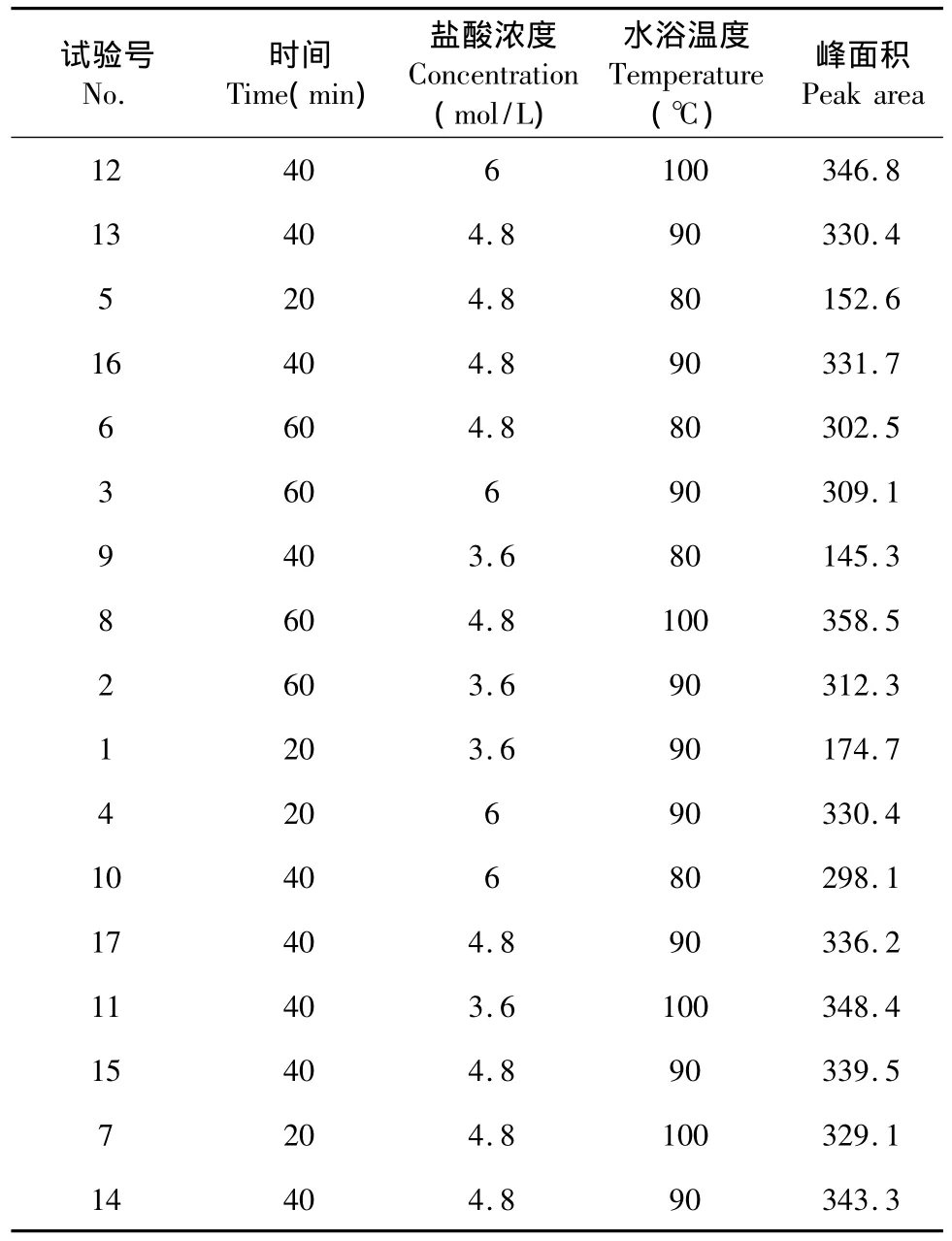
表2 3因素3水平Box-Behnken中心组合设计试验方案及结果Table 2 Experimental design and results of the three-levelthree-variable Box-Behnken central composition design
2.2 响应面分析试验设计方案
矢车菊和芍药素峰面积响应值的变化趋势基本一致[6],因此以 A、B、C 为自变量,以矢车菊和芍药素的峰面积之和为响应值(Y),进行响应面分析试验。试验方案及结果见表2。
2.3 二次响应面回归模型的建立与方差分析
对表2的结果进行二次回归响应面分析,建立多元二次响应面回归模型:
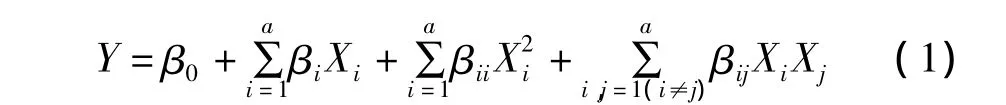
式1中,Y为矢车菊和芍药素的峰面积之和,β0,βi,βii,βij分别为常数项、一次项系数、二次项系数和相关项系数,X1,X2,X3分别对应因素 A,B,C。得出二次方程:
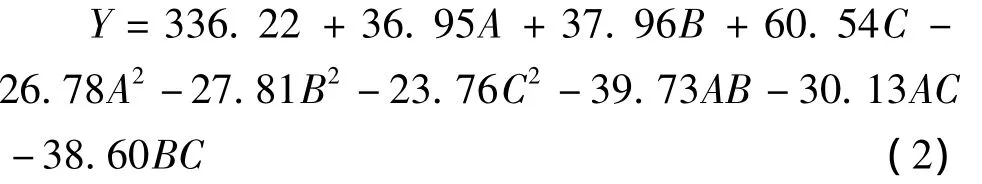
各因素的方差分析见表3。从表3可以看出,模型的 F值为91.40,其是噪音造成的概率小于0.01%,说明该模型是显著的。包括各因素一次项、二次项及其相互间的交互作用项(图2)均为显著(<0.05)。失拟性非显著(>0.05)说明该二次模型对于当前研究是有效的。
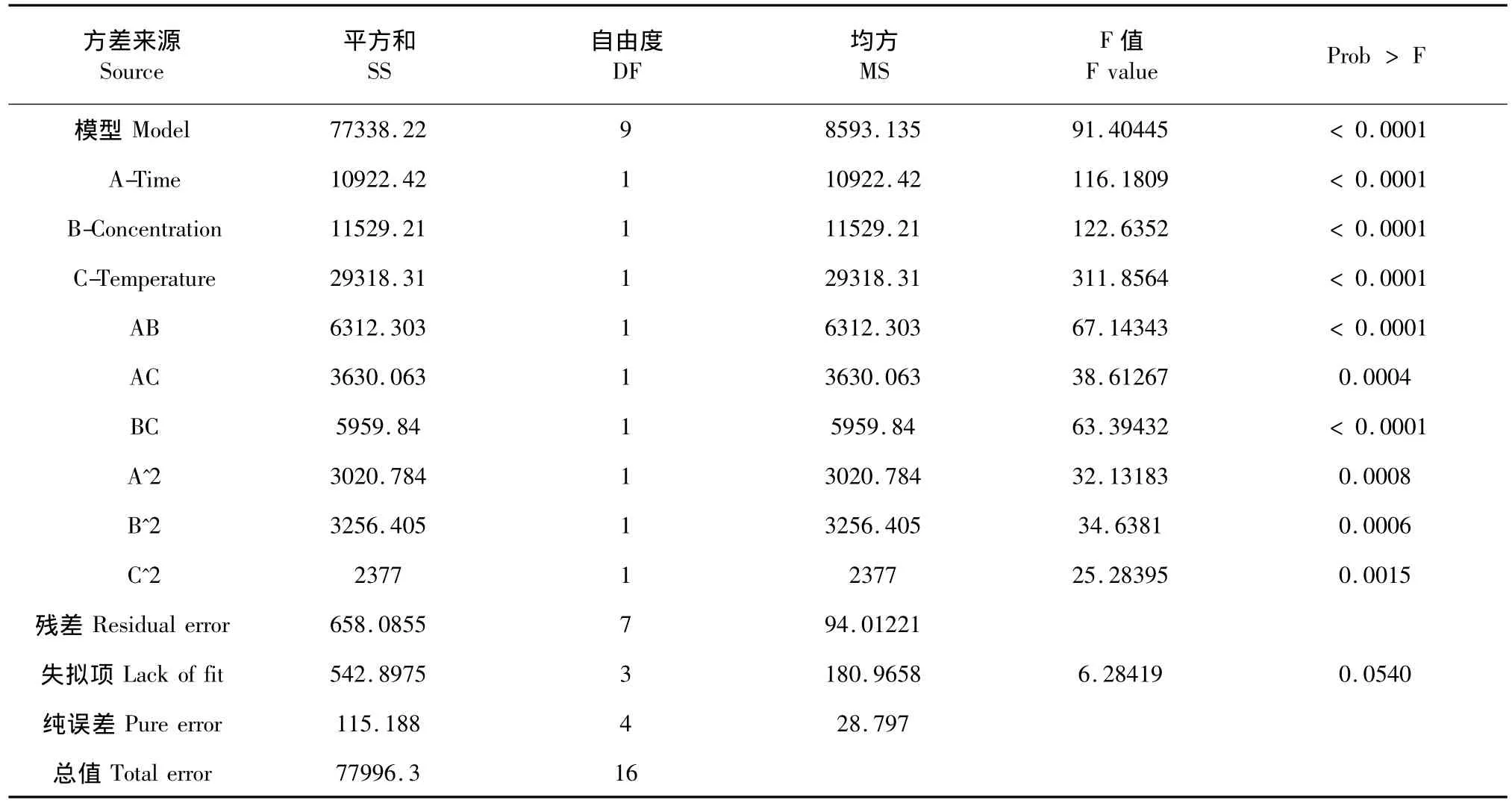
表3 二次响应面回归模型方差分析Table 3 ANOVA for Response Surface Quadratic Model

图2 水解时间(min)、盐酸浓度(mol/L)、水解温度(℃)对紫甘薯花青素峰面积影响的响应面曲线:(a)水解时间和盐酸浓度;(b)水解温度和盐酸浓度;(c)水解时间和水解温度Fig.2 Response surface plots on the sum of peak area of anthocyanidins in PSP as affected by hydrolysis time(min),HCl concentration(mol/L)and hydrolysis temperature(℃):(a)hydrolysis time and HCl concentration at constant hydrolysis temperature;(b)hydrolysis temperature and HCl concentration at constant hydrolysis time;(c)hydrolysis time and hydrolysis temperature at constant HCl concentration
2.4 模型确认
应用响应面设计法优化出最佳水解条件为:时间45.8 min,盐酸浓度 4.54 mol/L,水浴温度 100℃,得到的花青素峰面积预测值为374.1。为验证RSA法的可靠性,在优化条件下进行了3次紫甘薯花色苷水解,得到花青素峰面积值为360.9,为理论预测值的96.5%,RSD=0.77%。为进行比较,也采用前期OVAT优化条件(3 mol/L盐酸,100℃水浴水解60 min)对紫甘薯花色苷进行水解,得到的花青素峰面积值为324.6。RSA法优化得到的条件比前期OVAT优化条件得到的峰面积提高了11%,并且水解时间也有所减少,说明OVAT优化得到的结果只是局部最优。因此将RSA方法应用于紫甘薯花色苷水解优化可以在减少试验次数的同时,得到准确可靠的优化结果。
3 结论
响应面法是研究几种因素间交互作用的回归分析方法,避免了OVAT和正交设计等传统方法只能处理离散的水平值,而无法找出整个区域上因素的最佳组合和响应值的最优值的缺陷。采用3因素3水平Box-Behnken中心组合设计,优化了水解时间、盐酸浓度和水解温度对花青素峰面积之和的综合影响,得到紫甘薯花色苷的最佳水浴水解条件为:水解时间45.8 min,盐酸浓度4.54 mol/L,水浴温度100℃。在最优条件下进行验证试验,响应值为理论值的96.5%,与理论值基本相符,并高于OVAT方法优化得到的结果,说明该响应面法优化方法可行。
1 Truong V,Deighton N,Roger T,et al.Characterization of anthocyanins and anthocyanidins in purple-fleshed Sweetpotatoes by HPLC-DAD/ESI-MS/MS.J Agric Food Chem,2010,58:404-410.
2 Mao JF(毛建霏),Fu CP(付成平),Guo LA(郭灵安),et al.Determination of total anthocyanidins in purple sweet potato by vis spectrophotometry.Food Ferment Technol(食品与发酵科技),2010,46:101-104.
3 Tian Q,Konczak I,Schwartz SJ.Probing anthocyanin profiles in purple sweet potato cell line(Ipomoea batatas L.Cv.Ayamurasaki)by high-performance liquid chromatography and electrospray ionization tandem mass spectrometry.J Agric Food Chem,2005,53:6503-6509.
4 Mao JF(毛建霏),Zhou H(周虹),Lei SR(雷绍荣),et al.Detection of anthocyanins content in purple sweet potato by high performance liquid chromatography.Southwest China J Agric Sci(西南农业学报),2012,25:123-127.
5 Dejaegher B,Heyden YV.Experimental designs and their recent advances in set-up,data interpretation,and analytical applications.J Pharm Biomed Anal,2011,56:141-158.
6 Pinho C,Melo A,Mansilha C,et al.Optimization of conditions for anthocyanin hydrolysis from red wine using response surface methodology(RSM).J Agric Food Chem,2010,59:50-55.
7 Zhang Z,Kou X,Fugal K,et al.Comparison of HPLC methods for determination of anthocyanins and anthocyanidins in bilberry extracts.J Agric Food Chem,2004,52:688-691.
8 Nyman NA,Kumpulainen JT.Determination of anthocyanidins in berries and red wine by high-performance liquid chromatography.J Agric Food Chem,2001,49:4183-4187.
9 Merken HM,Merken CD,Beecher GR.Kinetics method for the quantitation of anthocyanidins,flavonols,and flavones in foods.J Agric Food Chem,2001,49:2727-2732.

